双糖链蛋白聚糖对大肠癌细胞生长作用研究
邢晓静,郑洪新,宋 纯
(1.辽宁省肿瘤医院消化肿瘤科辽宁中医药大学博士后在站,辽宁沈阳,110042 2.辽宁中医药大学,辽宁沈阳,110032;3.辽宁省肿瘤医院,辽宁沈阳,110042)
大肠癌是全球常见的恶性肿瘤,在欧美国家位居致死恶性肿瘤第二位[1],在我国也呈现发病率逐渐上升的趋势。和大多数恶性肿瘤一样,大肠癌的发病机制尚未明确,尽管近年来外科手术技术和化疗手段在不断提高,但大肠癌患者的5年生存率仅为40%,而术后的复发和肿瘤转移成为大肠癌致死的主要原因之一[2],所以,对大肠癌的有效治疗及作用机制研究尤为重要。本课题通过外源添加双糖链蛋白聚糖Biglycan处理大肠癌细胞系HT229和SW480,检测大肠癌细胞凋亡情况和侵袭能力等生物学特征变化,为寻找治疗大肠癌的新靶点提供重要的理论依据。
1 材料与方法
1.1 材料
DMEM培养基、胎牛血清购自 Hyclone公司;大肠癌细胞HT229和SW480购自中科院上海细胞库;Biglycan购自Sigma公司;Matrigel购自BD公司;AV/PI细胞凋亡检测试剂盒、细胞周期检测试剂盒购自碧云天生物技术研究所; Rb、pRb、Ras和 GAPDH抗体购自Santa cruz公司。
1.2 实验方法
1.2.1 细胞培养:大肠癌细胞 HT229和SW480培养于含10%胎牛血清的DMEM培养液中,在37℃、5%CO2、饱和湿度条件下的细胞培养箱中培养。
1.2.2 Transwell法检测Biglycan对大肠癌细胞侵袭能力的影响:按1:7体积比稀释过夜解冻的Matrigel,充分混匀后按每小室 100μL铺胶至Transwell上室内部的膜上,置37℃培育3 h。将Transwell小室放入24孔板中,下室加入含10%胎牛血清的DMEM培养液500μL;取HT229和SW480细胞悬液100μL分别加入上室,细胞数为1×105个/孔,在上室加入Biglycan至终浓度为0、50、100 nmol/L,每个样本重复3次;37℃、5%CO2、饱和湿度条件下培养24 h;取出 Tran2 swell小室,PBS轻轻冲洗;用棉签擦去微孔膜上层的细胞;甲醇室温下固定15 min,苏木素染液染色40 min,蒸馏水冲洗;在倒置显微镜下(200 ×)对侵袭转移至微孔膜下层的细胞计数。每个样本选取5个视野计数细胞个数,取均数。抑制率%=(空白孔细胞数-试验孔细胞数)/空白孔细胞数×100%。
1.2.3 AV/PI染色联合流式细胞术检测Biglycan对大肠癌细胞凋亡情况的影响:以0、100 nmol/L Biglycan处理大肠癌细胞HT229,以0、50 nmol/LBiglycan处理大肠癌细胞SW480 24 h后,胰蛋白酶消化收集细胞,小心吸除上清, PBS漂洗 2次,将细胞重悬于 200μL Binding Buffer,加入10μL Annexin V2FITC和10μL PI,轻轻混匀,避光4℃反应30 min后,加入300μL Binding Buffer,采用流式细胞仪进行上机检测,分析细胞凋亡百分率。
1.2.4 PI染色法联合流式细胞术检测Biglycan处理前后大肠癌细胞周期变化情况:以0、100 nmol/L Biglycan处理大肠癌细胞HT229,以0、50 nmol/LBiglycan处理大肠癌细胞SW480 24 h后,消化、收集各组细胞,小心吸除上清,PBS漂洗,70%乙醇4℃固定过夜,加入碘化丙啶染色液,37℃避光温浴30 min,进行流式检测,分析细胞周期变化情况。
1.2.5 Western Blot法检测细胞内 Rb、pRb和Ras蛋白表达水平以0、100 nmol/L Biglycan处理大肠癌细胞 HT229,以0、50 nmol/L Biglycan处理大肠癌细胞SW480 24 h后,胰蛋白酶消化收集细胞,BCA法进行蛋白质浓度测定,取20μg等量蛋白质进行聚丙烯酰胺凝胶电泳 (SDS2 PAGE),免疫印迹法检测Rb、pRb和Ras蛋白表达变化。
1.2.6 统计学分析:采用SPSS 16.0软件进行数据分析,数据以均数±标准差(±s)表示,组间差异比较采用单因素方差分析。
2 结 果
2.1 Biglycan对大肠癌细胞侵袭能力影响
Biglycan对大肠癌细胞的侵袭转移能力影响如图1所示,Biglycan作用于大肠癌细胞后,细胞侵袭能力受到明显抑制(P<0.05),100 nmol/L Biglycan作用HT229细胞24 h时,侵袭抑制率为66.83%,而50 nmol/L Biglycan作用SW480细胞24 h时,侵袭抑制率即达到60.29%。
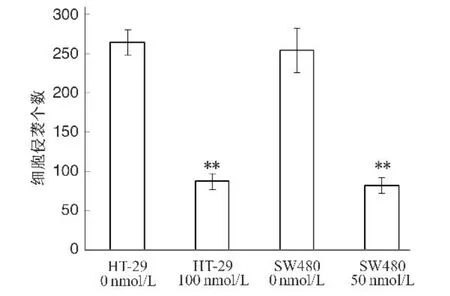
图1 Transwell法检测Biglycan对大肠癌细胞侵袭能力的影响与对照组比较,3P<0.05,33P<0.01
2.2 Biglycan处理前后大肠癌细胞凋亡情况
图2所示为HT229和SW480细胞凋亡检测结果,经Biglycan加药处理后,早期凋亡和晚期凋亡所占比例均有所增加。同时,正常细胞所占比例有所下降,说明在Biglycan作用下,细胞明显出现凋亡情况。
2.3 Biglycan处理前后大肠癌细胞周期变化情况
Biglycan对大肠癌细胞周期变化影响如图3所示,Biglycan作用于大肠癌细胞后,G1期细胞所占比例有所升高,而S期细胞比例呈现下降趋势,说明Biglycan可将细胞周期阻滞于 G1期,从而抑制细胞增殖。
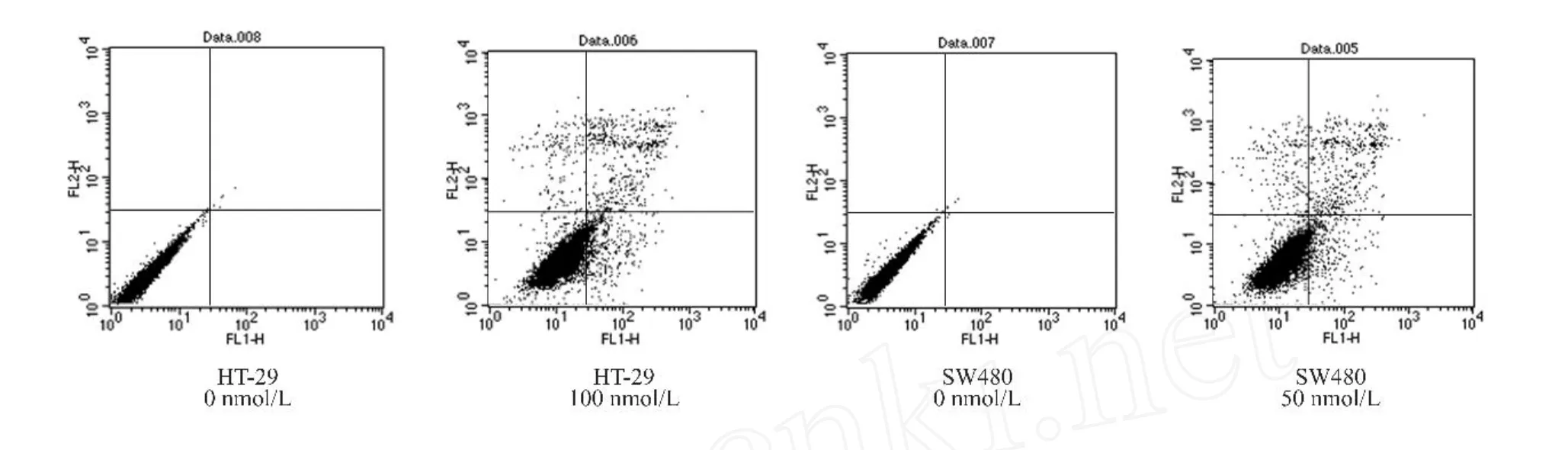
图2 Biglycan对大肠癌细胞凋亡影响
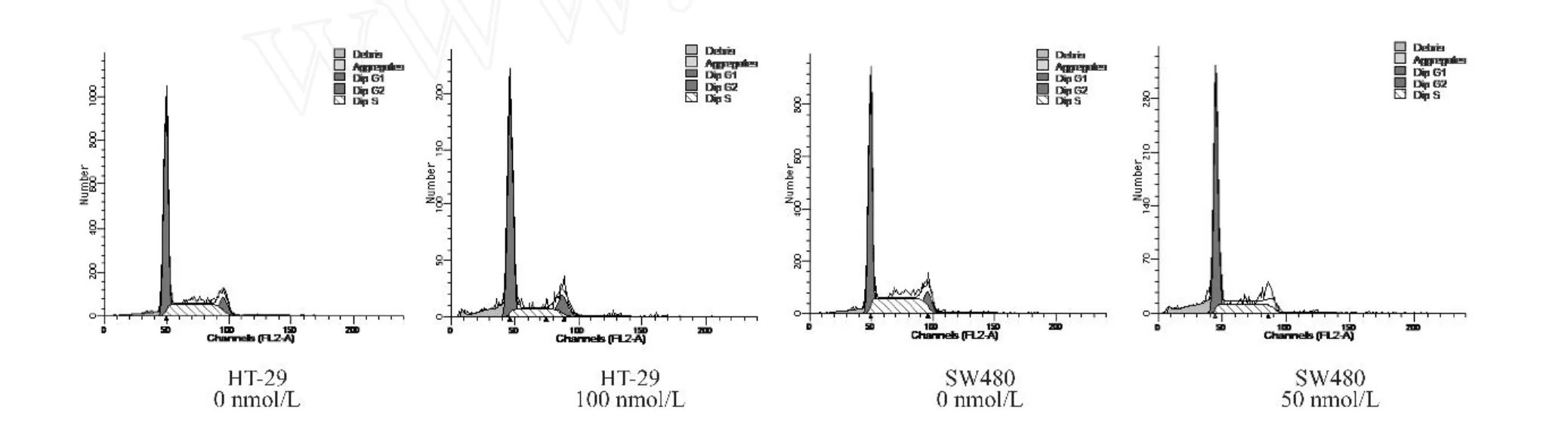
图3 Biglycan对大肠癌细胞周期变化影响
2.4 Biglycan作用下大肠癌细胞HT229和SW480细胞内Rb、pRb和Ras表达水平比较
Western blot结果如图4、5所示,经Biglycan加药处理大肠癌细胞后,细胞内Rb总蛋白无显著性变化,而pRb蛋白表达则有所下降;同时,Ras蛋白也呈现下降趋势。
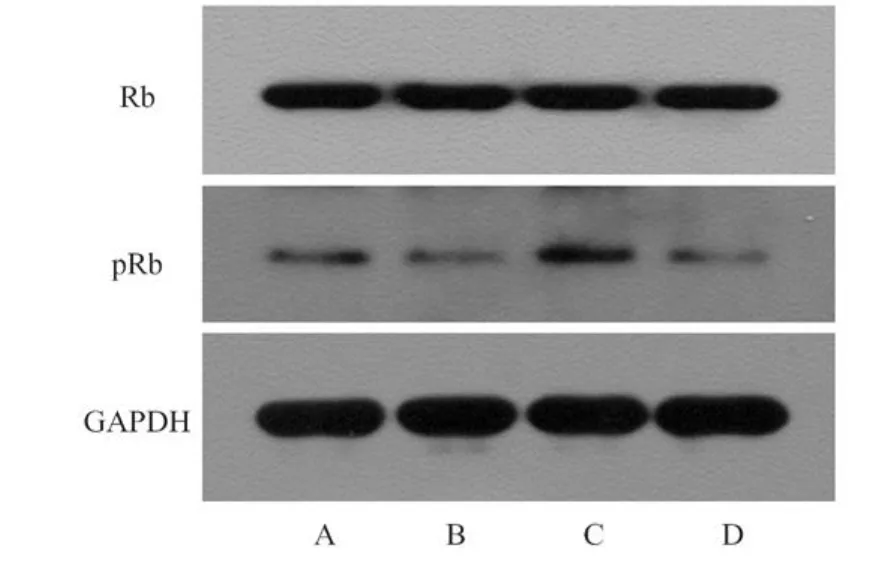
图4 Western blot检测大肠癌细胞Rb及pRb蛋白变化A.HT22920 nnmol/L;B.HT2292100 nnmol/L; C.SW48020 nmol/L;D.SW480250 nmol/L
3 讨 论
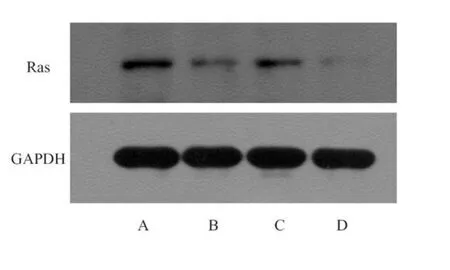
图5 Western blot检测大肠癌细胞Ras蛋白变化A.HT22920 nnmol/L;B.HT2292100 nnmol/L; C.SW48020 nmol/L;D.SW480250 nmol/L
双糖链蛋白聚糖Biglycan是一种重要的细胞外基质组成成分,是SLRP(smallleucine-rich proteoglycan)家族成员之一,Biglycan可以和转化生长因子 2β(t TGF 2β)、胶原分子以及其他基质因子相结合,参与细胞外基质的聚集、细胞迁移与细胞黏附[3],Ge C等研究发现 Biglycan可以使ERK磷酸化来激活转录因子Runx2,从而刺激成骨细胞的表达[4]。已有研究证实Biglycan在肝癌、卵巢癌、牙源性腺样癌和大肠癌中过表达[5-8],另有报道Biglycan高表达与胃癌的淋巴结转移,肿瘤分级,转移,脉管浸润高度相关,高表达Biglycan的患者肿瘤复发率比低表达者高,且生存率低于低表达者[9]。我们的前期研究发现Biglycan在大肠癌中高表达,并且与肿瘤的低分化,淋巴结转移和远处转移呈正相关[10],同时,有研究发现,Biglycan的表达异常与胰腺癌密切相关[11-12],与正常的胰腺组织相比,胰腺癌组织细胞基质外中的Biglycan表达显著上调,同时,外源性的Biglycan可以通过上调p27和下调cyclin A的表达将胰腺癌细胞阻滞在G1期,从而抑制细胞增殖[11]。所以,Biglycan与肿瘤的发生发展联系紧密,但其具体机制尚未明确。
本研究结果显示,Biglycan可显著抑制大肠癌细胞HT229和SW480的侵袭转移能力,同时,在100 nmol/L和 50 nmol/L Biglycan作用下, HT229细胞和SW480细胞均有凋亡情况发生,此外,细胞周期有所改变,G1期细胞所占比例有所升高,而S期细胞比例呈现下降趋势。采用West2 ern blot方法对Biglycan加药处理后的大肠癌细胞内Rb、pRb和Ras蛋白表达水平进行检测,发现细胞内Rb总蛋白无显著性变化,而pRb蛋白表达则有所下降;同时,Ras蛋白也存在下降趋势。Rb蛋白发挥着从 G1到S期限制点的作用,通过与E2F结合,抑制S期基因转录,从而抑制细胞从G1期进入S期,磷酸化作用可使Rb蛋白的功能解除。Ras蛋白是原癌基因cras的表达产物,对细胞的生长、分化、细胞骨架、蛋白质运输和分泌都具有影响。本研究结果中pRb蛋白表达有所下降,说明磷酸化作用后的非功能性Rb蛋白表达下降,功能性Rb蛋白表达增加,使大肠癌细胞阻滞于G1期,从而抑制细胞生长增殖。
[1] Jemal A,Siegel,Ward E,et al.Cancer statistics,2007[J]. CA Cancer J Clin 2007,57:43.
[2] Shi H,Zhou Y,Liu H,et al.Expression of CIAPIN1 in hu2 man colorectal cancer and its correlation with prognosis[J]. BMC Cancer 2010,10:477.
[3] Groth S,Schulze M,Kalthoff H,et al.Adhesion and Rac1-dependent regulation of Biglycan gene expression by trans2 forming growth Factor-β[J].J Biol Chem,2005,280(39): 33190.
[4] Ge C,Xiao G,Jiang D,et al.Identification and functional characterization of ERK/MAPK phosphorylation sites in the Runx2 transcription factor[J].J Biol Chem,2009,284(47): 32533.
[5] Nishino R,Honda M,Yamashita T,et al.Identification of novel candidate tumour marker genes for intrahepatic cholan2 giocarcinoma[J].J Hepatol,2008,49(2):207.
[6] Pan S,Cheng L,White J T,et al.Quantitative proteomics analysis integrated with microarray data reveals that extracel2 lular matrix proteins,catenins,and p53 binding protein 1 are important for chemotherapy response in ovarian cancers[J]. OMICS,2009,13(4):345.
[7] Modolo F,Biz M T,Martins M T,et al.Expression of ex2 tracellular matrix proteins inadenomatoid odontogenic tumor [J].J Oral Pathol Med,2010,39(3):230.
[8] Mikula M,Rubel T,Karczmarski J,et al.Integrating pro2 teomic and transcriptomic high-throughputsurveys for search of new biomarkers of colon tumors[J].Funct Integr Genomics,2010,34:126.
[9] Wang B,Li G X,Zhang S G,et al.Biglycan expression cor2 relates with aggressiveness and poor prognosis of gastric cancer [J].Exp Biol Med,2011,236(11):1247.
[10] Gu Xiaohu,Ma Yegang,Xiao jingdong,et al.Up-regulated biglycan expression correlates with the malignancy in human colorectal cancers[J].Clin Exp Med,2011.DOI 10.1007/ s10238-011-0155-4.
[11] Weber CK,Sommer G,Michl P,et al.Biglycan is overex2 pressed in pancreatic cancer and induces G1-arrest in pancre2 atic cancer cell lines[J].Gastroenterology,2001,121:657.
[12] Chen W B,Lenschow W,Tiede K,et al.Smad4/DPC4-dependent regulation of biglycan gene expression by trans2 forming growth factor-beta in pancreatic tumor cells[J].J Biol Chem,2002,277:36118.

