稀有人参皂苷IH901在体内外的生物转化及其生物活性
童宇星,郑志忠,童庆宣,林毅,明艳林
1 华侨大学化工学院,福建 厦门 361021
2 厦门华侨亚热带植物引种园 药用植物与植物药研发中心 厦门市植物引种检疫与植物源产物重点实验室,福建 厦门361002
人参Panax ginseng C.A. Meyer是我国传统名贵中药,具有抗肿瘤、抗炎、抗糖尿病和抗衰老等多种疗效,其主要活性成分为人参皂苷。目前已经从人参科属植物中分离出 60多种人参皂苷单体,而且还有一些新单体被不断发现[1-2]。按照其苷元上糖基位置及数量的不同,人参皂苷可分为 3类:第 1类为 20(S)-原人参二醇型(20-S-Protopanaxadiol) 人参皂苷,如人参皂苷Rb1、Rb2、Rc、Rd、Rh2等;第2类为20(S)-原人参三醇型 (20-S-Protopanaxatriol) 人参皂苷,如人参皂苷Re、Rf、Rg1、Rg2、Rh1等;第3类为齐墩果酸型 (Oleanolic acid) 人参皂苷,如人参皂苷R0、Rh3等[2]。其中二醇型和三醇型皂苷占人参皂苷的大多数,目前被认为是人参的最主要的活性成分。最新药理学研究表明,人参发挥其多种作用的最终有效活性物质并不是天然人参皂苷,而是天然人参皂苷的一系列肠道菌代谢产物,这些产物均具有多种特殊的药理活性。
人参皂苷肠道菌代谢产物 20-O-β-D-吡喃葡萄糖苷-20(S)-原人参二醇 (简称 IH901,Compound K或M1,如图1所示) 为天然二醇型人参皂苷在肠道细菌作用下的最终代谢产物,是人参皂苷发挥各种作用的最终主要活性形式之一,因此具有极大的药用价值和应用前景。然而,迄今为止,有关IH901各方面的研究尚处于探索阶段,文中就国内外对该化合物的体内外生物转化及其生物活性的研究进行综述,为IH901的深入研究提供参考和思路。

图1 IH901的化学结构[5]Fig. 1 Chemical structure of IH901[5].
1 人参皂苷IH901的体内转化
长期以来,人们一直认为人参中的天然二醇型人参皂苷 Rb1、Rc、Rh2和天然三醇型人参皂苷Rg1等是人参最终的主要活性物质,但是随着现代分析测试技术和先进仪器的发展,最新人参代谢组学的研究才发现,人参口服后最终进入血液循环,并发挥活性作用的物质是人参皂苷在肠道中由肠道微生物代谢产生,而在天然人参中并不存在的系列人参皂苷肠道代谢产物。其中Hasegawa等[3]的研究最具代表性,该研究揭示口服的人参皂苷在经过胃和小肠时无法被胃液和肝酶分解,只有进入大肠去糖基化后才能进入循环系统并被吸收。
1.1 人参皂苷的体内代谢
人参皂苷肠道代谢的途径是在多种肠道微生物协同作用下降解,如口普氏菌 Prevotella oris[4]、真细菌Eubacterium sp. A-44[5]、双歧杆菌Bifidobacterium K-506[6]、拟杆菌 Bacteroides JY-6[6]和梭杆菌 Fusobacterium K-60[6]等。首先,体内肠道菌从糖端阶梯式地切开低聚糖与糖苷配基的连接,20(S)-原人参二醇型的代谢产物为IH901 (M1)、CY、Mc、F2、M6、M7、Gp-XVⅡ和Gp-LXXV,其中IH901为其最终代谢产物;20(S)-原人参三醇型代谢物为 20(S)-原人参三醇(M4),Rh1和F1,其中M4为最终代谢产物,如图2和表1所示。然后,最终代谢产物IH901 (M1)和20(S)-原人参三醇 (M4) 进一步与脂肪酸酯化形成EM1和EM4,脂肪酸化的EM1和EM4仍具有分子活性,而且在体内比亲本代谢物存留时间更久。总之,人参皂苷在人体内经过肠道菌的去糖基化后成为有活性的物质,并被肝脏内的脂肪酸酯化作用后持续发挥作用。Akao等[5]将人体内能够代谢 Rb1的肠道菌株 Eubacterium sp. A-44植入到无菌大鼠,形成悉生动物模型,比较其与无菌动物口服Rb1(200 mg/kg) 后血浆、胃肠道及排泄物中Rb1和IH901的差异,结果证实Rb1在肠道中的吸收很少,只是一个“天然前药”,IH901才真正被吸收和发挥活性作用的实体。
1.2 人参皂苷IH901的体内转化
20(S)-原二醇型人参皂苷肠道内转化的主要活性产物为IH901,其中,肠道菌将Rb1代谢成IH901的途经研究的较为清楚,整个过程是分步进行的。首先,人参皂苷Rb1在C-20位的末端糖苷键断裂,脱去一分子葡萄糖,形成人参皂苷Rd。然后,人参皂苷Rd在C-3位上的末端糖苷键断裂,失去一分子葡萄糖,形成人参皂苷F2,进一步代谢C-3位上糖苷键断裂,失去一分子葡萄糖,形成了代谢物IH901,经长时间的酶解 (15 d以上),代谢物IH901在C-20位上的糖苷键断裂,脱去最后一分子葡萄糖,形成20(S)-原人参二醇 (PPD)。在整个酶解体系中,各代谢产物的量会此消彼长,处于一个动态变化过程中,最终的产物中代谢物 IH901最多,其次是人参皂苷Rd,少量的PPD,极少量的人参皂苷F2[7-10],其转化过程如图3所示。

图2 人参皂苷的化学结构[3]Fig. 2 Chemical structure of Ginsenoside[3].

表1 人参皂苷及其肠道代谢物[3]Table 1 Ginsenoside and the chemical structure of its intestinal metabolites[3]
2 人参皂苷IH901的体外生物转化
近年来,鉴于稀有人参皂苷IH901作为药物开发的潜力及其广阔的市场前景,如何通过体外酶转化和微生物转化等生物工程技术大规模提取制备IH901已成为业内研究的热点。随着最新人参体内代谢组学的深入研究,人们发现非天然的人参皂苷 IH901也可由其他二醇型人参皂苷转化而来,同时人参皂苷四环三萜母核结构上3位和 20位糖苷键的特异性决定常用的酸或碱水解方法相对较难获得IH901,但可以通过体外酶转化和微生物转化等生物转化法提取制备。目前,一般都是以人参和三七为原料,先制备出二醇型人参皂苷,然后在体外通过糖苷键酶和可以分泌该类酶的微生物转化获得。
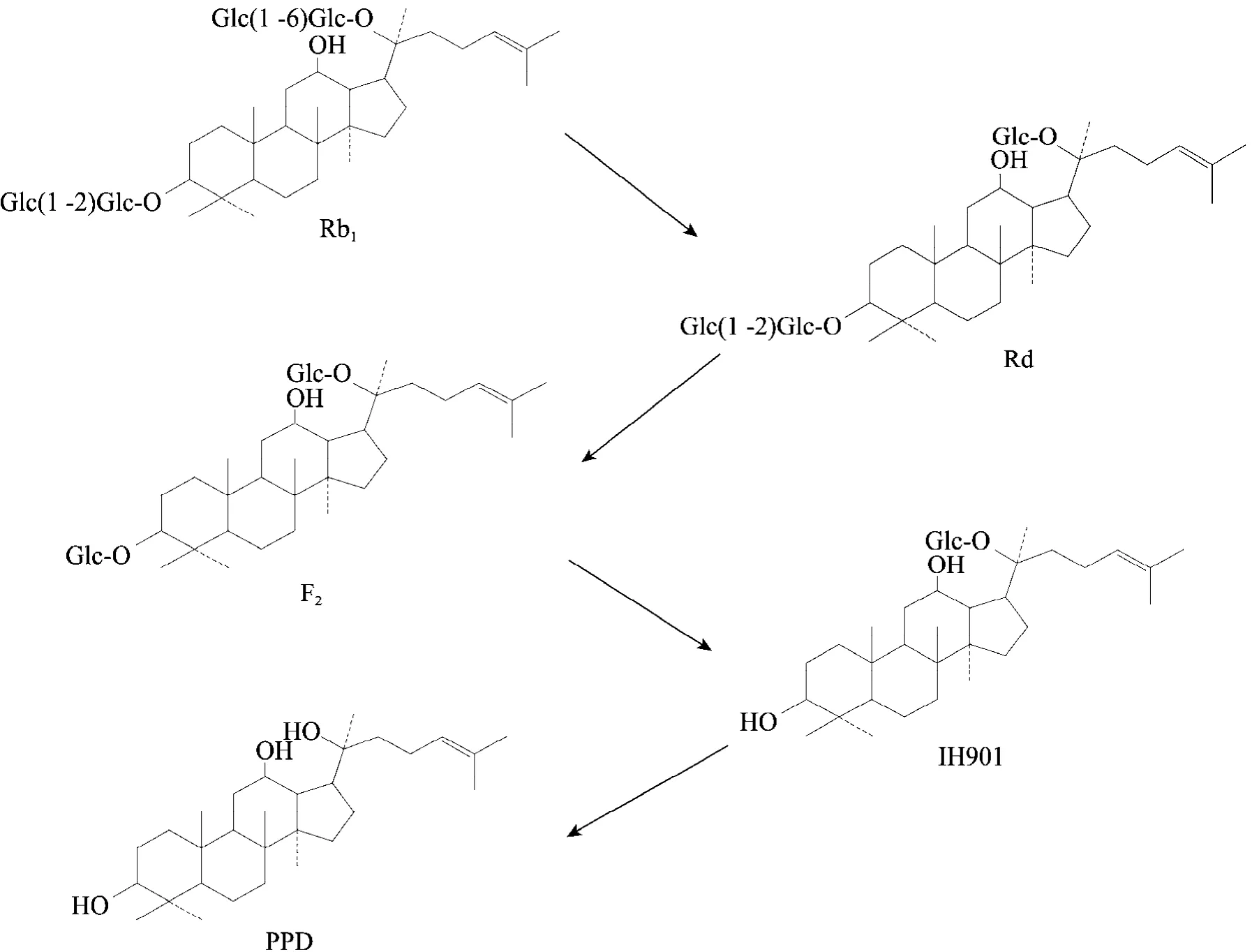
图3 稀有人参皂苷IH901的体内转化[7-10]Fig. 3 Biotransformation in vivo of rare ginsenoside IH901 [7-10].
2.1 IH901的体外酶法转化
酶转化法的优点在于流程短、专一性强、产物易分离纯化。目前用于制备人参皂苷IH901的酶主要是工业酶制剂,国外主要采用柚苷酶、果胶酶、纤维素酶及乳糖酶转化二醇型人参皂苷混合物来制备IH901[11-12]。将人参根部粗提物酶转化为IH901的方法有很多,Kim等[9]使用黑曲霉的果胶酶,Yu等[13]使用曲霉属真菌 Aspergillus的β-糖苷酶,Ko等[14]使用青霉菌Penicillium的乳糖酶和米曲霉的β-牛乳糖酶,均能成功将人参根部粗提物转化为人参皂苷IH901。国内学者严钦等[15]研究发现从拟青霉属真菌Bainer sp. 229中分离的β-葡萄糖苷酶能有效地将人参皂苷Rb1转化为IH901。本实验室[16]采用蜗牛酶转化三七的二醇型皂苷来制备人参皂苷IH901。有研究者直接从具有转化活性的菌株中分离专一性更强的转化酶。如从食用微生物 Bifidobacterium sp. Int-57和Bifidobacterium sp. SJ-32中提取的粗酶,可转化人参皂苷Rb1,Rb2和Rc制备IH901[7-8]。从人肠道菌Fusodobacterium K-60分离纯化的四聚体 β-葡萄糖苷酶,也能直接转化 Rb1生成IH901[17]。这些方法往往存在酶的用量大、来源困难、底物成本较高等缺点,因而比较少见于工业化生产。
2.2 IH901的体外微生物转化
相对于酶法转化而言,微生物转化的优点在于可以通过发酵罐进行大规模提取制备,而且可以重复使用,更容易实现工业化生产,因此更受业界的青睐。目前用于转化IH901的微生物主要是厌氧菌,如口普氏菌 Prevotella oris[4]、Eubaceteria sp. A-44[5]等,其他微生物研究的相对较少。Hasegawa等[18]运用体外厌氧培养人肠道菌群技术,对人参皂苷的肠道菌代谢过程进行了系统研究,提出了Rb1、Rb2和Rc降解到IH901的具体代谢途径 (图4),对人参皂苷在体内转化生成的研究起到了重要的作用。
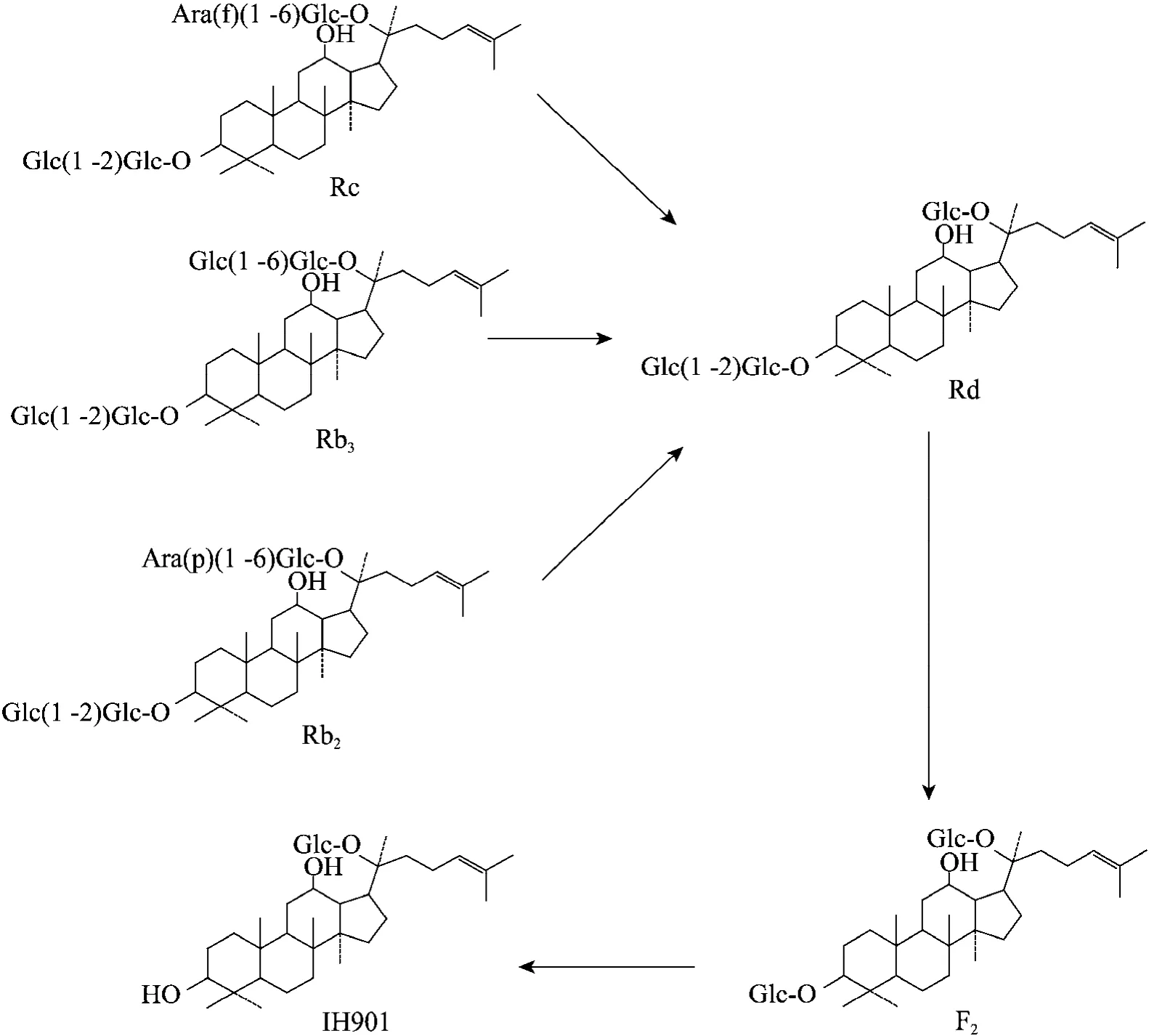
图4 人参皂苷IH901由人肠道微生物的代谢途径[18]Fig. 4 Specific metabolic pathway of ginsenoside IH901 by human intestinal bacteria[18]. First, the glycosidic bond of Rb1, Rb2, Rc at C-20 site are broken, lose one glucose to form Rd; then the glycosidic bond of Rd is broken at C-3 site, loses one glucose to form F2; in the end, the glycosidic bond of F2 is broken at C-3 site, loses one glucose to form IH901.
Bae等[19]采用肠道乳酸菌转化二醇型皂苷制备IH901,结果发现运用双歧杆菌Bifidobacterium minimum KK-1和豚双歧杆菌B. choerinum KK-2共发酵转化Rb1时效果最好,转化率达到41%左右。周伟等[20]从野山参土样分离筛选到了高转化活性拟青霉菌株Bainier sp. 229,通过菌种诱变和发酵工艺优化,选用二醇型三七茎叶总皂苷作为底物转化生成 IH901。陈广通等[21]用点枝顶孢 Acremonium strictum转化Rb1产生的5种已知代谢物中含有IH901,在Rb1添加到点枝顶孢培养物后的第 6天,IH901含量达到最大值。韩颖等[22]研究甘蔗镰孢霉Fusarium sacchari转化三七叶皂苷提取物的Rb1、Rb3、Rc的转化效果,发现甘蔗镰孢霉能将Rb1和Rc转化为IH901,具体途径如图5所示。

图5 Rb1 (A) 和 Rc (B)被Fusarium sacchari转化的途径[22]Fig. 5 Transform pathway of Rb1 (A) and Rc (B)by Fusarium sacchari[22].major transform pathway; minor transform pathway.
3 人参皂苷IH901的生物活性
最新药理药效学研究表明,人参皂苷IH901是人参在体内发挥活性作用的最终主要活性成分之一,其在抗肿瘤、抗炎、抗糖尿病和抗衰老等方面均具有良好的活性作用,尤其在抗癌活性方面显示出显著的抑制肿瘤细胞增殖生长、诱导凋亡和抑制侵袭转移的活性作用,而且其不良反应低。因此,人们普遍认为IH901具有极佳的药物开发潜力,尤其具有抗癌新药研发的前景。
3.1 抗肿瘤活性
最近体外药理药效学研究表明,IH901能诱导B16-BL6、HL-60、HepG2、U937、ECV304、SMMC7721、MHCC97-H和SV-40转染的大鼠星状肝细胞等多种肿瘤细胞凋亡,并能抑制肿瘤细胞的侵袭转移作用[23-32]。IH901抑制人纤维肉瘤HT1080细胞对基底膜的侵袭能力,比细胞结合素功能抑制多肽 (RGDS peptide,阳性对照药物)强1 000倍[33]。人参总提取物和人参皂苷都能明显地抑制 B16-BL6黑色素瘤细胞在小鼠体内的肺转移,但却不能在体外抑制B16-BL6黑色素瘤细胞和HT1080纤维肉瘤细胞的侵袭与转移,而IH901却能在无毒或微毒浓度下在体内抑制黑色素瘤肺转移和在体外抑制肿瘤细胞侵袭转移[34]。本实验室[35]研究 IH901对人肝癌细胞株BEL7402增殖抑制作用时发现,IH901能明显抑制 BEL7402细胞的生长,通过细胞形态进一步分析发现IH901作用BEL7402细胞后出现了大量的凋亡细胞,表明这种抑制作用是诱导细胞凋亡而非细胞毒作用引起的细胞坏死。IH901在体外与常用的抗肝癌药物,如环磷酰胺 (CTX)、5-氟尿嘧啶 (5-FU)、顺铂 (cDDP) 联合用药能提高其药效,表明其对抗肝癌药物具有增敏作用[36]。
在分子水平上,IH901作用于 HepG2细胞后,线粒体膜电位的下降和线粒体内的细胞色素c释放到胞质,Caspase-3、Caspase-8和Caspase-9的活化,P53和Bax表达水平提高,ADP核糖聚合酶 (PARP) 的水解作用增强,这些结果证明了 IH901诱导的细胞凋亡受到线粒体通路的调节[30]。IH901能引起肿瘤细胞发生细胞周期阻滞,从而抑制细胞增殖 IH901通过上调 P21 (Cyclin-CDK复合物的抑制蛋白),抑制Cyclin D、CDK4和Cyclin E的活化,诱导JNK和转录因子P21的活化,从而引起U937G1期阻滞[37]。
3.2 抗炎活性
Shin等[38]运用 唑酮诱导的慢性小鼠耳炎症模型研究了 IH901的抗炎活性。结果发现,0.05%倍他米松 ( 唑酮致炎前30 min及致炎后3 h,各耳缘注射20 μL) 的抑制率达到了84%,同剂量 IH901的抑制率也达到了 76%,显示相当好的抗炎活性。Lee等[39]对IH901的抗炎活性机制进行了深入研究,他们以 12-O-2十四烷酰佛波-13-醋酸酯 (TPA) 诱导建立了小鼠皮肤发炎模型,研究了IH901对多种蛋白表达的影响。实验发现,IH901下调了ERK和Akt蛋白的表达,从而阻断了NF-κB的活性,同时抑制了TPA诱导的cox-2基因激活物AP-1的活性,最终抑制cox-2的表达,并且IH901能有效抑制TPA诱导产生的PGE2 (前列腺素E2),使其恢复到正常水平,从而达到了抗炎和抑制肿瘤增生的目的。
3.3 抗糖尿病
糖尿病是一种严重影响生活质量和生命健康的疾病,控制好血糖是有效治疗糖尿病的方法,而IH901已被研究证实能有效控制血糖。Xie等[40]给予ob/ob鼠 (具有高血糖、糖耐量受损、肥胖等特征,与人类2型糖尿病表型相似) 每天腹腔注射100~200 mg/kg或口服150~300 mg/kg人参总皂苷12 d。结果表明,接受人参总皂苷的小鼠空腹血糖较对照组明显下降。研究表明,2型糖尿病通常伴随着 β细胞的凋亡,而 SAPK (Stress-activated protein kinase)/JNK (c-Jun N-terminal kinase) 调控凋亡的产生。Kim 等[41]发现,IH901通过调控SAPK/JNK的活化来抑制棕榈酸盐诱导的细胞凋亡,表明其具有抗糖尿病的作用。为了研究IH901抗糖尿病的作用机理,Yoon等[42]比较了IH901和二甲双胍的治疗效果,同时比较了 IH901单独使用和与二甲双胍联用的治疗效果,发现 IH901能通过提高胰岛细胞HIT-T15的胰岛素分泌水平来降低血糖,其作用机制可能是阻断了ATP敏感的K+通道。此外,IH901与二甲双胍的联用比二者单独使用更能显著降低血糖并能有效抵抗胰岛素耐受现象。
3.4 抗衰老和提高记忆力
近代研究认为,衰老是机体各种生化反应的综合表现,是体内外许多因素 (环境污染、精神紧张、遗传等) 共同作用的结果。透明质酸(Hyaluronic acid,HA) 的含量和新陈代谢随着人类皮肤成熟和老化过程而变化,它可以改善皮肤营养代谢,使皮肤柔嫩、光滑、去皱、增加弹性、防止衰老,在保湿的同时又是良好的透皮吸收促进剂。Kim等[43]发现IH901能改善皮肤的衰老状况,他们以人用生化表皮细胞 HaCaT细胞作为模型研究,在基因水平研究IH901对延缓皮肤老化的机制,发现细胞经IH901作用后,透明质酸合成酶2 (HAS2) 基因的变化最明显。裸鼠皮肤试验证实,IH901可显著增加表皮和乳突状真皮中的 HA含量,表皮厚度明显增加,局部使用IH901可以延缓皮肤出现干燥、皱纹等老化现象。Tohda等[44]以 β-淀粉样蛋白诱导的早老性痴呆(Alzheimer’s disease,AD) 小鼠模型研究IH901对记忆损伤的修复作用,结果显示IH901能明显提高大脑皮层和海马回路中神经丝蛋白NF-H和突触素水平,促进轴突伸展,逆转轴突神经炎性萎缩及突触缺失,从而改善AD患者的记忆障碍。
3.5 其他生物活性
IH901具有一定的抗过敏功效。Choo等[45]研究表明,IH901抑制老鼠嗜碱性白血病细胞RBL-2H3释放过敏物质 β-氨基己糖苷酶的能力是传统抗过敏药色甘酸二钠的 22倍;抑制大鼠腹膜肥大细胞释放组胺的活性更是色甘酸二钠的45倍,而且其细胞毒性很小 (EC50>0.2 mmol/L)。ICR小鼠的被动皮肤过敏反应实验显示,IH901 (25 mg/kg) 的抑制率达到了98%,是同剂量下色甘酸二钠的6.5倍,也优于抗组胺药氮卓斯汀。Shin等[46]发现,在用化学药物Compound 48/80 (N-甲基-对甲氧基苯乙胺和甲醛缩合产生的聚合物) 诱发皮肤搔痒之前口服IH901能减轻瘙痒,从而发现IH901具有抗搔痒作用。另外,IH901也能在一定程度上保护肝脏。Lee等[47]在体外实验中研究发现,IH901能有效减轻或抑制叔丁基过氧化氢 (TBHP) 诱导的 HepG2细胞损伤症状。而在体内实验中,将IH901口服或腹膜注射,然后检测小鼠体内的血清丙胺酸转氨酶 (ALT)、天冬氨酸转氨酶 (AST) 含量,结果也表明IH901有效抑制TBHP诱导后老鼠血浆中ALT和AST的增加,表明IH901具有一定的保肝护肝效果。
4 展望
稀有人参皂苷IH901是天然的20(S)-原二醇型人参皂苷在人肠道内的代谢产物,是人参在体内发挥活性的物质基础之一。生物活性研究表明IH901是一个多靶点、高活性的化合物,鉴于其良好的药学活性和应用价值,发现并研究其代谢具体过程及其体外生物转化途径具有重大意义,因此,进一步发现IH901新的代谢途径,新的代谢微生物或酶,以及IH901新的生物活性及其作用分子机理,均是该领域未来继续研究的重点和热点。在体内转化研究方面,我们推测除Rb1外,其他二醇型皂苷均能不同程度转化为IH901,但其代谢过程和代谢机理仍有待深入研究。另外,不同年龄的人和不同人种之间的人体内肠道菌落是有差异,因此比较研究不同的人口服人参后的代谢组学,可从理论上揭示不同的人服用人参后的效果差异原因。在体外生物转化方面,首先由于大部分转化人参皂苷的微生物都是不可食用的,为了使人参皂苷及其转化产物能更安全的使用,发现并研究能转化人参皂苷的可食用微生物将是人参皂苷微生物转化的一个重要方向,本实验室已经尝试筛选人参和三七的内生菌进行转化的研究。另外由于目前普遍使用人参和三七作为原料进行转化,而二者不仅昂贵而且来源有限,因此寻找新转化原料替代是我们未来考虑的重点,本实验室已经开始尝试使用富含二醇型皂苷的“南方人参”绞股蓝作为原料进行体外转化,并已经取得突破。在生物活性研究方面,因其高效低毒的特性值得引起研究者的重视并进行更加深入研究,尽管IH901在抗肿瘤、抗炎、降血糖和抗衰老等多个方面表现了良好的活性,但目前 IH901的研究主要集中在动物的体内或体外实验,临床研究的报道并不多见,而且IH901某些活性的作用机理并没有研究得很透彻,说明人参皂苷 IH901的活性研究和临床应用还有待深入研究。
[1] Attete AS, Wu JA, Yuan CS. Ginseng pharmacology: multiple constituents and multiple actions. Biochem Pharmacol, 1999, 58(11): 1685−1693.
[2] Chen YJ, Dou DQ, Zhao CJ, et al. New ingredients, activity and quality standardization research of ginseng. Gins Res, 2002, 14(1): 2−19.陈英杰, 窦德强, 赵春杰, 等. 人参的新成分、新活性和质量规范化研究. 人参研究, 2002, 14(1): 2−19.
[3] Hasegawa H. Proof of the mysterious efficacy of ginseng: basic and clinical trials: metabolic activation of ginsenoside: deglycosylation by intestinal bacteria and esterification with fatty acid. J Pharmacol Sci, 2004, 95(2): 153−157.
[4] Hasegawa H, Sung JH, Benno Y. Role of human intestinal Prevotella oris in hydrolyzing ginseng saponins. Planta Med, 1997, 63(5): 436−440.
[5] Akao T, Kida H, Kanaoka M, et al. Intestinal bacterial hydrolysis is required for the appearance of compound K in rat plasma after oral administration of ginsenoside Rb1from Panax ginseng. J Pharm Pharmacol, 1998, 50(10): 1155−1160.
[6] Bae EA, Choo MK, Park EK, et al. Metabolism of ginsenoside Rcby human intestinal bacteria and its related antiallergic activity. Biol Pharm Bull, 2002, 25(6): 743−747.
[7] Chi H, Ji GE. Transformation of ginsenosides Rb1and Re from Panax ginseng by food microorganisms. Biotechnol Lett, 2005, 27(11): 765−771.
[8] Chi H, Kim DH, Ji GE. Transformation of ginsenosides Rb2and Rc from Panax ginseng by food microorganisms. Biol Pharm Bull, 2005, 28(11): 2102−2105.
[9] Kim BH, Lee SY, Cho HJ, et al. Biotransformation of Korean Panax ginseng by pectinex. Biol Pharm Bull, 2006, 29(12): 2472−2478.
[10] Cheng LQ, Kim MK, Lee JW, et al. Conversion of major ginsenoside Rb1to ginsenoside F2by Caulobacter leidyia. Biotechnol Lett, 2006, 28(14): 1121−1127.
[11] Jang IS, Kang HH, Kim DH. Preparing compound K and ginsenoside F1from saponin of ginseng comprises dissolving purified saponin of ginseng in an aqueous solvent and adding naringinase and/or pectinase into the saponin solution: KR, 2003037005-A. 2003-05-12.
[12] Cho BG, Choi GJ, Kim YH. Method of preparing ginsenoside compound K using cellulase or lactase composition y-ao: KR, 2003043168-A. 2003-06-02.
[13] Yu HS, Zhang CZ, Lu MC, et al. Purification and characterization of new special ginsenosidase hydrolyzing multi-glycisides of protopanaxadiol ginsenosides, ginsenosidase type I. Chem Pharm Bull, 2007, 55(2): 231−235.
[14] Ko SR, Suzuki Y, Suzuki K, et al. Marked production of ginsenosides Rd, F2, Rg3, and compound K by enzymatic method. Chem Pharm Bull, 2007, 55(10): 1522−1527.
[15] Yan Q, Zhou W, Shi XL, et al. Biotransformation pathways of ginsenoside Rb1to compound K by β-glucosidases in fungus Paecilomyces bainier sp. 229. Process Biochem, 2010, 45(9): 1550−1556.
[16] Tong QX, Chen LH, Ming YL, et al. Study on enzymatic transformation and preparation of rare ginsenoside IH901. Nat Prod Res Dev, 2009, 21(6): 1039−1044.童庆宣, 陈良华, 明艳林, 等. 稀有人参皂苷IH901酶法转化与制备研究. 天然产物研究与开发, 2009, 21(6): 1039−1044.
[17] Park SY, Bae EA, Sung JH, et al. Purification and characterization of ginsenoside Rb1-metabolizing β-glucosidase from Fusobacterium K-60, a human intestinal anaerobic bacterium. Biosci Biotechnol Biochem, 2001, 65(5): 1163−1169.
[18] Hasegawa H, Sung JH, Matsumiya S, et al. Main ginseng saponin metabolites formed by intestinal bacteria. Planta Med, 1996, 62(5): 453−457.
[19] Bae EA, Kim NY, Han MJ, et al. Transformation of ginsenosides to compound K (IH-901) by lactic acid bacteria of human intestine. J Microbiol Biotechnol, 2003, 13(1): 9−14.
[20] Zhou W, Luo ZS, Zhou P. Determination of ginsenoside compound-K by reversed-phase high performance liquid chromatography. Chin J Chromatogr, 2005, 23(3): 270−272.
[21] Chen GT, Yang M, Song Y, et al. Microbial transformation of ginsenoside Rb1by Acremonium strictum. Appl Microbiol Biotechnol, 2008, 77(6): 1345−1350.
[22] Han Y, Sun B, Jiang B, et al. Microbial transformation of ginsenosides Rb1, Rb3and Rc by Fusarium sacchari. J Appl Microbiol, 2010, 109(3): 792−798.
[23] Kang KA, Lim HK, Kim SU, et al. Induction of apoptosis by ginseng saponin metabolite in U937 human monocytic leukemia cells. J Food Biochem, 2005, 29(1): 27−40.
[24] Yim HW, Jong HS, Kim TY, et al. Cyclooxygenase-2 inhibits novel ginseng metabolite-mediated apoptosis. Cancer Res, 2005, 65(5): 1952−1960.
[25] Choi HH, Jong HS, Park JH, et al. A novel ginseng saponin metabolite induces apoptosis and down-regulates fibroblast growth factor receptor 3 in myeloma cells. Int J Oncol, 2003, 23(4): 1087−1093.
[26] Park EJ, Zhao YZ, Kim J, et al. A ginsenoside metabolite, 20-O-β-D-glucopyranosyl-20(S)-protopanaxadiol, triggers apoptosis in activated rat hepatic stellate cells via Caspase-3 activation. Planta Med, 2006, 72(13): 1250−1253.
[27] Wakabayashi C, Murakami K, Hasegawa H, et al. An intestinal bacterial metabolite of ginseng protopanaxadiol saponins has the ability to induce apoptosis in tumor cells. Biochem Biophys Res Commun, 1998, 246(3): 725−730.
[28] Ming YL, Chen ZY, Chen LH, et al. Inhibitory effect of ginseng saponin IH901 on proliferation and metastasis of ECV304 cell line and its molecular mechanism. Acta Pharmacol Sin, 2009, 44(9): 967−972.明艳林, 陈忠炎, 陈良华, 等. 人参皂苷IH901对ECV304细胞增殖和迁移的影响及其分子机制.药学学报, 2009, 44(9): 967−972.
[29] Ming YL, Song G, Chen LH, et al. Anti-proliferation and apoptosis induced by a novel intestinal metabolite of ginseng saponin in human hepatocellular carcinoma cells. Cell Biol Int, 2007, 31(10): 1265−1273.
[30] Ming YL, Chen ZY, Chen LH, et al. Ginsenoside Compound K attenuated metastatic growth of hepatocellular carcinoma is associated with the translocation of nuclear factor-κB p65 and reduction of matrix metalloproteinase-2/9. Planta Med, 2010, 76(1): 1−6.
[31] Oh SH, Lee BH. A ginseng saponin metabolite-induced apoptosis in HepG2 cells involves a mitochondria-mediated pathway and its downstream caspase-8 activation and Bid cleavage. Toxicol Appl Pharmacol, 2004, 194(3): 221−229.
[32] Ming YL, Zheng ZZ, Chen LH, et al. Anti-tumor mechanism of ginseng saponin IH901 on proliferation, invasion and metastasis of hepatocellular carcinoma. Sci Sin Vitae, 2011, 41(3): 219−225.明艳林, 郑志忠, 陈良华, 等. 人参皂苷IH901抗肝癌生长及其侵袭转移的作用机理. 中国科学:生命科学, 2011, 41(3): 219−225.
[33] Hasegawa H, Sung JH, Huh JH. Ginseng intestinal bacterial metabolite IH901 as a new anti-metastatic agent. Arch Pharm Res, 1997, 20(6): 539−544.
[34] Wakabayashi C, Hasegawa H, Murata J, et al. In vivo antimetastatic action of ginseng protopanaxadiol saponins is based on their intestinal bacterial metabolites after oral administration. Oncol Res, 1997, 9(8): 411−417.
[35] Ming YL, Zheng ZZ, Chen LH, et al. Apoptosis induced by a novel intestinal metabolite of ginseng saponin in human hepatocellular carcinoma BEL-7402 cells. Chin Herb Med, 2007, 38(10): 1511−1514.明艳林, 郑志忠, 陈良华, 等. 人参皂苷肠道代谢物诱导人肝癌 BEL-7402细胞凋亡. 中草药, 2007, 38(10): 1511−1514.
[36] Ming YL, Zheng ZZ, Chen LH, et al. Sensitization of 20-O-β-D-glucopyranoside-20(S)-protopanaxadiol on chemotherapy in patients with hepatocellular carcinoma. Chin Herb Med, 2010, 41(6): 935−938.明艳林, 郑志忠, 陈良华, 等. 20-O-β-D-吡喃葡萄糖苷-20(S)-原人参二醇对抗肝癌药物的增敏作用研究. 中草药, 2010, 41(6): 935−938.
[37] Kang KA, Kim YW, Kim SU, et al. G1 phase arrest of the cell cycle by a ginseng metabolite, compound K, in U937 human monocytic leukamia cells. Arch Pharm Res, 2005, 28(6): 685−690.
[38] Shin YW, Bae EA, Kim SS, et al. Effect of ginsenoside Rb1and compound K in chronic oxazolone-induced mouse dermatitis. Int Immunopharmacol, 2005, 5(7/8): 1183−1191.
[39] Lee JY, Shin JW, Chun KS, et al. Antitumor promotional effects of a novel intestinal bacterial metabolite (IH-901) derived from the protopanaxadiol-type ginsenosides in mouse skin. Carcinogenesis, 2005, 26(2): 359−367.
[40] Xie JT, Wang CZ, Wang AB, et al. Antihyperglycemic effects of total ginsenosides from leaves and stem of Panax ginseng. Acta Pharmacol Sin, 2005, 26(9): 1104−1110.
[41] Kim K, Kim DH, Kim HY. Compound K protects MIN6N8 pancreatic beta-cells against palmitateinduced apoptosis through modulating SAPK/JNK activation. Cell Biol Int, 2009, 34(1): 75−80.
[42] Yoon SH, Han EJ, Sung JH, et al. Anti-diabetic effects of compound K versus metformin versus compound K-metformin combination therapy in diabetic db/db mice. Biol Pharm Bull, 2007, 30(11): 2196−2200.
[43] Kim S, Kang BY, Cho SY, et al. Compound K induces expression of hyaluronan synthase 2 gene in transformed human keratinocytes and increases hyaluronan in hairless mouse skin. Biochem Biophys Res Commun, 2004, 316(2): 348−355.
[44] Tohda C, Matsumoto N, Zou K, et al. A β(25-35)-induced memory impairment, axonal atrophy, and synaptic loss are ameliorated by M1, a metabolite of protopanaxadiol-type saponins. Neuropsychopharmacology, 2004, 29(5): 860−886. [45] Choo MK, Park EK, Han MJ, et al. Antiallergic activity of ginseng and its ginsenosides. Planta Med, 2003, 69(6): 518−522.
[46] Shin YW, Kim DH. Antipruritic effect of ginsenoside Rb1and compound K in scratching behavior mouse models. J Pharmacol Sci, 2005, 99(1): 83−88.
[47] Lee HU, Bae EA, Han MJ, et al. Hepatoprotective effect of ginsenoside Rb1and compound K on tert-butyl hydroperoxide-induced liver injury. Liver Int, 2005, 25(5): 1069−1073.