M3受体激动剂胆碱对大鼠心肌细胞内钙离子的影响
栾海蓉,李海林,何志鹏,吴 红
(牡丹江医学院机能学教研室,黑龙江省高校肿瘤疾病防治重点实验室,黑龙江牡丹江157011)
心脏M3受体具有重要的生理功能和病理意义,在充血性心力衰竭、缺血性心律失常等疾病的发生、发展中发挥重要作用[1]。近期研究表明,激动M3受体对心肌缺血及H2O2诱导的心肌细胞凋亡有保护作用,可以减少离体细胞中乌头碱和毒毛花苷诱导的细胞内钙超载,对乌头碱和氯化钡诱发 Wistar大鼠心律失常的发生和发展具有保护作用[2-4]。
激动M3受体可以介导IKM3电流,使钾离子通道开放,促进钾离子外流,引起心肌细胞膜的超极化,缩短动作电位时程,导致Ⅱ期平台期缩短,间接使钙离子内流减少,心肌细胞[Ca2+]i降低。M3受体还可以通过Gq/11激活磷脂酶 C,使膜结合的二磷酸磷脂酰肌醇(PIP2)水解为三磷酸肌醇(inositol triphosphate,IP3)和二酰甘油,两者作为细胞内第二信使,均可以使心肌细胞[Ca2+]i增加。以上两个通路作用结果使细胞内钙变化截然相反,因此,该研究采用激光扫描共聚焦显微镜技术,分别利用高钾激活细胞膜电压依赖性钙通道,引起外钙的内流,以及咖啡因和IP3激活心肌细胞内“钙池”内质网/肌浆网引起细胞内钙的释放,观察M3受体激动剂胆碱对心肌细胞胞质游离钙离子浓度的影响,探讨其作用机制。
1 材料与方法
1.1 实验动物 健康成年Wistar大鼠,雌雄兼用,体质量250~300 g,由哈尔滨医科大学实验动物中心提供。
1.2 药品和仪器 4-羟乙基哌嗪乙磺酸[4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES],乙二醇-双-(2-氨基乙醚)四乙酸[ethylene glycol bis(2-aminoethyl)tetraacetic acid,EGTA],Na2-ATP,小牛血白蛋白(BSA),胶原酶Ⅱ,实验药物胆碱和4-DAMP(4-diphenylacetoxy-N-methylpiperidine-methiodide)等购自 Sigma公司;Fluo-3/AM,F-127等购自Invitrogen公司,日本Olympus FV-300激光扫描共聚焦显微镜。
1.3 溶液配制 包括[5]台氏液:NaCl 126 mmol/L,KCl 5.4 mmol/L,HEPES 10 mmol/L,NaH2PO40.33 mmol/L,MgCl2110 mmol/L,CaCl21.8 mmol/L,Glucose 10 mmol/L,用NaOH调pH至7.35。无钙台氏液除没有CaCl2之外,其余成分与台氏液相同。细胞保存液(KB液):Glutamic acid 70 mmol/L,Taurin 15 mmol/L,KCl 30 mmol/L,HEPES 10 mmol/L,KH2PO410 mmol/L,MgCl20.5 mmol/L,EGTA 0.5 mmol/L,Glucose 10 mmol/L,用 KOH 调 pH 为7.3~7.4。
1.4 大鼠单个心室肌细胞的制备 将大鼠撞击头部致昏,仰卧位固定于鼠台上,迅速开胸取出心脏,置于4℃台氏液中,游离主动脉并逆行插管连接于Langendorff灌流装置上,台氏液8 mL/min流速连续灌流约5 min,洗去心脏残血,然后用无钙台氏液灌流约10 min至心脏停搏后,用含0.02%胶原酶Ⅱ的无钙台氏液灌流分离豚鼠单个心室肌细胞,消化约10 min后自左心室分段剪取心室肌组织,置于盛有KB液的试管中,用吸管轻轻吹打,使之分散成单个细胞,弃除大块组织,置于 4℃冰箱稳定1 h待用[6-7]。
1.5 荧光染料的配制与细胞染色 取稳定好的细胞,用20 μmol/L的Fluo-3/AM染色,在37℃恒温水浴中孵育45 min,去除负载液后,用正常台氏液再洗涤1次,最后将细胞用正常台氏液稀释到所需浓度。取染好色的细胞置于浴槽中,静置贴壁5 min后用于实验,光镜下选取杆状、横纹清晰无颗粒的细胞实验[8]。细胞内钙的增加以荧光强度(fluorescence intensity,FI)升高表示。
1.6 细胞内钙离子([Ca2+]i)变化的检测 在Time seriesXYT模式下扫描记录心肌[Ca2+]i,激发波长为488 nm,扫描时间程序设定为每10秒采集一次数据,连续采集30次。基础荧光值按最小噪声最大图像信号设定,预扫描获得基础值后于第2次和第3次扫描间隙之间加入终浓度为30.0 mmol/L KCl,平均荧光强度以给药后与给药前的荧光强度比值(FI/FI0)表示。
1.7 统计学方法 图像分析时,细胞内基础钙FI定为1.0,加药后钙FI的变化为其相对值,以均数±标准差(±s)表示,统计学处理采用方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 胆碱对静息状态下大鼠心肌细胞内钙荧光强度的作用 在正常台氏液(含Ca2+1.8 mmol/L)加入胆碱5.0 mmol/L 和 4-DAMP 2.0 nmol/L,对照组加相同体积0.9%的生理盐水,钙Fmax/FI0无明显改变(表1)。

表1 胆碱对静息状态下心肌细胞钙荧光强度的影响
2.2 胆碱对咖啡因介导Rynaodine受体激动所致大鼠心肌细胞内“钙池”Ca2+释放的影响 在无钙台氏液(含 EGTA 2.0 mmol/L)中,加入终浓度10.0 mmol/L的咖啡因可使细胞内荧光强度比值(FI/FI0)增加(2.53±0.24)倍(峰值处)(n=20,与静息值相比,P<0.01)。10.0 mmol/L Rynaodine受体的拮抗剂普鲁卡因(procaine)孵育心肌细胞15 min,可以抑制咖啡因诱导的心肌细胞内钙FI/FI0的增强。5.0 mmol/L胆碱预先孵育细胞15 min后再用咖啡因激动,内钙升高倍数无明显改变(表2)。
10.0mmol/L咖啡因使得心肌细胞内FI/FI0增高达到峰值后,加入5.0 mmol/L胆碱不能使FI/FI0降低(图1)。
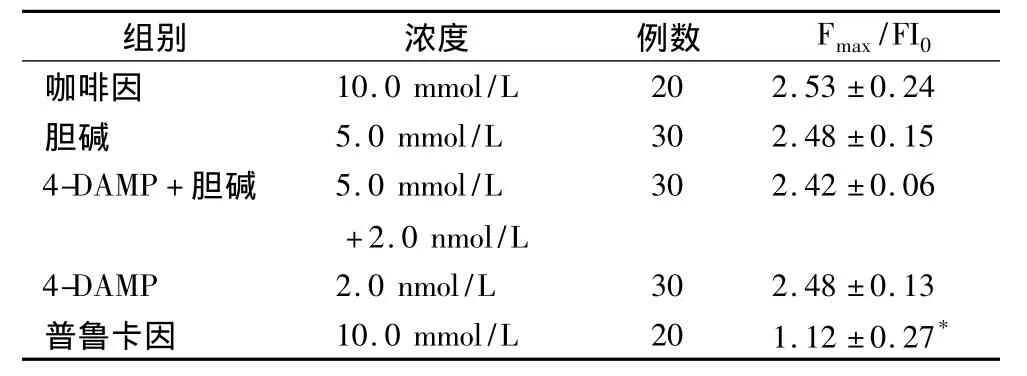
表2 胆碱对咖啡因诱导心肌细胞内钙释放钙荧光强度的影响
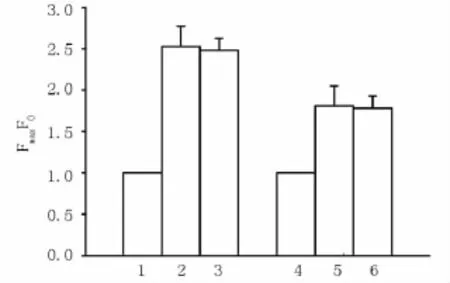
图1 choline对Caeffni和IP3诱导的细胞内钙释放的影响
2.3 胆碱对IP3介导IP3受体激动所致大鼠心肌细胞内“钙池”Ca2+释放的影响 在无钙台式液中,加入终浓度10.0 mmol/L IP3使细胞FI/FI0增加(1.81±0.24)倍(n=20,与静息值相比,P <0.01)。测定前预先用IP3受体的拮抗剂肝素(heparin)孵育心肌细胞15 min,肝素可以抑制IP3诱导的心肌细胞内钙FI/FI0的增强。5.0 mmol/L胆碱预先孵育细胞15 min后,不能抑制IP3诱导细胞内钙荧光强度的增强(表3)。
10.0mmol/L IP3使得心肌细胞内FI/FI0增高达到峰值后,加入5.0 mmol/L胆碱不能使FI/FI0降低(图1)。
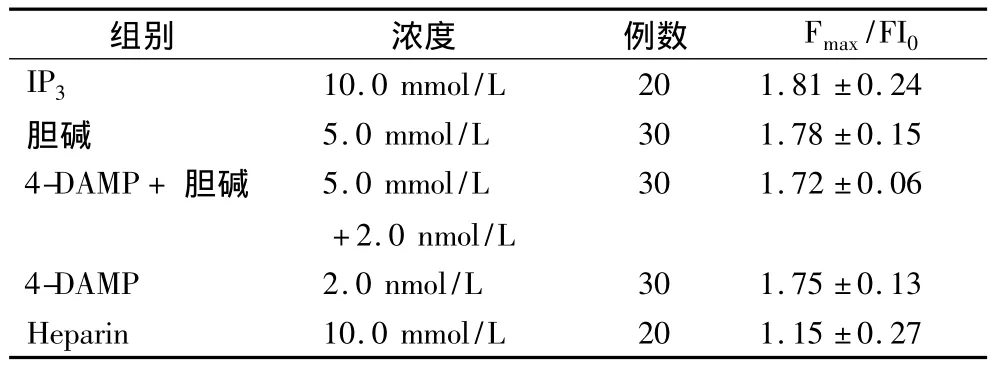
表3 胆碱对IP3诱导心肌细胞内钙释放钙荧光强度的影响
2.4 胆碱对KCI诱导大鼠心肌细胞内钙荧光强度增高(外钙内流)的影响 在正常台氏液(含1.8 mmol/L Ca2+)中加入30 mmol/L KCl后,[Ca2+]i逐渐升高,FI/FI0增加(2.62 ±0.11)倍(n=20,与静息值相比,P <0.01)。10.0 μmol/L 钙拮抗剂维拉帕米(verapamil)孵育心肌细胞15 min,可以抑制KCl心肌细胞内钙FI/FI0的增强。当细胞用5.0 mmol/L胆碱预孵15 min后加入KCl,可以明显降低钙FI/FI0至(1.42 ±0.13)倍(n=30,与 KCl相比,P <0.01)。而细胞用5.0 mmol/L胆碱与2.0 nmol/L 4-DAMP共同预孵 15 min后加入 KCl,FI/FI0恢复至(2.24±0.12)倍(n=30,与胆碱相比,P <0.01)(图 2A)。30.0 mmol/L KCl使得心肌细胞内FI/FI0增高达到峰值后,加入5.0 mmol/L胆碱可使FI/FI0明显降低(图2B)。
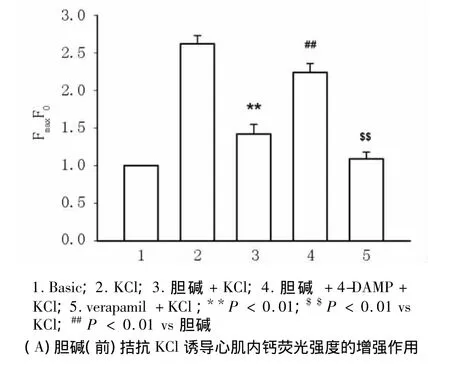
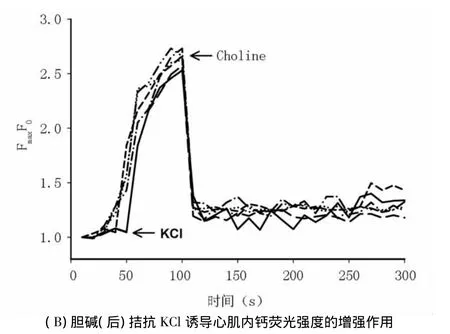
图2 胆碱对KCI诱导大鼠心肌细胞外钙内流的影响
3 讨论
Ca2+在生命活动中起着至关重要的作用,是影响或决定许多细胞反应和活性的第二信使。细胞内Ca2+的调节主要包括两方面:跨膜钙转运和胞内钙池的调节。跨膜钙转运包括质膜钙通道、质膜钙泵和Na+/Ca2+交换。胞内钙池的调节则包括胞内钙池Ca2+-ATP酶、胞内钙池钙结合蛋白、胞内钙池受体钙通道的调节。其中,通过心肌细胞膜电压依赖性L-钙离子通道的“外钙内流”和心肌细胞内钙释放通道IP3R和RyR介导的“内钙释放”在调节心肌细胞内游离钙离子的稳定水平发挥着最重要的作用[9]。
实验结果表明,M3受体激动剂胆碱对静息状态下的细胞内钙的浓度无影响,说明胆碱不参与自发的外钙内流和内钙释放,不影响静息状态下的心肌细胞对钙离子的调节。
细胞内钙池贮存钙的释放主要是由Ryanodine受体系统和IP3受体系统介导,它们均是受体依赖性钙通道。本实验采用咖啡因激动心肌细胞Ryanodine受体和IP3激动IP3受体,从而引起心肌细胞[Ca2+]i的增加。结果表明,不论是前给药还是后给药,胆碱均不能拮抗咖啡因和IP3介导胞内钙荧光强度的升高,表明胆碱对心肌细胞内钙池内储钙的释放没有影响。
本实验中,采用30.0 mmol/L KCl诱导心肌细胞膜上的电压依赖性钙通道被激活,L-型钙通道开放,外钙内流,使得[Ca2+]i明显升高。分别采用胆碱孵育细胞预先给药,和先用KCl增高[Ca2+]i然后加入胆碱后给药两种方式,结果表明胆碱均可以拮抗KCl诱导心肌细胞外钙内流的作用,说明胆碱可以阻断细胞膜L-型钙通道,从而减少钙内流。4-DAMP是M3受体特异性阻断剂[10],2.0 nmol/L 4-DAMP 能恢复 5.0 mmol/L胆碱抑制的KCl除极诱导的心肌[Ca2+]i升高,提示该作用可由M3受体调节。
实验结果表明,虽然M3受体介导的“IKM3”通路和“Gq/11”通路对细胞内钙离子作用相反,但实验结果表明,M3受体激动剂胆碱可以通过阻断细胞膜L-型钙通道,从而减少钙内流,降低心肌细胞内总钙浓度,抑制钙超载,从而对缺血性心肌发挥保护作用。
[1]岳朋,吕延杰,杨宝峰.心脏M3受体作为抗心律失常药物新靶点研究的[J].药学学报,2006,41(8):702-705.
[2]Liu Y,Sun HL,Wu H,et al.Protective effect of M3receptor on H2O2-induced apoptosis of rat myocardial cells in vitro[J].Acta Pharm Sin,2004,39(11):887-891.
[3]Liu Y,Sun HL,Li DL,et al.Choline produces antiarrhythmic actions in animal models by cardiac M3receptors:improvement of intracellular Ca2+handling as a common mechanism[J].Can J Physiol Pharmacol,2008,86(12):860-865.
[4]Liu Y,Du J,Gao Y,et al.Role of M3receptor in aconitine/bariumchloride-induced preconditioning against arrhythmias in rats[J].Naunyn Schmiedebergs Arch Pharmacol,2009,379(5):511-515.
[5]杨宝峰,单宏丽,周宇宏.一种筛选抗心律失常药物新模型的建立[J].中国药理学通报,2003,19(2):217-221.
[6]王赫,周宇宏,单宏丽.冬虫夏草水提液对单个心室肌细胞钾通道的影响[J].中国药理学通报,2004,20(5):536-539.
[7]刘玉梅,周宇宏,单宏丽.延胡索乙素对豚鼠单个心室肌细胞钾离子通道的影响[J].中国药理学通报,2005,21(5):599-601.
[8]初文峰,单宏丽,乔国芬,等.三磷酸肌醇信号途径参与血小板激活因子诱导豚鼠心室肌细胞钙浓度增高[J].中国药理学与毒理学杂志,2006,2,20(1):48-52.
[9]孙祝美.心肌细胞与钙离子调控[J].广州医药,2008,39(3):1-3.
[10]Van Zwieten P,Doods H.Muscarinic receptors and drugs in cardiovascular medicine[J].Cardiovasc Drugs Ther,1995,9(1):159-167.
- 医学综述的其它文章
- 基于SCIE的第二军医大学科研论文产出分析

