Ⅱ型糖尿病伴牙周炎病人牙龈组织中VEGF表达及MVD计数的研究
郭留云,李亚静,王芬英,杨志敏
(郑州大学口腔医学院暨河南省口腔医院牙周科,河南郑州450052)
牙周炎与糖尿病具有双向相关性,与健康人相比,Ⅱ型糖尿病病人牙周炎发病率以及牙周破坏程度均显著增高[1-2]。最近研究发现:血管内皮生长因子(Vascular Endothelial Growth Factors,VEGF)与牙周炎和糖尿病的发生发展关系密切。糖尿病是否可通过上调VEGF使牙龈组织微血管增多、血管通透性增加而促进牙周炎的进展,目前相关研究尚少。本研究通过免疫组织化学染色方法,比较Ⅱ型糖尿病伴牙周炎病人、全身健康的慢性牙周炎病人以及健康人牙龈组织中VEGF的表达水平及微血管密度(Microvessles Density,MVD),探讨其在糖尿病伴牙周炎时对牙周炎的进展及组织破坏的作用。
1 研究对象和方法
1.1 研究对象
2010-01—2011-01在河南省口腔医院牙周科就诊的病人中选取Ⅱ型糖尿病1年以上并伴重度牙周炎的病人15例(DP组),男8例,女7例,年龄41~67岁;按性别、年龄匹配选择无糖尿病但患有重度慢性牙周炎的病人15例(CP组),男9例,女6例,年龄40~65岁;同时选取无糖尿病且牙周健康者(龈沟深度≤3 mm,无牙周袋及附着丧失,X线片示无牙槽骨吸收)15例作为正常对照组(N组),男8例,女7例,年龄20~32岁。所有研究对象均知情同意。
纳入标准:①Ⅱ型糖尿病依据WHO(1999)确定的糖尿病诊断标准:空腹血糖(fasting blood glucose,FBG)≥7.0 mmol/L和(或)糖耐量实验(oral glucose test 2 h blood glucose,OGTT2hBG)≥11.1 mmol/L;②重度慢性牙周炎参照曹采方等标准[3],全口牙中有附着丧失和骨吸收的位点占总位点数>30%;炎症较明显或发生牙周脓肿;牙周袋>6 mm,附着丧失≥5 mm;X线片示牙槽骨吸收超过根长的1/2;牙多有松动;多根牙有根分叉病变;③口内至少存留14个牙齿,其中有4个磨牙;④无其他全身性疾病。
排除标准:①标本采集前3个月内做过牙周系统治疗;②3个月内使用抗生素或避孕药;③妊娠期妇女及抽烟者。
1.2 方法
1.2.1 主要试剂
VEGF兔抗人多克隆抗体、CD34鼠抗人多克隆抗体(SANTA CRUZ,美国);免疫组化SP试剂盒(武汉博士德)。
1.2.2 HE和免疫组化染色
实验组炎症牙龈来源于具有拔牙指征而且治疗计划需要拔除的牙齿周围牙龈或者翻瓣术切除的牙龈组织;健康牙龈来源于因冠延长术而切除的牙龈组织,要求牙龈组织健康无炎症,无探诊出血。局麻下在预先准备的部位切取牙龈组织约3 mm× 2 mm×2 mm,生理盐水洗净血污后置新鲜配置的中性福尔马林液中固定后,常规制作5 μm石蜡切片。HE染色观察组织形态;按照SP试剂盒说明进行免疫组化染色,观察VEGF表达和MVD计数。
1.2.3 免疫组化结果判定
光学显微镜观察以细胞质呈棕黄色为VEGF阳性,不着色为阴性,每张切片在高倍镜下(× 400)随机选取5个有代表性的视野,通过与显微镜相连的设备进行拍照,将切片图像输入计算机后,用图像分析系统(Biosens Digital Image Analysis Systems)分析所选取图像中VEGF染色阳性反应部位的光密度值,取其平均值以反映该标本的表达强度。
MVD计数判定:以血管内皮细胞胞质内出现明显的黄色或棕黄色颗粒为阳性判断标准;MVD测定方法:首先在100倍光镜下挑选被CD34着色的微血管密度最高区域,然后在200倍光镜下计数5个不重复视野中的微血管数目,取其平均值作为MVD值。
1.3 统计学分析
2 结果
2.1 HE染色结果
健康对照组牙龈由复层鳞状上皮和固有层组成,复层鳞状上皮明显角化或不全角化,上皮钉突插入固有层中,固有层为致密的结缔组织,胶原纤维交织成网状,主要由纺锤状成纤维细胞和小血管组成,几乎不见炎症细胞浸润。Ⅱ型糖尿病伴牙周炎组与慢性牙周炎组可见上皮及其下方结缔组织大量炎症细胞(主要为淋巴细胞和浆细胞)浸润,胶原变性,成纤维细胞排列紊乱,毛细血管增生。
2.2 免疫组化染色结果
VEGF阳性染色为棕黄色,主要定位于细胞的胞浆,正常和炎症牙龈组织都有VEGF的阳性表达。在健康对照组牙龈组织中,VEGF阳性主要定位于牙龈上皮细胞和成纤维细胞的低量表达(图1)。而慢性牙周炎组(图2)和Ⅱ型糖尿病伴牙周炎组(图3)VEGF在牙龈上皮细胞、成纤维细胞、血管内皮细胞和炎症细胞(淋巴细胞和浆细胞)均有强阳性表达。
CD34是血管内皮细胞标记物,各组牙龈组织均有阳性表达,被CD34染色阳性的小血管和微血管主要位于牙龈结缔组织,棕黄色细胞呈点状、线状或管状结构分布。健康对照组(图4)镜下观血管管腔较大,分支很少,形态成熟。慢性牙周炎组(图5)和Ⅱ型糖尿病伴牙周炎组(图6)镜下可见大量新生血管,血管管腔大小不等,细小分支较多。
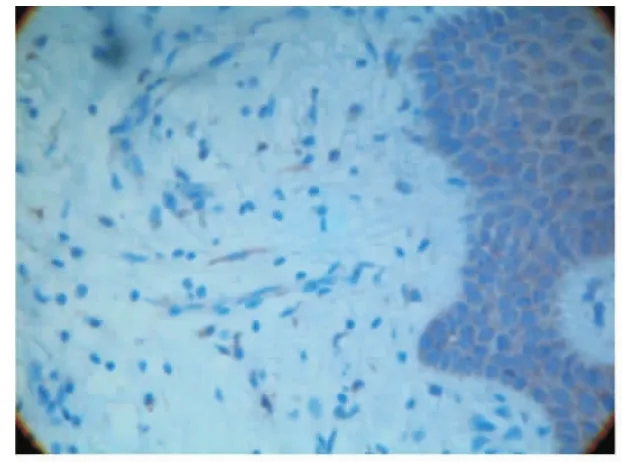
图1 健康对照组VEGF低表达(免疫组化 ×400)
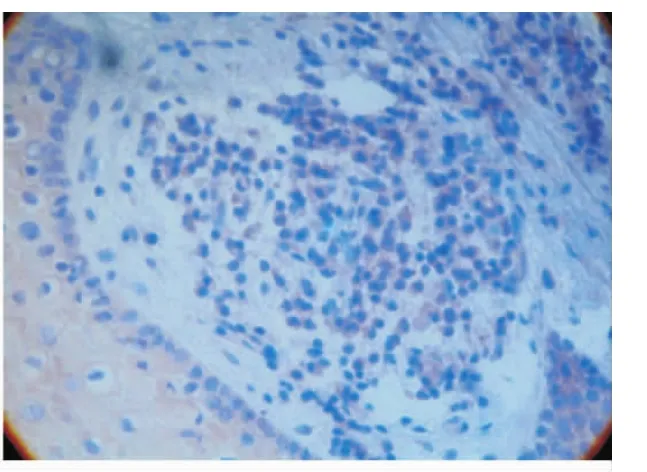
图3 糖尿病伴牙周炎组VEGF高表达(免疫组化 ×400)
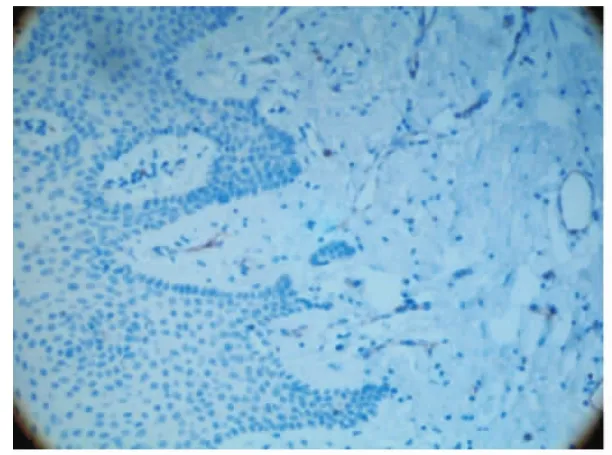
图4 健康对照组MVD计数状况(免疫组化 ×200)

图5 慢性牙周炎组MVD状况(免疫组化 ×200)
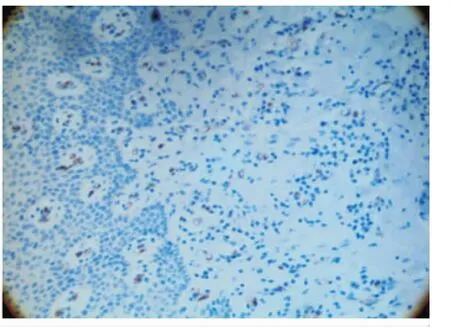
图6 糖尿病伴牙周炎组MVD状况(免疫组化 ×200)
2.3 图像分析结果
2.3.1 VEGF在各组牙龈组织中表达水平比较
各组VEGF阳性部位光密度值比较(表1),Ⅱ型糖尿病伴牙周炎组平均VEGF表达水平最高,慢性牙周炎组次之,健康对照组最低,各组间比较差异均有统计学意义(P<0.05)。
表1 各组牙龈组织中VEGF阳性部位光密度值比较 (±s)

表1 各组牙龈组织中VEGF阳性部位光密度值比较 (±s)
不同字母组间P<0.05
组别 样本量 平均光密度值N 15 95.660±1.051a CP 15 124.990±1.983b DP 15 142.774±1.225c
2.3.2 各组牙龈组织中的MVD计数
Ⅱ型糖尿病伴牙周炎组平均MVD计数最高,慢性牙周炎组次之,健康对照组最低(表2),各组间比较差异均有统计学意义(P<0.05)。
表2 各组牙龈组织中MVD计数比较 (±s)
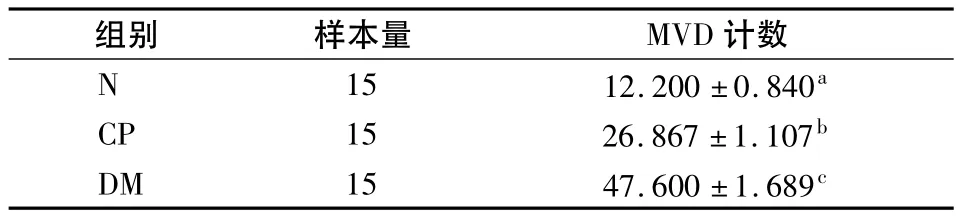
表2 各组牙龈组织中MVD计数比较 (±s)
不同字母组间P<0.05
组别 样本量 MVD 计数N 15 12.200±0.840a CP 15 26.867±1.107b DM 15 47.600±1.689c
3 讨论
很多流行病学调查和医学研究表明:牙周炎与糖尿病之间具有双向相关性,互相增加发病风险。糖尿病可加重牙周炎病人牙周组织的破坏程度,而牙周炎又可影响糖尿病的代谢控制,因此有学者将牙周炎列为糖尿病的第六并发症[4]。VEGF是一种特异地作用于血管内皮细胞的多功能生长因子,也称血管通透因子(VPF),是微血管内皮细胞生长调控的关键因子,在正常组织中表达较低,病理状况如组织缺血缺氧、肿瘤、炎症时VEGF表达上调。血管反应在慢性炎症进展期起重要作用,主要包括血管数目增加和血管通透性增高。VEGF可通过增加血管通透性而促进白细胞和血浆蛋白的渗出,引起局部炎性水肿,静脉压升高,继发局部缺氧,加速炎症进展;同时VEGF还是血管生成的关键调节因子,VEGF可通过诱导血管内皮细胞的分裂、增殖、分化、迁移以及血管基底膜胶原蛋白的水解而形成新生血管即血管生成(angioenesis),新生血管能够运送炎症细胞、炎症因子、粘附分子和营养物质至病损区,参与炎症反应的持续与进展。研究发现牙周炎病人龈沟液VEGF水平远高于牙周健康者,而且与牙周炎临床参数呈正相关[5];糖尿病病人由于高血糖、缺氧等可导致VEGF水平升高。因此,糖尿病可能通过上调VEGF表达增加牙周炎的易感性。
本研究结果显示:在健康对照组牙龈组织中,VEGF阳性主要定位于牙龈上皮细胞、血管内皮细胞和成纤维细胞的低量表达,而慢性牙周炎组VEGF在牙龈上皮细胞、成纤维细胞、血管内皮细胞和炎症细胞(淋巴细胞与浆细胞)均有强阳性表达。且其表达水平明显高于健康对照组(P<0.05),与Booth等[6]研究结果相似。慢性牙周炎组MVD计数亦明显高于健康对照组MVD计数(P<0.05)。这与Artese等[7]研究结果相一致。牙周炎病人牙龈组织中VEGF表达水平升高可能与牙周致病菌及其代谢物刺激牙周组织局部合成VEGF增加有关。研究发现:伴放线放线杆菌和牙龈卟啉单胞菌的膜泡以及外膜蛋白可上调体外培养的牙龈成纤维细胞VEGF的表达[8],同时IL-1和TNF-α也能诱导牙周膜细胞分泌更多的VEGF[9-10];而且炎症牙龈组织中大量被激活的炎症细胞如浆细胞、单核细胞,淋巴细胞也合成和分泌VEGF。因此推测在牙周炎状态下,牙龈组织中升高的VEGF通过介导血管生成,使微血管数目增多;通过促进血管通透性,加重渗出进而促进牙周炎的进展。
有研究发现:高血糖、缺氧可刺激VEGFmRNA与蛋白的表达升高[11],本结果显示:Ⅱ型糖尿病伴牙周炎组平均VEGF表达水平和MVD计数均明显高于单纯慢性牙周炎组(P<0.05),表明牙龈组织中VEGF表达水平不仅与牙周组织的局部炎症有关,而且与糖尿病本身相关。
糖尿病病人由于高血糖环境以及牙龈组织内小血管基底膜增厚,血液黏稠度高使组织局部缺氧,导致牙周组织中VEGF表达升高;而且长期高血糖可致血清中糖化末端产物(AGEs)的形成和聚集,AGEs可与血管壁和单核细胞表面的AGEs受体(AGER)结合,从而刺激牙周组织中的单核细胞合成更多的IL-1β、TNF-α和IL-6等一系列炎症因子。同时,糖尿病病人中性粒细胞的趋化、迁移、吞噬和杀菌功能受损,牙周致病菌在逃避中性粒细胞的吞噬杀伤时又可刺激单核细胞产生大量炎症因子,从而上调牙周组织中VEGF的表达。另外,糖尿病可导致胶原代谢障碍和中性粒细胞功能障碍,致使牙周感染难以消除,炎症反应加重,牙周病的菌血症和内毒素血症使血循环中炎症因子升高,刺激牙周局部VEGF的合成。VEGF水平的上升可以增强牙周炎的血管反应,使炎症组织中新生血管增多,血管通透性增加,以及通过介导骨吸收作用进一步加重牙周炎症的进展,炎症反应加重进而可以刺激炎症细胞激活分泌更多炎症因子入循环,加重胰岛素抵抗,如此可形成恶性循环。
近年来,国外曾有相关方面文献报道,Unlu等[12]、Guneri等[13]所选取的分别为健康人牙龈组织、重度慢性牙周炎病人与糖尿病伴牙周炎病人的牙周患病位点和健康位点的牙龈组织,研究发现:糖尿病伴牙周炎病人与慢性牙周炎病人牙龈组织中VEGF表达均高于健康对照组,炎症组均可见炎症细胞中VEGF表达,本研究结果与之相一致。但与之不同的是:本研究中健康对照组也发现VEGF的阳性表达,慢性牙周炎组远高于健康组,而上述两位学者皆报道健康牙龈中未见VEGF表达,牙周炎组和健康组VEGF表达差异无统计学意义,这也许是个体间差异的结果,需加大样本量进一步研究。Sakallioglu等[14]用ELLSA法检测发现:血糖控制良好的Ⅱ型糖尿病伴牙周炎病人牙龈组织中VEGF含量高于慢性牙周炎病人牙龈组织VEGF的含量,差异有统计学意义,但Gonca等[15]报道:慢性牙周炎、Ⅱ型糖尿病伴慢性牙周炎病人牙龈组织中VEGFmRNA的表达没有差异。综上所述,目前VEGF与糖尿病伴牙周炎的关系尚未有定论。
本研究结果得出:Ⅱ型糖尿病伴牙周炎病人牙龈组织中VEGF强度和MVD计数增加,因此推测对VEGF与牙周炎糖尿病的关系的深入研究可能作为衡量糖尿病伴牙周炎的一个重要指标。
[1] Tsai C,Hayes C,Taylor GW.Glycemic control of type 2 diabetes and severe periodontal disease in the US adult population[J].Community Dent Oral Epidemiol,2002,30(3):182-192.
[2] Campus G,Salem A,Uzzau S,et al.Diabetes and periodontal disease:a case-control study[J].J Periodontol,2005,76 (3):418-425.
[3] 曹采芳.临床牙周学[M].北京:人民卫生出版社,2008: 116-141.
[4] Loe H.Periodontal disease.The sixth complication of diabetes mellitus[J].Diabetes Care,1993,16(1):329-334.
[5] Prapulla DV,Sujatha PB,Pradeep AR.Gingival crevicular fluid VEGF levels in periodontal health and disease[J].J Periodon-tol,2007,78(9):1783-1787.
[6] Booth V,Young S,Cruchley A,et al.Vascular endothelial growth factor in human periodontal disease[J].J Periodontal Res,1998,33(8):491-499.
[7] Artese L,Piattelli A,de Gouveia Cardoso LA,et al.Immunoexpression of angiogenesis,nitric oxide synthase,and proliferation makers in gingival samples of patients with aggressiveand chronic periodontitis[J].J Periodontol,2010,81(5):718-726.
[8] Suthin K,Matsushita K,Machigashira M,et al.Enhanced expression of vascular endothelial growth factor by periodontal pathogens in gingival fibroblasts[J].J Periodontal Res,2003,38(1):90-96.
[9] OyamaT,Sakuta T,Matsushita K,et al.Effects of roxithromycin on tumor necrosis factor-alpha-induced vascular endothelial growth factor expression in human periodontal ligament cells in culture[J].J Periodontol,2000,71(10):1546-1553.
[10] Bando Y,Noguchi K,Kobayashi H,et al.Cyclooxygenase-2-derived prostaglandin E2is involved in vascular endothelial growth factor production in interleukin-1α-stimulated human periodontal ligament cells[J].J Periodontal Res,2009,44 (3):395-401.
[11] Kim Bs,Chen J,Weinstein T,et al.VEGF expression in hypoxia and hyperglycemia:reciprocal effect on branching angiogenesis in epithelial endothelial co-cultures[J].J Am Soc Nephrol,2002,13(8):2027-2036.
[12] Unlu F,Guneri PG,Hekimgil M,et al.Expression of vascular endothelial growth factor in human periodontal tissues:comparison of healthy and diabetic patients[J].J Periodontol,2003,74(2):181-187.
[13] Guneri P,Unlu F,Yesilbek B,et al.Vascular endothelial growth factor in gingival tissues and crevicular fluids of diabetic and healthy periodontal patients[J].J Periodontol,2004,75 (1):91-97.
[14] Sakallioglu EE,Aliyev E,Lutfioglu M,et al.Vascular endothelial growth factor(VEGF)levels of gingiva and gingival crevicular fluid in diabetic and systemically healthy periodontitis patients[J].Clin Oral Investig,2007,11(2):115-120.
[15] Keles GC,Cetinkaya BO,Eroglu C,et al.Vascular endothelial growth factor expression levels of gingiva in gingivitis and periodontitis patients with/without diabetes mellitus[J].Inflamm Res,2010,59(7):543-549.

