超声引导下射频消融治疗结节性甲状腺肿46例报告
刘金涛 郭文斌 杨世财 葛述科
(大连市中心医院乳腺甲状腺外二科,大连 116033)
超声引导下射频消融治疗结节性甲状腺肿46例报告
刘金涛 郭文斌 杨世财 葛述科
(大连市中心医院乳腺甲状腺外二科,大连 116033)
目的 探讨超声引导下射频消融(radiofrequency ablation,RFA)治疗结节性甲状腺肿的临床效果。 方法2009年6月~2010年9月对46例甲状腺良性结节在局部麻醉下行超声引导下RFA治疗,在颈部皮肤取1mm切口,切开皮肤及皮下组织,将射频针穿刺在结节的中心部位开启射频,应用能量为4~6 W,其中心温度可达95℃。 结果 均成功行RFA,术中无明显并发症发生,1例出现穿刺部位感染。RFA术后6个月47.8%(22/46)患者结节全部吸收,26.1%(12/46)结节体积较术前缩小≥50%,26.1%(12/26)结节体积较术前缩小25% ~50%。 结论 超声引导下RFA治疗结节性甲状腺肿疗效好、微创优势明显,是一种值得推广的手术方法。
射频消融; 甲状腺良性结节; 超声引导
自Hüscher等[1]报道首例腔镜甲状腺腺叶切除术以来,关于其争论也增加,部分学者认为,所有颈部无瘢痕腔镜甲状腺手术并非是一种微创手术,反而手术时间长、剥离面大、术后疼痛强而被认为是一种创伤较大的手术[2,3]。2009年6月 ~2010年9月我科应用超声引导下射频消融技术(radiofrequency ablation,RFA)治疗46例结节性甲状腺肿,取得满意疗效,现将结果报道如下。
1 临床资料与方法
1.1 一般资料
本组46例,男15例,女31例。年龄19~56岁,平均32岁。主诉:颈部可触及肿块或影响美观38例,颈部异物感或疼痛8例。肿瘤大小1.0~2.6 cm,平均1.5 cm。甲状腺单发结节13例,多发结节33例。实性18例,囊实性16例,囊性12例。实验室检查甲状腺功能正常。术前结节穿刺病理诊断全部为结节性甲状腺肿。
病例选择标准:术前细针穿刺细胞学诊断为结节性甲状腺肿;实验室检查甲状腺功能正常;术前超声提示结节为良性病变,且病变部位与周围组织无浸润,病变区无明显沙砾样钙化,颈部无淋巴结肿大;肿瘤最大径>1 cm。
1.2 方法
1.2.1 仪器设备 超声仪采用GE公司500型彩色B超;结节活检使用18 G巴德穿刺针;德国Celon AG公司射频仪,工作频率为470 kHz,其中射频针裸露部分为0.5 cm ×0.2 cm。
1.2.2 手术方法 术前由超声医生全面探查双侧甲状腺及颈部淋巴结,以确定肿瘤的部位、大小、有无钙化及颈部是否有怀疑转移的淋巴结。患者仰卧,超声探查需要消融病灶的部位及范围,确定穿刺点及穿刺途径。常规消毒铺巾后用1%利多卡因做皮肤、针道及结节周围浸润麻醉,同时在甲状腺背侧近气管旁加注局麻药物,使甲状腺与喉返神经形成隔离带,以防止神经的热损伤。穿刺点以尖刀片做1 mm切口,切开皮肤及皮下组织,将射频针穿刺在结节的中心部位开启射频,应用能量为4~6 W,其中心温度可达95℃。消融区组织的阻抗会随着消融程度的加大而逐渐上升,阻抗升至最高时,射频仪自动停止工作,说明组织已彻底固化消融。术中通过超声监测,如汽化范围尚未完全覆盖结节,则调整穿刺针部位再次消融,直到整个结节全部汽化为止,同时观察结节区域血流全部消失即完成治疗(图1~4)。对于多发结节,术中在超声引导下调整穿刺针的方向,或重新选择穿刺点,进行射频消融。术后局部压迫,适当支持治疗如止血等。术后应用抗生素3 d。
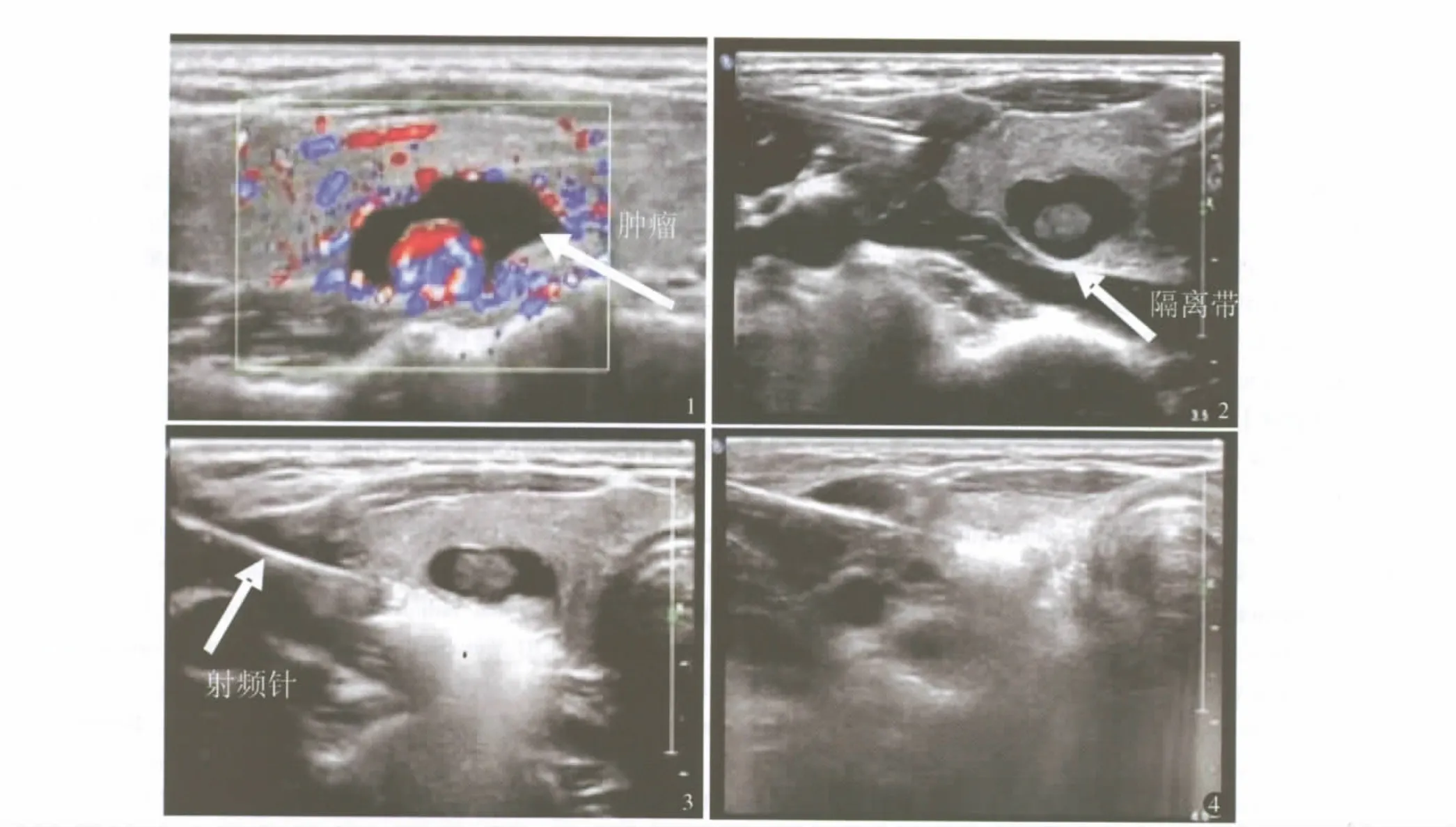
图1 超声探查肿瘤及血流信号 图2 注射麻药,形成隔离带 图3 射频针插入肿瘤内,消融开始 图4 消融结束,结节内部及边缘呈高回声改变
1.3 效果评价
疗效判定参照RFA治疗子宫肌瘤的标准[4~6],在超声探及血流完全消失下进行评价。治愈:结节完全消失:显效:结节体积缩小≥50%;好转:结节体积缩小25%~50%。
2 结果
全部手术均成功,无中转开放手术。在局麻、超声引导下将射频针皆准确插入结节内部,全部病例皆成功进行射频消融治疗,术中仅有轻微的不适,皆可耐受。治疗时超声显示病灶部位的回声逐渐增强,部分病人可见“微小气泡”样强回声沿针道缓慢移动。射频治疗后1周开始,所有病灶超声显示为不规则的回声增强,边界模糊,病灶内的高回声呈“椭圆形”分布,与射频电极的能量空间形状一致。
3例治疗后1~3 d有低热,体温37.4~38.2℃,体温正常后出院;1例出现穿刺部位皮肤红肿经过7 d抗炎治疗后痊愈。其余患者体温正常,预防性应用抗生素24 h,观察2 d出院。本组未出现声音嘶哑、饮水呛咳、神经损伤等并发症。RFA术后3个月超声复查,全部患者甲状腺结节血流消失,39.1%(18/46)患者甲状腺高回声影消失,即结节完全吸收,其余结节有不同程度的缩小;术后6个月超声复诊,47.8%(22/46)病人结节全部吸收(表1)。
3 讨论
RFA自20世纪90年代问世以来,因其创伤小、操作简便及疗效好等优点越来越多地应用实体肿瘤的治疗中。RFA是一种肿瘤热疗方法,基本原理是利用热能损毁肿瘤组织,由电极发出射频波使周围组织中的离子和极性大分子振荡撞击摩擦发热,将肿瘤区加热至有效治疗温度范围并维持一定时间以杀灭肿瘤细胞。目前,RFA治疗领域主要应用于肝、肺原发或继发肿瘤,较小的肾肿瘤及甲状腺癌转移病灶[5]。近年来,国外少数学者开始应用RFA治疗甲状腺良性结节[6],而国内相关报道较少。

表1 RAF后甲状腺结节及术后3、6个月的疗效
基于以上理论,本组采用RFA进行甲状腺良性结节治疗,并取得较好效果。由于超声引导下进针具有实时调整进针方向、穿刺点准确、可避开大血管及邻近脏器等优点,且本组应用的射频针消融范围仅为0.6 cm,在保证射频精确性的前提下,最大限度地避免周围组织不必要损伤。由于应用的射频针消融范围小,部分病例采用多点消融法,以保证彻底消融结节。目前,RFA主要适用于长径<3 cm的甲状腺良性病变及反复出现的颈部肿瘤转移病灶,对于微小甲状腺癌尚在探讨之中。对于有凝血功能障碍、服用抗凝药物及直径较大的良恶性肿块则为禁忌证[7]。但也可能会出现术前结节活检微小甲状腺癌漏诊的可能,由于射频消融靶区的温度可以达到95℃,足可以杀灭肿瘤细胞,故本法是安全可靠的。
RFA治疗甲状腺结节的并发症:消融术中可出现大血管损伤、神经的热损伤及术后出现如感染、脓肿等并发症[8]。消融区域感染后可短时间内明显增大,病灶内出现气体、液体,建议及时行穿刺活检明确诊断以利临床治疗。本组1例穿刺部位感染,经过治疗后7 d痊愈。在穿刺前首先超声明确颈部大血管部位,全部过程针尖部位一直是在超声监护下,避免了对大血管的误伤。术者在治疗开始前,将结节与神经之间注射盐水形成隔离带,以防止在消融过程中对神经的热损伤,故未出现神经损伤征象。
射频消融时因组织内水分汽化出现气泡,超声可见高回声病灶,随着治疗的继续,高回声气泡增多增大并逐渐融合,其周边形成一个高回声晕环。根据形态及血流的变化,选用超声、增强CT或MR作为RFA术后影像学随访的主要手段[9~11]。我们参考相关文献[4~6]判断 RFA 疗效,由于超声简单、快捷,故本研究选用超声作为随访手段,在治疗6个月后有 47.8%(22/46)患者结节完全吸收,26.1%(12/46)患者结节体积较术前缩小≥50%,26.1%(12/46)患者结节体积缩小25% ~50%,临床显示很好的疗效。在射频消融后,结节组织变性、坏死,通过机体的吞噬功能使结节吸收。
目前,RFA治疗甲状腺结节仍处于临床探索阶段,有些问题如:如何使RFA与影像学更好结合,把计算机三维立体定位技术引入RFA的治疗,提高治疗的准确性,减少对周围组织结构破坏的可能等,尚待深入研究[6]。总之,RFA作为非血管介入治疗技术,由于具有微创、安全、有效及美观等优势,将来可能成为甲状腺疾病治疗的重要手段之一。
1 Hüscher CS,Chiodomi S,Napolitano C,et al.Endoscopic right thyroid lobectomy.Surg Endosc,1997,11(8):877.
2 Tan CT,Chea WK,Delbridge L.“Scarless”(in the neck)endoscopic thyriodectomy(SET):an evidence-based review of published techniques.Word JSurg,2008,32(7):1349 -1357.
3 Duncan TD,Rashid Q,Speights F,et al.Endocopic transaxillary approach to the thyroid gland our early experience.Surg Endosc,2007,21(12):2166 -2171.
4 王 娟.超声引导下射频消融术治疗子宫肌瘤临床观察.现代医药卫生,2009,25:1858 -1859.
5 Damian E,Duputy,MD,John M,etal.Radiofrequency ablation of regional recurrence from well-differentiated thyroid malignancy.Surgery,2001,130(6):971 -977.
6 Jeong WK,Baek JH,Rhim H,et al.Radiofrequency ablation of benign thyroid nodules:safety and imaging follow-up in 236 patients.Eur Radiol,2008,18(12):1244 -1250.
7 郭文斌,孙一云,张建全.甲状腺肿物微创治疗的研究进展.中国普通外科杂志,2010,19(11):1238 -1241.
8 Gillams AR. Complication of percutaneous therapy. Cancer Imaging,2005,5:110 -113.
9 Smith S, Gillama A. Imaging appearances following thermal ablation.Clin Radiol,2008,63(1):1 -11.
10 Okuma T, Okamura T, Matsuoke T, et al. Fluorine-18-fluorodexyglucose position emission tomography for assessment of patients with unresectable recurrent or metastatic lung cancer after CT-guided radiofrequency ablation preliminary results.Ann Nucl Med,2006,20(2):115 -121.
11 Savatek RS,Sims R,Anderson JK,et al.Magnetic resonance imaging characteristics of renal tumors after radiofrequency ablation.Urology,2006,67(3):508 -512.
(责任编辑:李贺琼)
Doppler Ultrasound-guided Radiofrequency Ablation for Nodular Goiter:Report of 46 Cases
LiuJintao,GuoWenbin,Yang Shicai,etal.SecondDepartmentofBreastandThyroidSurgery,DalianCentralHospital,Dalian116033,China
ObjectiveTo explore the efficacy of Doppler ultrasound-guided radiofrequency ablation(RFA)for benign thyroid nodules.MethodsFrom June 2009 to September2010,we performed RFA under the guidance by Doppler ultrasonography on 46 patientswith benign thyroid nodules.Wemade a 1-mm incision at the neck,cut the skin and subcutaneous tissues,and then inserted a radiofrequency needle into the center point of the nodules for RFA(4-6 W,center temperature 95℃).ResultsThe procedure was completed in all the patientswithout causing severe complications.One patient developed infection at the puncture site.Sixmonths after the RFA,22 of the patients(47.8%)had all the nodules disappeared,12 patients(26.1%)had the size of the nodules reduced by≥50%,while in the other12 patients the noduleswere reduced by 25% -50%.ConclusionsRFA is a safe,effective,and minimally invasivemethod for the treatment of nodular goiter.It is worth being widely used.
Radiofrequency ablation;Benign thyroid nodules;Ultrasound guidance
R739.91
A
1009-6604(2012)08-0701-03
2012-04-06)
2012-04-28)
·临床论著·

