超声波均质化对仙台病毒ELISA测试中抗原稳定性的影响
向志光,刘先菊,佟 巍,李雨函,张丽芳,魏 强
(中国医学科学院/北京协和医学院医学实验动物研究所,卫生部实验动物检测中心,北京 100021)
仙台病毒是实验用大小鼠严格控制的病原体,在我国的实验动物国家标准中对用清洁级以上的实验用大小鼠均需要排除该病原体的干扰[1],并且确定以血清学检测实验动物自身携带的抗病毒抗体水平以评价实验动物的质量。目前对于仙台病毒的血清学检测的ELISA方法中多使用病毒的天然抗原,因为天然抗原更具有代表性。但是目前对于各类获取的天然病毒抗原的均质化处理,以及天然抗原对于酶标板的吸附性状的研究较少。
本文报道了我中心采用BHK-21细胞扩增仙台病毒,使用差速离心去除了培养细胞碎片,富集了仙台病毒。对收集的仙台病毒采用超声波进行均质化处理,和未处理的病毒颗粒做比较包被酶标板,用仙台病毒的免疫血清在两种平板做测试,通过比较测试数据的变异率分析了超声波处理对于酶标板包被抗原的均质性和抗原稳定性的影响。
1 材料和方法
1.1 病毒、细胞、质控血清的来源
仙台病毒和BHK-21细胞来自美国ATCC。SPF小鼠血清采自北京华阜康生物技术有限公司提供的6~8周龄SPF级实验小鼠外周血。免疫质控血清按照本中心之前报道的方法进行制备[2]。
1.2 病毒的扩增和浓缩纯化
使用仙台病毒接种感染BHK-21细胞,感染3d后收集培养物经-80℃至室温的反复冻融3次,后经56℃水浴30min对仙台病毒灭活处理。培养物经4℃ 10000r/m in离心30min去除细胞碎片,收集上清经4℃ 35000r/min离心3h收集沉淀病毒颗粒。使用生理盐水反复吹打沉淀物至呈均匀分散相,使用12000r/min 30min低温离心去除结块不溶物。使用BCA法测定蛋白浓度。
1.3 病毒的超声波处理
取浓度为3mg/m L病毒重悬物1m L,放置冰上,使用小探头进行超声处理,超声频率为20kHz,振幅30%,功率设定在300W。超声处理5s,停10s,连续处理60次。将超声处理后的病毒再次进行12000r/min 30min低温离心,去除不溶物,再次用BCA法测定蛋白浓度。
1.4 酶标板的包被和血清样品的检测
将未经超声处理的仙台病毒抗原和超声处理的抗原按照1μg/m L的浓度重悬于包被液,按照每孔100μL包被酶标板,4℃包被过夜,室温封闭后加入待测试样品37℃孵育1h。使用PBST洗板3次后加入酶标记物(1∶20000稀释的rabbit anti-mouse IgG-HRP)37℃孵育1h。使用PBST洗板3次后加入TMB底物液,10min内加入2M H2SO4终止显色反应。至A450进行检测。
1.5 变异系数(变异率)的计算
对标准免疫血清做梯度稀释至从1∶40至1∶2560,每个稀释度重复测试6个孔。2份 SPF血清也进行6个孔的重复测试。对各样品做均值和标准差的统计,测定变异系数,以标准差/均值 ×100%做变异率统计。
2 结果
2.1 超声处理对仙台病毒抗原的抗原性无显著影响
各血清样品在2种平板A450的测量均值如图1所示。SeV的免疫小鼠血清稀释至1∶40、1∶80、1∶320、1∶640、1∶1280、1∶2560,测量数值在2种平板的测量值均逐渐下降,多次测量此种趋势一致。2份SPF小鼠血清(NC1和NC2)的测量值在0.2以下。在超声处理的SeV病毒抗原包被平板中各样品的测量值均低于其在未经超声处理抗原平板的数据,但差异较小,超声处理未能显著影响仙台病毒抗原的抗原性。

图1 梯度稀释SeV免疫血清(P)和SPF血清(NC)在两种抗原平板的A450检测均值Fig.1 The average A450of gradient diluted SeV-immunizedserum(P)and SPF sera(NC)in the two kinds of plates
2.2 超声处理抗原包被平板同一样品检测孔间变异率较小
各血清样品在2种平板A450的测量均的变异率(%)如图2所示。各梯度小鼠免疫血清样品在未经超声处理仙台病毒抗原包被ELISA检测中测量值的变异率在1.97%~6.02%之间;在经超声处理仙台病毒抗原包被ELISA检测中测量值的变异率在0.53%~2.26%之间;2份SPF小鼠血清在未经超声处理的平板的测量值变异率为 6.81%和7.46%,在超声处理的平板的测量值变异率为2.79%和 4.34%,均高于免疫血清测量值的变异率;但所有样品在经超声处理的病毒抗原包被ELISA检测中测量值的变异率均较小。
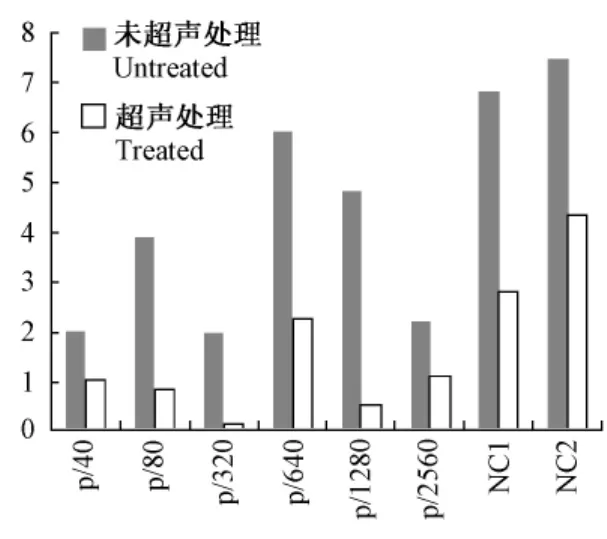
图2 各血清样品在2种平板A450测量值的变异率(%)Fig.2 The coefficient of variation(CV%)of the tested samp les(A450)in the two kinds of plates
3 讨论
酶联免疫吸附实验(ELISA)在实验动物的病原学检测中主要是利用病毒抗原包被在酶标板孔的底面,以吸附的抗原物质检测待检血清样品中抗病毒的抗体水平,因此病毒抗原的抗原性、抗原和酶标板底面的吸附性、抗原包被的剂量和检测抗体的容量等都是影响ELISA检测方法准确性的关键因素。因此寻找病原体特异性的抗原是首要因素,在小鼠的仙台病毒ELISA检测试剂盒的设计上我们依然选择病毒的天然抗原作为抗原物质进行包被,这样就排除了使用重组表达抗原漏检的可能性[3]。我们对仙台病毒的鸡胚培养物和BHK-21细胞培养物做了比较,发现细胞培养物的仙台病毒经后续纯化后抗原纯度更高,对后续实验的影响较小(数据未报道),通过抗原交叉实验确定了最佳抗原包被剂量(另文报道)。但是仙台病毒细胞培养物自身的结构状态以及其与酶标板底面的吸附性状仍需关注。
仙台病毒是单链 RNA病毒,病毒粒子多呈圆形,直径130~250nm[4]。作为副粘病毒,其与细胞组分的粘附特性值得关注。仙台病毒差速离心后,沉淀物重新悬起需要借助外力,加样器枪头吹打的机械剪切力对沉淀物混匀的效果不佳。使用电动匀浆器对沉淀进行匀浆,可以使得沉淀物成为均匀分散相,但进行12000r/min的再次离心仍然会有沉淀物存在。这表明差速离心收集的沉淀物中仍有较大团块状物质,这可能是病毒的聚集体,也有可能是病毒与细胞碎片粘附的团块。这些较大的颗粒状物质在酶标板上的吸附稳定性较差,使用同一血清样品在同一酶标板的不同孔中读出的数值偏差较大,即使进行了再次的高速离心这种团块效应依然存在。
超声波细胞破碎技术是对生物物质均质化的另一选择。超声对细胞等生物物质的热效应、空化效应和机械效应可以更好的打开病毒颗粒之间、病毒与细胞碎片之间的粘附,对沉淀物的均质化有一定作用[5]。本文报道了使用超声波对沉淀物质进行均质化处理,结果可以看出此处理降低了抗原的团块效应对于抗原与酶标板吸附的影响,降低了同一样品在不同孔之间检测数值的变异率,提高了酶标板吸附抗原的稳定性。
[1]实验动物微生物学等级及监测[S].GB14922.2-2001.
[2]侯丽波,谢军芳,佟巍,等.小鼠仙台病毒标准化血清的制备及鉴定[J].中国比较医学杂志,2008,18(9):57-59.
[3]Wan CH,Riley MI,Hook RR,et al.Expression of Sendai virus nucleocapsid protein in a baculovirus expression system and application to diagnostic assays for Sendai virus infection[J].J Clin Microbiol.1995,33(8):2007-2011.
[4]Megumi T,Nishikawa R,Fujita S,et al.Absorption spectra of viral components of Sendai virus in the wavelength region from 130to 320nm[J].J Photochem Photobiol B.1991,10(1-2):79-89.
[5]de Oliveira MZ,Vale V,Keid L,et al.Validation of an ELISA method for the serological diagnosis of canine brucellosis due to Brucella canis[J].Res Vet Sci.2011,90(3):425-31.

