经皮射频消融术治疗原发性单发小肝癌效果观察
季必勇,吕维富
(安徽医科大学附属省立医院,合肥230001)
当前原发性肝癌治疗手段主要包括外科切除、介入治疗和肝脏移植等。由于供体的缺乏及费用的高昂限制了肝移植的普遍应用,又因肝癌所固有的生物学特性、多中心生长的特点且多伴有肝内播散以及乙肝和肝硬化背景、肝功能储备差等导致外科真正切除率低(仅为20%左右[1])。而射频消融(RFA)是目前公认的第4代物理治疗手段,是一种微创性肿瘤原位治疗技术,Rossi等[2]首次报道RFA治疗肝癌以来,已成为近年来发展较快的肝恶性肿瘤治疗手段之一。目前经皮射频消融(PRFA)治疗原发性小肝癌临床应用已渐趋广泛,本文分析我院2009年4月~2012年1月行PRFA治疗原发性单发小肝癌31例,对其疗效及安全性进行了相应评估。现报告如下。
1 资料与方法
1.1 临床资料 本组为我院对原发性单发小肝癌行PRFA治疗31例,其中男24例,女7例;年龄38~82岁,中位年龄56岁。共31个病灶,其中病灶位于肝右叶23例、左叶8例。病灶直径0.8~3.0 cm、平均2.1 cm。31例患者临床表现为不同程度厌食、乏力、体质量减轻,伴或不伴有右上腹隐痛不适以及精神状态低下而来院就诊,部分患者伴有低热,均在37.9℃以内。术前11例行穿刺活检获病理诊断;未获得病理学诊断依据的20例,但术前均经多种影像学检查及临床证实,全部病例符合最新2004年中国抗癌协会肝癌专业委员会制定的原发性肝癌的临床诊断标准[3]。26例患乙肝或伴有肝硬化,肝功能Child分级A级14例,B级17例。AFP>40 ng/mL 23例(74.2%)。所有病例均由于病灶位置因素、肝功能储备差不适宜行外科手术切除或拒绝行手术切除。
1.2 RFA方法 采用和佳HGCF3000冷极射频治疗仪器及GE64层螺旋CT。患者术前均行肝脏增强CT扫描检查,明确病灶的位置、数目、大小以及与肝内重要血管及胆管的毗邻关系,确定进针入路。术前适当给予患者镇静剂,根据避开重要脏器原则,取患者平卧或侧卧位,CT平扫后取肿瘤最大层面,测出病灶中心与皮肤距离,确定最佳穿刺点及穿刺角度以及进针距离,放置体外电极板后常规消毒后铺巾,局麻药适量逐层浸润麻醉至肝包膜下,经皮穿刺置入射频消融针至肿瘤内行射频消融治疗。对于直径≤2 cm的病灶采用单点消融,而直径>2 cm的病灶采用多位点叠加消融。射频功率48 W,设置温度90~92℃,消融时间为5~12 min。消融边界超过病灶边缘0.5~1.0 cm,以确保肿瘤组织的充分坏死,以期达到病理性完全消融。治疗时间结束,完成消融后常规烧灼封闭穿刺道并拔针。术后给予镇痛、抗炎、止血及保肝治疗。
1.3 评价标准 采用WHO实体瘤客观疗效评价标准进行评判。治疗后1个月的增强CT作为疗效依据,分为完全消融(CR):肿瘤影像消失,呈低密度、无强化;不完全消融(ICR):动脉期病灶内强化,表明肿瘤局部残留(需再次行RFA治疗)。之后每隔2~3个月复查,根据随访结果判断分为稳定(SD):病灶最大截面积增减在1/4内,未出现病灶动脉期强化表现;进展(PD):病灶最大截面积增加超过1/4,动脉期病灶局限性强化或出现肝内原处复发、远处复发以及出现肝外转移(综合评估后均选择重复RFA治疗2~4次)。随访至2012年1月,随访6~33个月,平均21个月。
2 结果
2.1 术后CT随访 治疗后1个月根据CT扫描提示,本组25个(80.6%)病灶为完全消融,6个(19.4%)病灶呈不完全消融,随继续行RFA治疗。在中位 21个月的随访病程中,病灶稳定17个(54.8%),14个(45.2%)病灶进展,其中6例局部复发,3例肝内播散,另3例分别出现门静脉癌栓、腹膜后淋巴结转移以及脑转移等,多为不完全消融病例,对进展病灶其中9例继续予以射频消融治疗。14例进展病灶均直径>2 cm(典型病例见图1)。
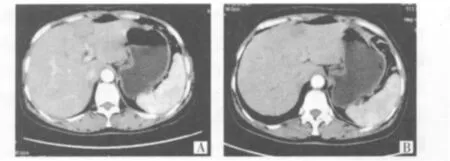
图1 小肝癌治疗前后CT图像注:A示RFA术前小肝癌位于左叶包膜下,增强后呈强化密度影,大小约2.0 cm×2.8 cm;B示RFA术后6个月复查肝左叶,病灶未见明显强化,密度均匀,体积缩小,大小约1.8 cm×2.0 cm
2.2 实验室检查
2.2.1 甲胎蛋白(AFP) 消融术前AFP阳性24例(77.4%),RFA术后早期(1~3个月)随访转阴18例,4例患者呈不同程度降低,另2例保持较高水平。
2.2.2 肝功酶(ALT/AST) 27例(87.1%)术后肝酶升高,保肝治疗后1个月内逐步下降以至恢复正常。
2.3 不良反应 27例(87.1%)于术后第2天发热,温度均在39℃以内,抗炎治疗后均降至正常;本组无胆瘘、出血、邻近脏器受损等严重并发症,无肿瘤针道种植播散的病例,未出现与治疗相关死亡病例。
2.4 生存时间 31例患者中,生存>0.5 a者29例(93.5%),>1 a者26例(83.9%),>2 a者20例(64.5%)。死亡原因为梗阻性黄疸、肝内外转移及肝功能衰竭等。
3 讨论
RFA途径有经皮、经腔镜及开腹三种。PRFA是在影像导向下将电极针置入靶肿瘤内,射频电极裸端将射频高频波传导至瘤体内,激发组织细胞发生高速离子震荡、碰撞、摩擦致热高温,局部温度达90~120℃,从而造成癌组织脱水产生凝固性坏死。同时肿瘤周边血供被毁损、切断而降低癌灶转移的风险。体外实验表明,肿瘤组织热耐受性较差,局部温度高于50℃即出现凝固性坏死,温度超过60℃时可引起细胞线粒体、溶酶体、DNA等细胞器不可逆的变性,90℃以上的持续射频高温,可有效灭活靶肿瘤及其邻近周边组织。肿瘤病灶经过RFA治疗后产生凝固性坏死、毁损,对于小病灶可达到类手术切除根治的目的[4,5],为治疗小肝癌的理想适应证[6]。有研究结果表明,RFA除可促进肿瘤细胞凋亡及抑制肿瘤血管生成之外,尚可具备增强机体细胞免疫的效能[7]。
肝癌治疗的目的是提高生存质量和延长生存期限,对不宜手术的患者,以RFA为主要代表的局部物理消融优势突出,疗效确切。三期增强CT扫描显示病灶无强化改变者,其病理基础为凝固性坏死、无血液供应,临床可视作无残余癌和复发癌。小病灶消融率高,可实现影像学完全消融,有望达到病理性完全毁损的目的。Rossi等报道,小病灶的完全毁损率95%。另据报道[8]的RFA完全消融率要高于PEI(无水乙醇化学消融)。本组术后1月随访完全消融率80.6%(25/31),低于文献的报道,但总体消融率仍呈较高趋势,本组不完全消融的主要原因是由于病灶的位置(诸如近膈顶部、近肝门大血管处或者大的胆管分支处)及形态规整性以及直径大小等因素造成。病灶进展的判定与患者生存率关系密切。CT随访后复发者毁损灶增强扫描出现动脉期强化,表明新生肿瘤组织。本组随访过程中发现进展病例14例,占45.2%(14/31),见于不完全消融者,随行重复射频治疗。初次治疗不完全消融者提示局部残留,复发几率明显增大。经过重复RFA治疗后疗效满意,CT复查病灶呈低密度、无强化改变。AFP作为临床首选应用的诊断肝癌血清标记物,其数值与肿块直径、分化度、生长情况及肿瘤内坏死呈相关性[9],AFP转阴或下降是评价PRFA疗效的重要指标,原发性肝癌患者AFP一般均有不同程度上升,对于癌灶毁损完全的小肝癌患者其指标可由阳转阴。本组血清肿瘤标记物AFP18例术后早期转阴,转阴率75.0%(18/24),其余病例均较术前下降,表明转阴率高、治疗效果确切。需要指出的是,AFP阴性肝癌的指标对其疗效不适于判定。
RFA治疗原发性小肝癌安全性高,本组术后27例出现肝酶升高,27例出现发热,经相应处理后恢复正常,其余术后各项指标均无显著进展、恶化。RFA治疗后并发症发生率低,文献报道的严重的并发症有内出血、胆汁瘘、胃肠穿孔等[10],本组并未出现此类并发症。本组病例均无手术相关死亡。并发症的发生与术者操作技术以及经验相关,我们总结的经验是,熟练掌握操作技术、严格把握适应证可有效避免射频相关并发症的发生。本组病例均符合以下条件:①病灶孤立单发,直径小,均属于3 cm以内的肿瘤结节;②术前无邻近脏器侵犯;③肝功能等级为Child-Pugh A级或B级,无严重肝功障碍患者。关于射频消融后病死率及生存率国内外相关报道情况有:国外Livraghi等[11]报道肝癌行射频消融术后的2 320例病死率为85.3%、71.3%、57.6%;国内文献报道直径≤3.0 cm的小肝癌采用RFA治疗后1、2、3年生存率分别为 94.63%、83.69%、70.47%[12]。而本研究组病例中半年生存率为93.5%(29/31),1年生存率为83.9%(26/31),2年生存率为64.5%(20/31),总体数值低于相关报道,但与文献报道大体趋势相近,笔者认为差异性可能由于病例组的样本所致。其中病例死因主要为阻塞性黄疸及全身其他脏器转移等。总之射频消融治疗孤立性小肝癌的效果较为满意,近期生存率高,其长期生存率有待进一步随访及探讨。
综上所述,RFA治疗原发性小肝癌的优点有:①操作简洁,在CT引导下确定病灶大小、位置,然后制定进针路线,射频消融治疗过程在计算机控制下进行,整个操作过程简单、流畅;②住院周期短,平均住院时间3天左右;③安全性高,RFA治疗属于微创技术、痛苦小、恢复快,由于射频消融操作风险低,类似于肝脏穿刺,故患者耐受度良好(本组未见严重并发症,多为发热等一些简单并发症,经过相应处理数日内恢复);④可重复治疗,对于出现病灶残留或复发的病例,可继续行RFA,可获得较为满意的治疗效果;⑤疗效好,对于不能手术的病例,行RFA治疗后患者的生存质量及生存时间得到明显提高。
总之,RFA治疗原发性肝癌的疗效已获普遍认同,其对孤立性小肝癌具有疗效确切、安全性高、并发症低等优点,其近期生存率尚好,远期疗效尚待进一步随访观察。随着射频消融技术持续开展和研究的继续深入,其疗效必将会进一步改善和提高。
[1]Goldberg SN.Radiofrequency tumor ablation:principles and techniques[J].Eur J Ultrasound,2001,13(2):129-147.
[2]Rossi S,Buscarini E,Garbagnati F,et al.Percutaneous treatment of small hepatic tumors by an expandable RF needle electrode[J].AJR Am J Roentgenol,1991,170(10):1015-1022.
[3]中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2004,9(suppl):67-68.
[4]Lau WY,Lai EC.The curent role of radiofrequency ablation in the management of hepatocellular carcinoma:a systematic review[J].Ann Surg,2009,249(1):20-25.
[5]Livraghi T,Meloni F,Di Stasi M,et al.Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis:is resection still the treatment of choice[J].Hepatology,2008,47(1):82-89.
[6]Livraghi T,Lazzaroni S,Meloni F.Radiofrequency thermal ablation of hepatocelluar cancer[J].Eur J Ultrasound,2001,13(2): 159-166.
[7]倪雪君,周国雄,成建萍.射频消融治疗肝癌机制的研究进展[J].世界华人杂志,2008,16:3416-3420.
[8]Leneioni RA,Allgaier HP,Cioni D,et al.Small hepatocellular carcinoma in cirrhosis:randomized comparison of radiofrequency thermal ablation versus percutaneous ethanol injection[J].Radiology,2003,228(1):235-240.
[9]贾户亮,刑戌健,叶青海,等.甲胎蛋白在原发性肝癌临床诊断中的应用[J].中国医学科学院学报,2008,30(4):440-443.
[10]Chen MH,Yang W,Yan K,et al.Treatment efficacy of radiofrequency ablation of 338 patients with hepatic malignant tumor and the relevant complications[J].World J Gastroenterol,2005,11: 6395-6401.
[11]Livraghi T,Solbiati L,Meloni MF,et al.Treatment of focal liver tumors with percutaneous radiofrequency ablation complications encountered in a multicenter study[J].Radiology,2003,226 (2):441.
[12]陈敏山,张耀军,李锦清,等.射频消融或联合经皮瘤内无水酒精注射治疗小肝癌181例疗效分析[J].中国微创外科杂志,2005,5(2):105-107.

