知母多酚对血管内皮的保护作用
严 犇,刘 康,刘保林,黄 芳
中国药科大学中药药理实验室,南京 211198
知母为百合科植物知母(Anemarrhena asphodeloides Bunge.)的干燥根茎,具有抗菌解热、降糖、降脂、抑制血小板聚集等作用。知母多酚(total phenol of Anemarrhena asphodeloides,TPAA)为其主要活性组分。体内研究发现[1-2],知母多酚能显著降低糖尿病动物的血糖。本文通过知母多酚对内皮保护作用的研究,探讨其改善糖尿病心血管并发症的作用。
1 实验材料
1.1 药物及试剂
知母购自安徽亳州药材市场,经南京中医药大学生药教研室吴启南副教授鉴定确认。知母用10倍量水煎煮2次,每次1h,放冷,过滤,浓缩至1 g· mL-1,加乙醇至含醇70%,过滤,回收乙醇,得流浸膏,再加水稀释至0.5 g·mL-1、调pH值为3,正丁醇1/3体积萃取3次,得正丁醇层,调pH值为7,以水1/3体积萃取3次,得水层,调pH值为3,正丁醇1/ 3体积萃取3次,回收正丁醇,得知母多酚,收率为2%。以芒果苷(苏州思源天然产物研发有限公司赠送,纯度99.5%以上)为对照,酒石酸亚铁反应比色法测定总酚含量为80%。经HPLC法测得,多酚中主要成分为芒果苷和新芒果苷,见图1。
牛血清白蛋白(BSA,南京生兴生物技术有限公司,批号:8C248C24);棕榈酸(palmitic acid,PA),用无水乙醇溶解、10%BSA稀释成相应浓度;胰岛素注射液 (江苏万邦生化医药股份有限公司,批号:1103240);重酒石酸去甲肾上腺素注射液(NE,天津金耀氨基酸有限公司);乙酰胆碱(Ach)、水杨酸钠、D-葡萄糖、果糖、叠氮钠均为分析纯。
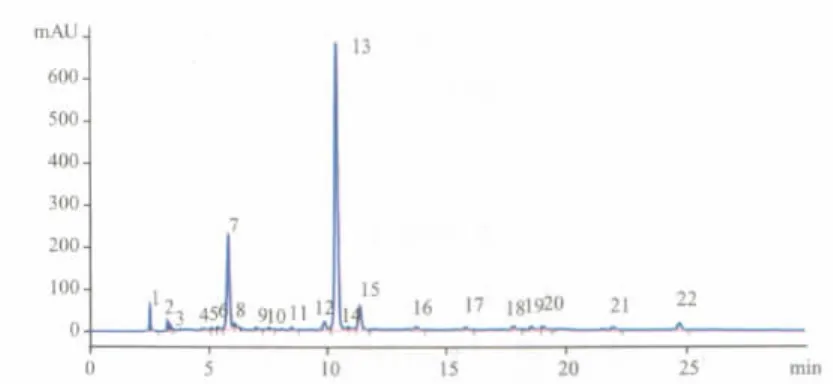
图1 知母多酚HPLC测定结果峰13为芒果苷,峰7为新芒果苷
人脐静脉血管内皮细胞株(HUVEC),购于南京凯基生物有限公司。胎牛血清(Fetal bovine serum,FBS)、DMEM培养基,Gibco公司产品。ELISA试剂盒,进口分装,南京迪兆生物科技有限公司提供。
1.2 实验动物
SD大鼠,雄性,购自扬州大学比较医学中心,合格证号:0002359;动物分笼饲养,保持昼夜节律在室温22±2℃中自由摄食和饮水。
1.3 仪器
JH-2肌张力传感器、HW-400SE恒温平滑肌槽、BL-420生物机能实验系统 (成都泰盟科技有限公司产品);RF-5301PC岛津荧光分光光度计。
1.4 统计处理
用生物机能实验系统对原始张力进行测量分析,所有实验数据均以表示,采用单因素方差分析和Student’s-t检验进行统计学分析,P<0.05认为有统计学差异。
2 方法与结果
2.1 大鼠胸主动脉环的制备
选取雄性SD大鼠,体重180~220 g,剪头后迅速打开胸腔取出胸主动脉,置于通以95%O2+5%CO2混合气体的K-H液中,仔细分离血管周围组织,清除血管内血液,剪成长2~3 mm血管环,钢钩固定于含K-H液的浴皿中,并通过张力换能器连于生物机能记录仪。给予血管环2 g左右的静息张力,平衡60 min后,重复两次加入高K+液,预收缩血管条,检查标本活性,然后用K-H液洗涤达基线。待动脉环稳定后,先以NE(1×10-6mol·L-1)收缩血管环,再分别用累进剂量ACh(1×10-9、1×10-8、1×10-7、1×10-6、1×10-5mol· L-1)舒张血管,若加ACh后使NE预收缩的血管舒张幅度>80%,认为内皮完整,可继续下一步实验。
2.2 知母多酚对大鼠胸主动脉舒张反应的影响
取内皮完整的主动脉环,在K-H液中平衡后,分组处理:(1)正常组:继续平衡60 min;(2)棕榈酸损伤组:浴槽中加入棕榈酸(100 μmol·L-1)温育30 min;(3)知母多酚组:在加入棕榈酸前30 min分别加入不同浓度的知母多酚 (10、100、300 μg·mL-1),观察其对血管张力的影响;(4)水杨酸钠组:在加入棕榈酸前30 min加入5 mmol·L-1的水杨酸钠。在上述各组继续用NE(1×10-6mol·L-1)预收缩的基础上,依次累进加入胰岛素 (1×10-9、1×10-8、1×10-7、1×10-6mol·L-1),每次间隔20 min,记录血管张力变化曲线,观察胰岛素诱导的舒张百分比。
如图2所示,棕榈酸刺激下,由胰岛素调节的内皮依赖性血管舒张受到极大程度的抑制,证明造模成功。加入不同浓度知母多酚 (10、100、300 μg· mL-1)预处理后,胰岛素调节的内皮依赖性血管舒张得到明显改善,其中高剂量组与棕榈酸损伤组比较有显著差异(*P<0.05)。证实了知母多酚对血管内皮的保护作用及作用的浓度呈梯度依赖性。
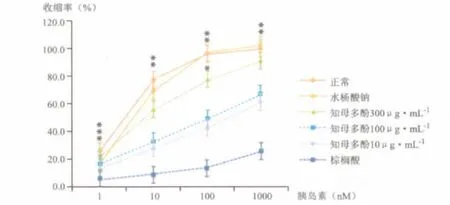
图2 知母多酚对棕榈酸损伤主动脉环舒张功能的影响正常组、水杨酸钠组、知母多酚高剂量组与模型组相比,*P<0.05
2.3 知母多酚对IL-6、TNF-α蛋白水平表达的影响
选用生长良好的HUVEC,以5×105mL-1接种于6孔培养板,每孔加入细胞悬液1 mL,待细胞融合后,换用无血清DMEM培养基,使细胞同步化后即进行实验分组:(1)正常组:用10%FBS的DMEM培养基温育HUVEC 24h;(2)棕榈酸组:加入100μmol·L-1的棕榈酸温育HUVEC 24 h;(3)知母多酚组:先分别用10、100、300 μg·mL-1的知母多酚预温育HUVEC 30 min,再加100 μmol·L-1的棕榈酸共温育HUVEC 24 h;(4)水杨酸钠组:用5 mmol·L-1的水杨酸钠预温育HUVEC 30 min,再加入100 μmol·L-1的棕榈酸共温育HUVEC 24 h;无菌操作,吸取上清液,分装,于-70℃低温冰箱保存,ELISA试剂盒检测。
如图3、图4所示,棕榈酸刺激下,炎性细胞因子IL-6、TNF-α较空白组明显增加,知母多酚(10、100、300 μg·mL-1)能显著抑制内皮细胞IL-6、TNF-α的释放。说明了知母多酚对内皮细胞的保护作用可能与抑制细胞的炎症通路有关。
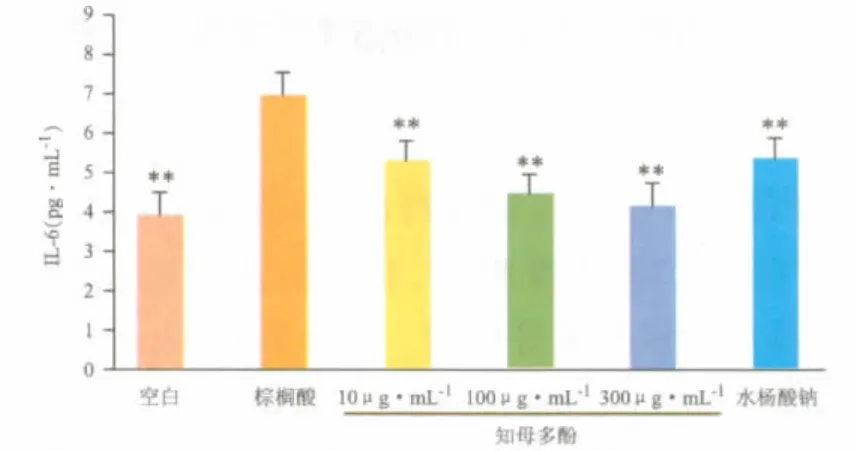
图3 知母多酚对棕榈酸刺激下内皮细胞IL-6释放的影响
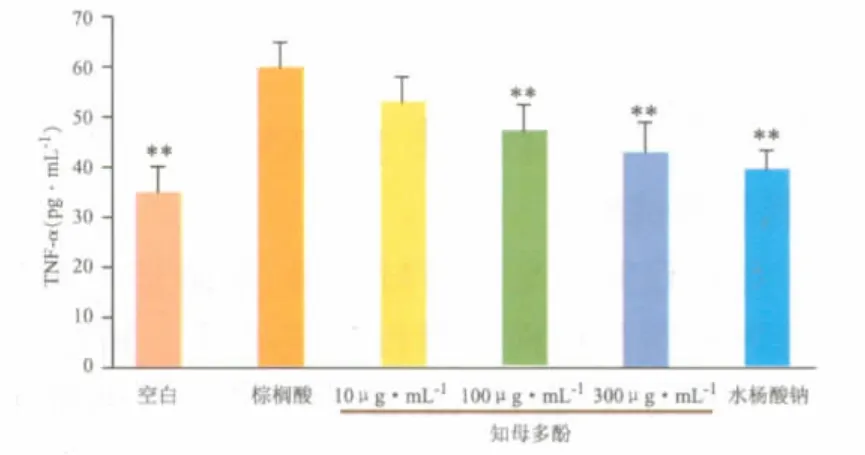
图4 知母多酚对棕榈酸刺激下内皮细胞TNF-α释放的影响
2.4 知母多酚对体外糖基化修饰蛋白质的抑制试验
反应液:BSA 0.5%、D-葡萄糖5 mmol、果糖5mmol、叠氮钠0.02%,临用前用PBS配制。将上述反应液1.9mL分装于2.0mL的试管内,再加入不同浓度的知母多酚0.1mL(临用前以PBS分别配制成1×10-2、8×10-3、6×10-3、4×10-3、2×10-3、1×10-3g·L-1),并将试管密封,置于37℃孵育各21天,形成糖基化修饰的白蛋白(AGE-BSA),阳性药为盐酸氨基胍(10、5、1mmol·L-1),另设不加任何药物的糖基化系统、无蛋白的空白组、无糖空白组,每组设4个复孔。利用AGE-BSA在激发波长370/发射波长450 nm有特征性吸收光谱,采用荧光光谱分析法测定其形成的AGE-BSA含量(激发波长370 nm,发射波长450 nm,灵敏度2,增益5,缝宽5 μm)。结果以荧光值表示,组间采用t检验。
如表1所示,与模型组相比,阳性药氨基胍盐酸盐(10 mmol·L-1)的抑制率达到86.88%;知母多酚(10-2g·L-1)的抑制率达到99.29%,而知母多酚(10-3g·L-1)的抑制率也达到66.45%。说明知母多酚能显著抑制体外糖基化产物的生成。
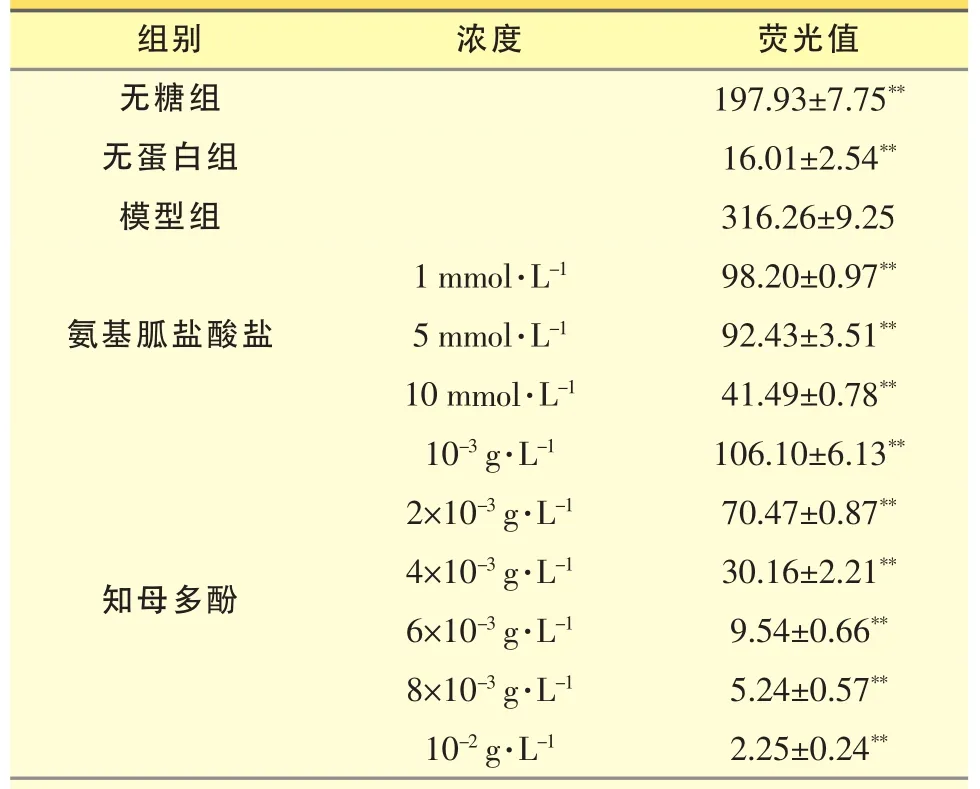
表1 TPAA对蛋白质体外糖基化终产物(AGEs)荧光值测定结果
3 讨 论
3.1 内皮细胞(VEC)是胰岛素的靶器官之一
生理浓度下胰岛素能增强内皮细胞内皮型NO合酶的表达,从而增加NO的释放;亦可直接作用于血管平滑肌,使细胞膜超极化及Ca2+通道关闭,介导血管舒张。胰岛素的这一生理活性对维持血管内皮的正常功能起着关键作用,且胰岛素介导的舒张血管活性作用具有内皮依赖性[3]。游离脂肪酸可引发血管炎症反应,促进粘附分子表达致炎性细胞因子,如白细胞介素-6、肿瘤坏死因子-α(TNF-α)等释放,其中TNF-α通过增加活性氧的生成促使NO失活,从而降低血管内皮依赖性舒张[4]。
本实验中用棕榈酸刺激大鼠胸主动脉环,胰岛素介导的主动脉环舒张作用显著下降,NO释放减少。知母多酚和水杨酸钠都能有效改善棕榈酸损伤的VEC依赖性血管舒张功能和VEC内源性NO释放。水杨酸钠是炎症反应的有效抑制剂,并且能显著恢复血管舒张功能。因此提示炎症可能参与棕榈酸作用于血管内皮的反应。
3.2 蛋白质的非酶糖基化
蛋白质的非酶糖基化是体内的葡萄糖等酮糖与体内多种蛋白质,在高糖或氧化应激条件下发生非酶催化的糖基化作用,生成可逆的Schiff碱,继而重排生成稳定的Amadori产物,再降解为α-酮醛复合物,生成棕褐色具有荧光性的糖基化终末产物(AGEs)[5]。AGEs在组织中形成和沉积后,引起组织的老化和功能衰退,在眼晶状体表现为白内障;血管基底膜的糖基化则与糖尿病微血管病变等有关。低密度脂蛋白的糖基化修饰与高血脂症、糖尿病心血管并发症有密切关系。在糖尿病患者,糖基化的速度与正常人相比大大加快,与糖尿病微血管并发症密切相关。
本实验结果发现,知母多酚用药组糖化蛋白明显减少,提示其可能对体外的非酶糖基化反应具有抑制作用。
[1] Miura T,Ichiki H,Iwamoto N,et al.Antidiabetic activity of the rhizoma of Anemarrhena asphodeloides and active components,mangiferin and its glucoside[J].Biol Pharm Bull,2001,24(9):1009-11.
[2] 黄 芳,徐丽华,郭建明,等.知母提取物的降血糖作用[J].中国生化药物杂志,2005,26(6):332-5.
[3] Steinberg HO,Chaker H,Leaming R,et al.Obesity/insulin resistance is associated with endothelial dysfunction.Implications for the syndrome of insulin resistance [J].J Clin Invest,1996,97(11):2601-10.
[4] Wimalasundera R,Fexby S,Regan L,eta1.Effect of tumor necrosis factor-alpha and interleukin 1beta on endothelium-dependent relaxation in rat mesenteric resistance arteries in vitro[J].Br J Pharmacol,2003,138 (7):1285-94.
[5] Yamagishi S.Role of advanced glycation end products (AGEs)and receptor for AGEs(RAGE)in vascular damage in diabetes[J].Exp Gerontol,2011,46(4):217-24.

