肺组织低氧代谢中葡萄糖转运蛋白1的表达及其作用*
刘义鑫,潘灵辉,林 飞,葛万运,杨 建
(广西医科大学附属肿瘤医院麻醉科,南宁 530021)
肺组织低氧代谢中葡萄糖转运蛋白1的表达及其作用*
刘义鑫,潘灵辉△,林 飞,葛万运,杨 建
(广西医科大学附属肿瘤医院麻醉科,南宁 530021)
目的探讨单肺通气对大鼠肺组织葡萄糖转运蛋白1(GLUT1)表达的影响。方法 30只Sprague Dawley大鼠经10%水合氯醛4.5mL/kg腹腔注射麻醉后行气管插管术,建立单肺通气模型,将建模后大鼠随机分为对照组(n=6)与实验组(n=24),对照组大鼠采用主支气管插管双肺通气;实验组大鼠均为右主支气管插管通气,左侧肺不通气,按左侧肺不通气时间随机分为实验0.5h组、实验1.0h组、实验2.0h组及实验4.0h组,每组6只。采用透射电子显微镜观察大鼠Ⅱ型肺泡上皮细胞(AECⅡ)超微结构,半定量逆转录聚合酶链反应(RT-PCR)检测大鼠肺组织GLUT1mRNA的表达情况。结果对照组AECⅡ细胞核内染色质分布均匀,细胞质内板层小体圆形且密度均匀,微绒毛清晰。各实验组AECⅡ的细胞核染色质、细胞质内板层小体、细胞膜及微绒毛等有不同程度的改变。与对照组比较,实验0.5h组、实验1.0h组大鼠肺组织GLUT1mRNA表达量显著降低(P0.05);实验2.0h组大鼠肺组织GLUT1mRNA表达量略有降低,但差异无统计学意义(P0.05);实验4.0h组大鼠肺组织GLUT1mRNA表达量明显增加(P0.05)。除实验1.0h组与实验0.5h组大鼠肺组织GLUT1mRNA的表达差异无统计学意义外(P0.05),其余各实验组两两比较,差异均有统计学意义(P0.05)。结论低氧条件下,肺组织GLUT1mRNA的上调对AECⅡ具有保护作用。
肺通气;细胞低氧;肺泡上皮细胞;葡萄糖转运蛋白;大鼠
单肺通气麻醉目前已广泛应用于临床。单肺麻醉时一侧肺完全萎陷,萎陷肺的血流灌注明显下降,肺组织缺氧[1]。肺泡细胞在缺氧时,依靠无氧酵解获取能量,这意味着肺泡细胞需要摄取大量葡萄糖以满足机体的正常代谢。葡萄糖转运蛋白1(glucose transporter 1,GLUT1)是GLUT家族成员之一,主要负责细胞内、外葡萄糖的跨膜转运,对调节机体糖代谢发挥关键作用。目前国内、外尚未见在低氧环境下肺泡细胞GLUT1表达的相关报道。本研究通过分析不同时间低氧对肺泡细胞中GLUT1mRNA表达的影响,探讨在低氧环境下肺泡细胞GLUT1mRNA的表达及其作用。
1 材料与方法
1.1 动物 健康Sprague Dawley大鼠30只,不分雌雄,体质量(240.0±20.0)g,由广西医科大学实验动物中心提供。
1.2 动物单肺通气模型的建立及分组 实验前大鼠禁食8h,不限制饮水。用10%水合氯醛4.5mL/kg腹腔注射麻醉,气管切开后行气管插管术,通气设置:潮气量5mL/kg、呼吸频率80次/min、吸呼比(inspiratory expiratory ratio,I:E)为1∶2,呼气末正压通气(postive end-expiratory pressure,PEEP)6cm H2O、吸入氧体积分数(fraction of inspire O2,FiO2)为1.0。将建模后大鼠随机分为对照组(n=6)与实验组(n=24),对照组大鼠采用主支气管插管双肺通气;实验组大鼠均为右主支气管插管通气,左侧肺不通气,按左侧肺不通气时间随机分为实验0.5h组、实验1.0h组、实验2.0h组及实验4.0h组,每组6只。
1.3 透射电镜检测 取各组大鼠左肺下叶组织(1mm3)置于4℃、2%戊二醛液(pH 7.4)中固定,磷酸盐缓冲溶液(phosphate buffered solution,PBS)冲洗、锇酸固定、乙醇脱水、丙酮脱水、环氧树脂Epon812包埋、100%丙酮浸透,采用LKB-Ⅴ电镜切片机(瑞典LKB公司)制成超薄切片,醋酸双氧铀-柠檬酸铅双重染色后,H-500型透射电子显微镜(日本Hitachi公司)观察组织、细胞超微结构。
1.4 半定量逆转录聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR) Trizol法提取大鼠左、右肺下叶组织总RNA,按逆转录试剂盒(美国Fermentas公司)说明进行逆转录获取cDNA,自动PCR仪(Light Cycle,美国Roche公司)扩增。GLUT1及内参β-actin引物由上海生物工程技术服务有限公司合成。GLUT1上游引物:5′-GGA GAC GCA TAG TCA CAG AAC G-3′,下 游 引 物:5′-GCC AAA GCG ATT AAC AAA GAG-3′,扩增产物长度为348bp;内参β-actin上游引物:5′-AGA TGT ACG TAG CCA TCC-3′,下游引物:5′-CTC TCA GCT GTG GTG GTG AA-3′,扩增产物长度为228bp。GLUT1循环条件:95℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸90s,共33个循环;最后72℃延伸10min,4℃保存。扩增结束后取8μL PCR产物经2%非变性琼脂糖凝胶电泳检测,凝胶成像获取的图片经Quantity One v462软件(美国Biorad公司)进行分析,以目的条带与内参灰度值的比值反映GLUT1mRNA的表达。
1.5 统计学处理 采用SPSS13.0软件进行统计学分析,计量数据用±s表示,组间比较采用方差分析和SNK(Student-Newman-Keuls)法检验(方差齐)及矫正t检验(方差不齐),以P0.05为差异有统计学意义。
2 结 果
2.1 大鼠Ⅱ型肺泡上皮细胞(alveolar epithelial cell typeⅡ,AECⅡ)的透射电镜观察 对照组大鼠AECⅡ:细胞核及其边界清晰,细胞核内染色质分布均匀;细胞质内板层小体圆形且密度均匀正常;细胞膜连续完整,微绒毛清晰,见图1。实验0.5h组大鼠AECⅡ:细胞核及其边界清楚,细胞核内染色质分布均匀;细胞质内板层小体数目减少,体积增大,呈环状排列;微绒毛排列较整齐,见图2。实验1.0h组大鼠AECⅡ:细胞核及其边界清楚,核仁偏移,细胞核内染色质不清;细胞质内板层小体体积增大,密度减小;微绒毛排列紊乱,见图3。实验2.0h组大鼠AECⅡ:细胞核及其边界清楚,细胞核变形,核仁碎裂,染色质分布不均匀;细胞质内板层小体相对密度降低,数目减少,体积增大,伴有空泡样变,微绒毛消失,见图4。实验4.0h组大鼠AECⅡ:细胞核、核仁碎裂呈2个,细胞核内染色质不清;细胞质内板层小体空泡样变,并向细胞外排出;细胞膜结构不完整,见图5。
2.2 大 鼠 肺 组 织 中GLUT1mRNA的 表 达 RT-PCR结 果 分析表明,与对照组比较,实验0.5h组、1大鼠肺织GLUT1mRNA表达量显著降低(P0.05);实验2.0h组大鼠肺组织GLUT1mRNA表达量略有降低,但差异无统计学意义(P0.05);实验4.0h组大鼠肺组织GLUT1mRNA表达量明显增加(P0.05)。除实验1.0h组与实验0.5h组大鼠肺组织GLUT1mRNA的表达差异无统计学意义外(P0.05),其余各实验组两两比较,差异均有统计学意义(P0.05),见图6。与对照组比较,实验1.0h组右肺下叶组织GLUT1mRNA的表达量降低(P0.05)。见表1、图6。
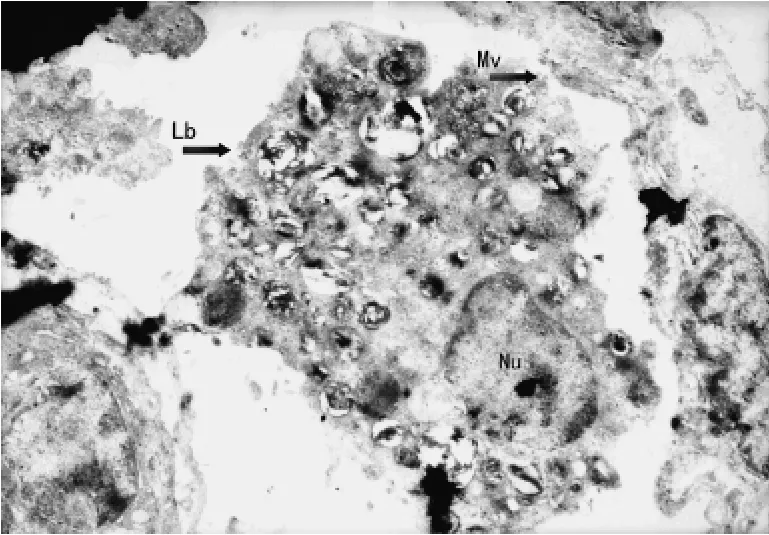
图1 对照组大鼠AECⅡ的超微结构(×2 800)。
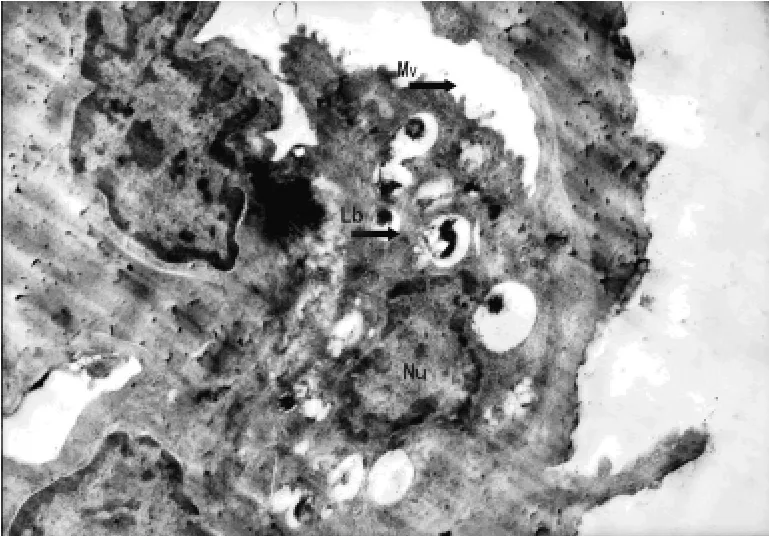
图2 实验0.5h组大鼠AECⅡ的超微结构(×4 800)

图3 实验1.0h组大鼠AECⅡ的超微结构(×4 800)
表1 对照组大鼠肺组织与实验1.0h组右肺下叶组织GLUT1mRNA表达的比较(±s,n=6)

表1 对照组大鼠肺组织与实验1.0h组右肺下叶组织GLUT1mRNA表达的比较(±s,n=6)
*:P0.05,与对照组比较。
组别GLUT1mRNA对照组0.36±0.07实验1.0h组右肺下叶组织 0.13±0.05*
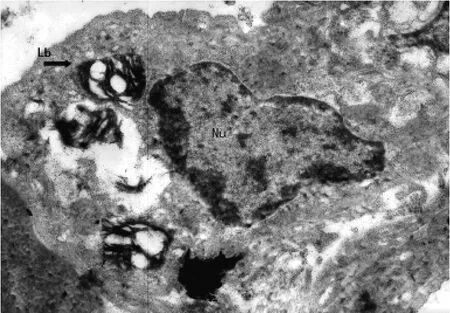
图4 实验2.0h组大鼠AECⅡ的超微结构(×7 700)
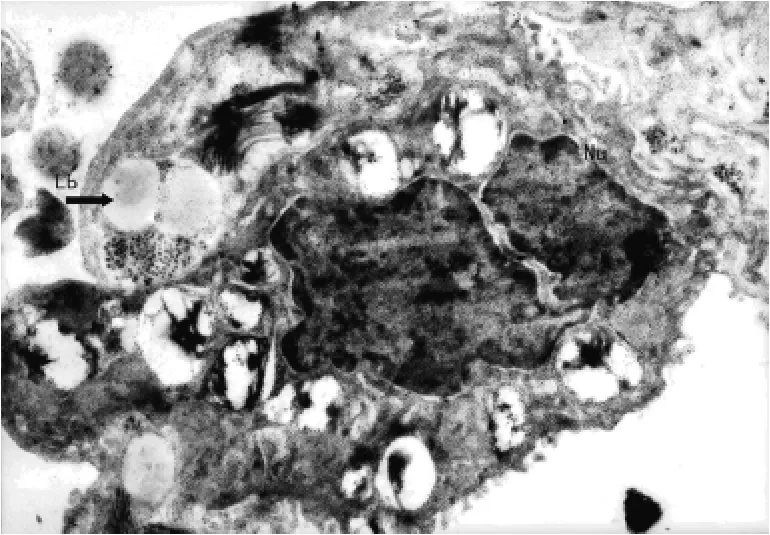
图5 实验4.0h组大鼠AECⅡ的超微结构(×5 900)
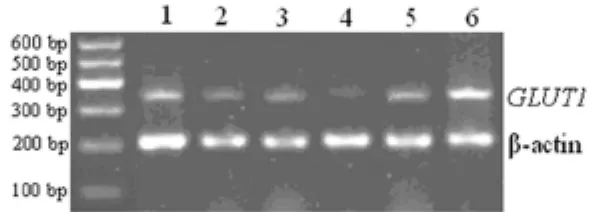
图6 各组大鼠肺组织GLUT1mRNA表达的电泳图
3 讨 论
单肺通气技术已广泛应用于胸外科手术,单肺通气技术使一侧肺通气,一侧肺萎陷停止呼吸,为手术提供良好的视野,由于大部分手术都能在4.0h内完成,因此,本研究选择单肺通气时间为0.5~4.0h。
单肺通气期间,非通气侧肺的血液没有得到氧合,其动脉血与静脉血掺杂,肺组织缺氧,导致肺组织细胞损伤及功能损害[1-2]。葡萄糖是肺泡细胞主要的能源物质。正常情况下,肺泡细胞主要靠葡萄糖的有氧代谢获取能量;而缺氧时,肺泡细胞主要靠葡萄糖的无氧酵解获取能量。1分子葡萄糖无氧酵解可净生成2分子ATP,而有氧氧化可净生成38分子ATP。因此,为了维持肺泡细胞所需的能量,细胞需要摄取大量葡萄糖。细胞摄取葡萄糖主要通过GLUT,GLUT家族中GLUT1是哺乳动物细胞内参与葡萄糖跨膜转运的主要载体,GLUT主要功能是跨膜将葡萄糖分子转运入细胞内。目前发现GLUT共有13个成员,分别命名为GLUT 1~12和H+-肌醇转 运 体 (H+myo-inositol transporter,HMIT)[3]。 其 中,GLUT1是介导细胞葡萄糖摄取的主要载体,在人体各组织、细胞中广泛存在,与代谢密切相关,主要介导细胞内外的跨膜转运,调节葡萄糖摄取,对糖代谢的调节功能发挥关键作用[4]。GLUT1的 表 达 受 多 种 因 素 的 影 响 ,缺 氧 诱 导 因 子1、降 糖 药 、肿瘤坏死因子、葡萄糖生长激素转化β成纤维细胞生长因子1和癌基因等均可上调GLUT1mRNA的表达[5]。本研究结果表明,随着低氧时间延长,尤其是单肺通气达到4h时,大鼠AECⅡ超微结构破坏越严重,细胞结构受破坏的程度与缺氧时间成正比。GLUT1是慢性缺氧的标记物[6],低氧时,GLUT1基因表达和转运能力增强,同时低亲和力的GLUT1被激活向细胞膜转位,使组织细胞摄取葡萄糖的能力增强。在缺氧的情况下,低氧诱导因子-1α(hypoxia induced factor 1α,HIF1α)表达急剧升高,激活 GLUT1 5′端的增强子序列,从而引起GLUT1mRNA的大量表达[7]。本研究表明实验0.5h组及实验1.0h组的大鼠肺组织GLUT1mRNA的表达量下调,由此,本研究增加了检测通气右肺下叶组织,结果右下肺组织通气1.0h后的GLUT1mRNA的表达量同样出现下调,说明在单肺通气0.5~1.0h时,肺血管缺氧性收缩产生肺内分流,代偿性保证了非通气左肺组织的氧供给,两侧肺泡细胞摄氧是平衡均等并能满足肺泡细胞能量代谢的需要,因此,出现GLUT1mRNA表达量下调。实验研究表明,在单肺通气超过2h后,肺泡细胞处于低氧代谢环境,AECⅡ的形态、结构和功能受到影响,AECⅡ凋亡、裂解、坏死,导致AECⅡ的数量减少,而其在短时间内不能得到补充和代偿,从而启动了GLUT1调控。因此,本实验中,大鼠肺组织GLUT1mRNA从低氧2.0h开始上调,低氧4.0h时GLUT1mRNA的表达量显著增加。Stein等[8]发现低氧时GLUT1mRNA的半衰期从0.52h增加到8.00h。Ouiddir等[9]报道,AECⅡ的GLUT1在低氧诱导下活性明显提高,在复氧后GLUT1的活性迅速降低。由此可见,低氧刺激诱导了GLUT1的表达及其活性增加,从而保证糖代谢的速率。
单肺通气可以使通气/血流比例失衡,增加肺内分流导致低氧血症[10]。有研究发现,单肺通气超过2.0h,氧合指数小于300;超过3.0h,氧合指数为216,达到急性肺损伤的诊断标准[11]。单肺通气可引起缺氧性肺损伤,甚至发展成为急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS)。缺氧时,肺泡细胞无氧代谢增加,能量匮乏,GLUT1基因表达和转运能力增强使肺泡细胞摄取葡萄糖能力增强[12],这有助于恢复肺泡细胞的能量代谢,减少组织、细胞的损害[13],对AECⅡ具有保护作用。有研究发现GLUT1表达的增加可修复缺氧对组织、细胞的损害,它可通过激活c-Jun氨基末端激酶 (c-Jun N-terminal kinases,JNK)信号途径阻止缺氧诱导的细胞凋亡[14]。进一步研究缺氧条件下肺组织GLUT1的调控机制可能对防治缺氧性肺损伤,甚至ARDS,均有重要意义。
[1] 黄冰.单肺通气期间肺损伤的机制及形态学研究[J].医学综述,2006,12(14):868-870.
[2] 金宝伟,郭建荣,金孝炬.单肺通气肺损伤机制及保护策略研究进展[J].中国急救医学,2010,30(8):745-748.
[3] Joost HG,Thorens B.The extended GLUT-family of sugar/polyol transport facilitators:nomenclature,sequence characteristics,and potential function of its novel members (review)[J].Mol Membr Biol,2001,18(4):247-256.
[4] Scheepers A,Joost HG,Schürmann A.The glucose transporter families SGLT and GLUT:molecular basis of normal and aberrant function[J].JPEN J Parenter Enteral Nutr,2004,28(5):364-371.
[5] Lukas J,Aagaard L,Strauss M,et al.Oncogenic aberrations of p16INK4/CDKN2and cyclin D1 cooperate to deregulate G1control[J].Cancer Res,1995,55(21):4818-4823.
[6] Bashan N,Burdett E,Hundal HS,et al.Regulation of glucose transport and GLUT1glucose transporter expression by O2in muscle cells in culture[J].Am J Physiol,1992,262(3Pt 1):C682-690.
[7] Katz A.Modulation of glucose transport in skeletal muscle by reactive oxygen species[J].J Appl Physiol,2007,102(4):1671-1676.
[8] Stein I,Neeman M,Shweiki D,et al.Stabilization of vas
cular endothelial growth factor mRNA by hypoxia and hypoglycemia and coregulation with other ischemia-induced genes[J].Mol Cell Biol,1995,15(10):5363-5368.
[9] Ouiddir A,Planès C,Fernandes I,et al.Hypoxia upregulates activity and expression of the glucose transporter GLUT1in alveolar epithelial cells[J].Am J Respir Cell Mol Biol,1999,21(6):710-718.
[10]刘勇,陈锋,朱涛,等.单肺通气时小潮气量对血气和血流动力学的影响[J].郧阳医学院学报,2006,25(1):34-35.
[11]游志坚,姚尚龙,梁华根.不同时间单肺通气后兔两侧肺损伤程度比较[J].中国急救医学,2007,27(2):133-135.
[12]李军,安小玲,唐杰.缺氧增加大鼠视网膜糖载体蛋白glut-1的表达[J].黑龙江医学,2004,28(3):191-192.
[13]黄缄,高钰琪,张国斌,等.大鼠缺氧习服后骨骼肌葡萄糖摄取的特点[J].第三军医大学学报,2004,26(1):5-7.
[14]Lin Z,Weinberg JM,Malhotra R,et al.GLUT-1reduces hypoxia-induced apoptosis and JNK pathway activation[J].Am J Physiol Endocrinol Metab,2000,278(5):E958-966.
Expression of glucose transporter 1 and its effects in lung tissue of hypoxic metabolism*
ObjectiveTo explore the effect of one-lung ventilation on the expression of glucose transporter 1(GLUT1)in lung tissue of rats.Methods30Sprague Dawley rats were subjected to anesthesia by intraperitoneal injection of 10%chloral hydrate 4.5mL/kg,followed by endotracheal intubation to establish rat models of one-lung ventilation.Rats after modeling were randomly divided into control group(n=6)and experimental group(n=24).Lung ventilation using main-stem bronchial intubation was conducted in rats in the control group,and in the experimental group,lung ventilation was performed through right main-stem bronchial intubation with no ventilation in the left lung.Rats in the experimental group were subdivided into experimental 0.5hgroup,experimental 1.0hgroup,experimental 2.0hgroup and experimental 4.0hgroup,according to the duration of non-ventilation in the left lung.Transmission electron microscopy was employed to observe the ultrastructure of alveolar epithelial cell typeⅡ(AECⅡ)of rats and semi-quantitative reverse transcriptase-polymerase chain reaction (RT-PCR)was adopted to detect the expression ofGLUT1 mRNA in lung tissue of rats.ResultsAECⅡin control group showed nuclear chromatin with well-distribution,cytoplasmic lamellar bodies with round shape and uniform density,and clear microvilli.AECⅡin each experimental group were found different degrees of changes in nuclear chromatin,cytoplasmic lamellar bodies and microvilli.Compared with the control group,expression ofGLUT1mRNA was significantly decreased in lung tissue of rats in experimental 0.5hgroup and experimental 1.0hgroup(P0.05),it was slightly reduced in experimental 2.0hgroup with no statistically significance,and it was markedly increase in experimental 4.0hgroup(P0.05).Paired comparison among experimental groups,except the comparison between experimental 1.0h group and experimental 0.5hgroup,differences were statistically significant(P0.05).ConclusionIn the condition of hypoxia,the up-regulation ofGLUT1mRNA in lung tissue possesses the protective effect on AECⅡ.
pulmonary ventilation;cell hypoxia;alveolar epithelial cells;glucose transporters;rats
10.3969/j.issn.1671-8348.2012.09.015
A
1671-8348(2012)09-0872-03
广 西 壮族自 治 区 科 学 技术自 然 基 金 资 助项目(桂 科 自0991235);广 西医 疗 卫 生 重 点 科研 课 题 资 助 项 目 (重2010070)。△
,Tel:(0771)5320919;E-mail:plinghui@yahoo.com
2011-11-21
2012-01-08)
•临床研究•
- 重庆医学的其它文章
- 955例HBV感染者肾功能损害的分析

