注射用头孢替唑钠与注射用卡络磺钠配伍稳定性考察
郑 芳,李 鹏,朱雪松,钟基大
头孢替唑(Cefepime)对多种革兰阳性菌及革兰阴性菌有广泛和强大的杀菌力,为第一代广谱头孢类抗生素。临床主要用于呼吸系统感染、泌尿系统感染、败血症、腹膜炎的治疗,该药对尿路感染及败血症效果很好,肾毒性极低,不良反应轻微[1]。卡络磺钠(Carbazochrome sodium sulfonate)是新一代肾上腺素腙衍生物止血药,用于毛细血管通透性增加导致的多种出血,临床常用于泌尿系统、上消化道、呼吸道和妇产科出血[2]。头孢替唑与卡络磺钠联合应用常用于出血感染的预防与治疗。由于两药的配伍稳定性未知,为了用药安全,临床用药时两药不仅分开注射,中间还以适量糖或盐的大输液作为间隔,这样需要增加患者的补液量及输注的次数,给患者带来痛苦的同时增加了护士工作量。为研究两药是否存在配伍禁忌,本实验参照有关文献[3-5],模拟临床用药浓度,在室温[(20±1)℃]、不避光条件下,对注射用头孢替唑钠与注射用卡络磺钠的配伍稳定性进行考察,为临床治疗提供理论依据。
1 仪器与试药
1.1 仪器 日本岛津LC-9A高效液相色谱仪,岛津SPD-6A紫外检测器,浙大N2000色谱工作站;HS-2060超声仪;pHs-3D型酸度计(上海雷磁仪器厂);岛津AEU-210电子天平。
1.2 试药 头孢替唑对照品(中国药品生物制品检定所,批号:130510-200301);卡络磺钠对照品(徐州莱恩药业有限公司提供);注射用头孢替唑钠(商品名:特子社复,天津新丰制药有限公司,批号:20100703;规格0.5 g/支);注射用卡络磺钠(海南通用康力制药有限公司,批号:111201,规格:40 mg/瓶);0.9%氯化钠注射液(四川科伦药业股份有限公司,批号:A10103202-2;规格: 100 mL∶0.9 g);乙腈(色谱纯,天津科密欧化学试剂有限公司,批号:20091216);水为新制注射用水;枸橼酸、磷酸二氢钾均为分析纯。
2 方法与结果
2.1 溶液配制
2.1.1 对照品溶液的配制 分别精密称取头孢替唑和卡络磺钠对照品适量,用注射用水溶解并稀释配制成浓度分别为5.05、0.41 mg/mL的头孢替唑和卡络磺钠对照品储备液;将头孢替唑和卡络磺钠对照品储备液用注射用水分别稀释25、10倍,得各自对照品溶液。
2.1.2 样品溶液的配制 将4支注射用头孢替唑钠加入100 mL 0.9%氯化钠注射液中,摇匀,得头孢替唑钠样品溶液。将2支注射用卡络磺钠加入100 mL 0.9%氯化钠注射液中,摇匀,得卡络磺钠样品溶液。
2.1.3 配伍溶液的配制 将上述头孢替唑钠样品溶液和卡络磺钠样品溶液等体积混合,得配伍溶液。
2.2 含量测定方法
2.2.1 色谱条件与系统适应性试验 色谱柱: Phenomenex C18(150 mm×4.6 mm,5 μm);检测波长:头孢替唑[6]与卡络磺钠[4]分别为 254、364 nm;流速:0.9 mL/min;灵敏度为0.4 AUFS;进样量:20 μL;柱温:20℃;头孢替唑流动相:乙腈-枸橼酸溶液(取枸橼酸3 g,加水溶解并稀释至900 mL,11∶89);卡络磺钠流动相:乙腈-0.025 mol/L磷酸二氢钾溶液(11∶89)。在上述色谱条件下,头孢替唑与卡络磺钠色谱峰的保留时间分别约为6.1、9.8 min;头孢替唑主峰的理论塔板数不低于4 000,卡络磺钠主峰的理论塔板数不低于3 000,两主峰之间及与相邻杂质峰的分离度均>1.5(见图1)。
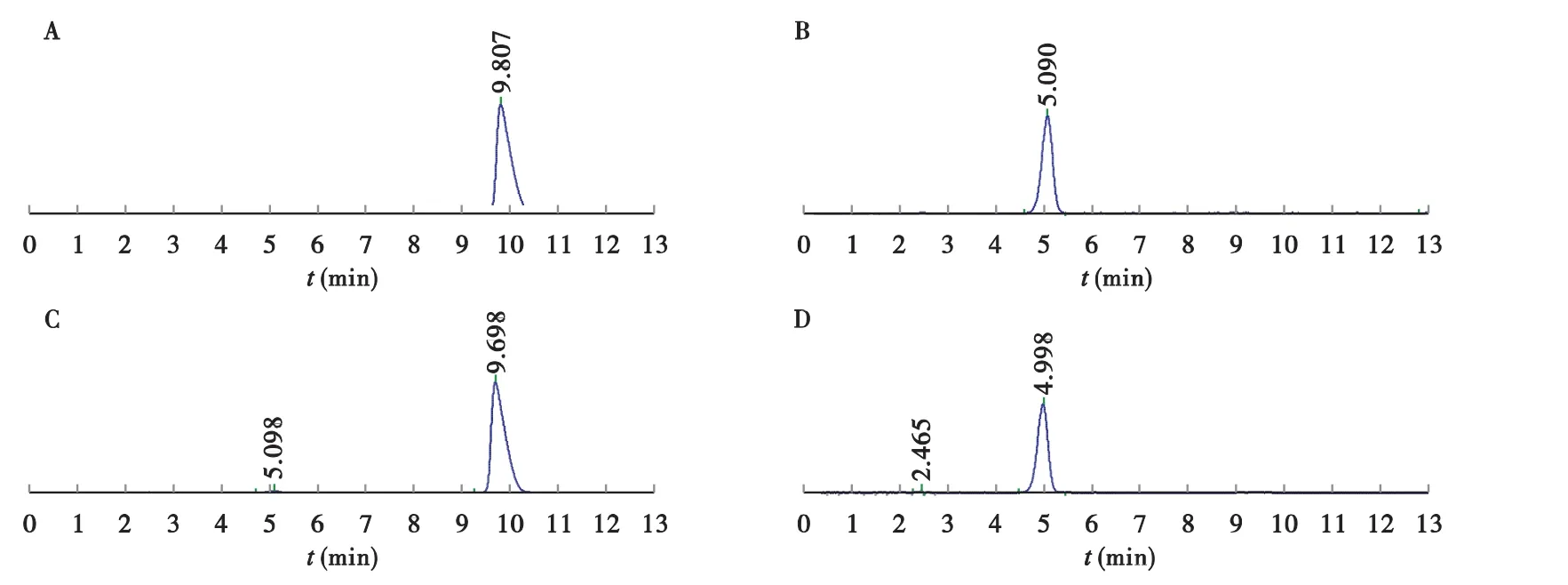
图1 高效液相色谱图注:A.头孢替唑对照品(λ=254 nm);B.卡络磺钠对照品(λ=364 nm);C.头孢替唑配伍液(λ=254 nm); D.卡络磺钠配伍液(λ=364 nm)
2.2.2 标准曲线的建立 ①头孢替唑:精密吸取“2.1”项下头孢替唑对照品储备液0.5、1.0、2.0、3.0、4.0、5.0 mL,分置50 mL量瓶中,用注射用水稀释至刻度,摇匀。在“2.2.1”项色谱条件下分别进样分析。以峰面积(Y)为纵坐标、浓度(X)为横坐标绘制标准曲线,回归方程:Y替=11 155 X替+ 29 397(r=0.999 6,n=6),结果表明,头孢替唑在50.5~505.0 μg/mL范围内,浓度与峰面积呈良好的线性关系。②卡络磺钠:精密吸取“2.1”项下卡络磺钠对照品储备液0.5、1.0、2.0、3.0、4.0、5.0 mL分置25 mL量瓶中,加注射用水稀释至刻度,摇匀。在“2.2.1”项色谱条件下分别进样上述溶液20 μL,记录峰面积。以峰面积(Y)为纵坐标、浓度(X)为横坐标绘制标准曲线,回归方程: Y卡=31 133 X卡+7 013.7(r=0.999 5,n=6),结果表明,卡络磺钠在8.2~82.0 μg/mL范围内,浓度与峰面积呈良好的线性关系。
2.2.3 精密度试验 分别进样“2.1”项下头孢替唑和卡络磺钠对照品溶液,重复进样6次,测定峰面积,结果头孢替唑、卡络磺钠的峰面积RSD分别为0.39%、0.44%。
2.2.4 重复性试验 取同一批样品,按“2.1”项下分别平行制备6份头孢替唑与卡络磺钠样品溶液,分别稀释100、20倍后进样,记录峰面积,测得头孢替唑、卡络磺钠的峰面积 RSD分别为0.54%、0.68%(n=6)。
2.2.5 溶液稳定性试验 将注射用头孢替唑钠与注射用卡络磺钠用注射用水配制成浓度约为0.2、0.04 mg/mL的溶液,置于室温下,分别于0、1、2、3、4、6 h在上述色谱条件进样20 μL,测定峰面积。结果头孢替唑与卡络磺钠峰面积RSD分别为0.56%、0.66%(n=6)。说明头孢替唑钠与卡络磺钠在上述条件下6 h内稳定。
2.2.6 加样回收率实验 精密量取已知含量的注射用头孢替唑钠样品溶液0.5 mL分置9个100 mL量瓶中,分别精密加入头孢替唑对照品储备液1.6、2.0、2.4 mL各3份,分置上述量瓶中,用注射用水稀释至刻度,摇匀,20 μL进样;精密量取已知含量的注射用卡络磺钠样品溶液1.0 mL分置9个50 mL量瓶中,分别精密加入卡络磺钠对照品储备液1.6、2.0、2.4 mL各3份,分置上述量瓶中,用注射用水稀释至刻度,摇匀,20 μL进样;以“2.2.1”项下方法测定峰面积,代入回归方程,计算浓度(X),并计算回收率,结果见表1。
2.3 配伍稳定性试验
2.3.1 外观、pH值变化 取“2.1”项下配伍溶液适量,室温下分别于0、1、2、3、4、5、6 h用纳氏比色管观察颜色变化并测定pH值,结果见表2。
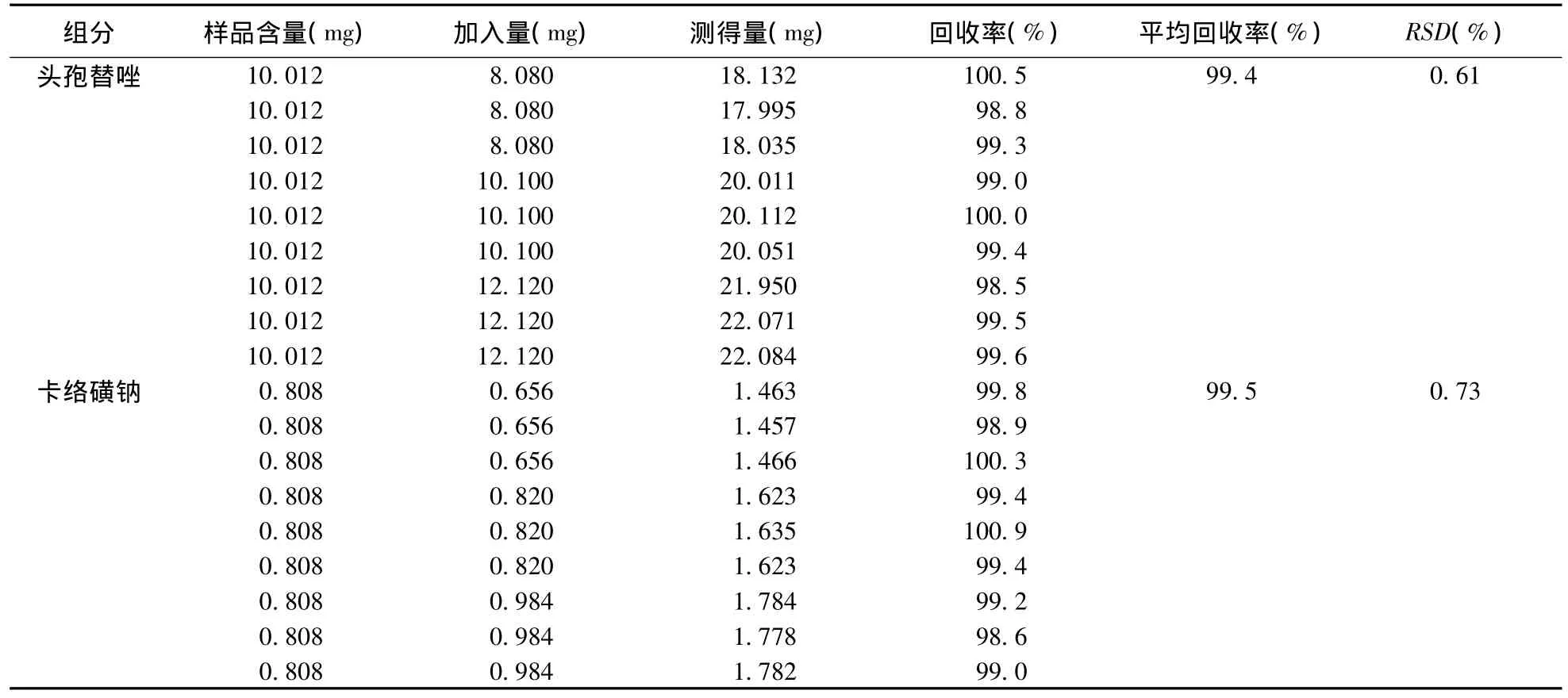
表1 加样回收率试验结果(n=9)
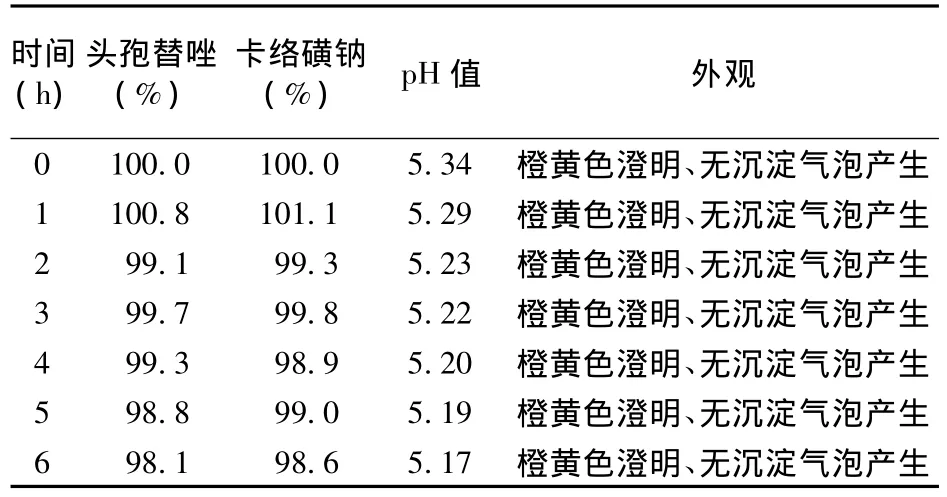
表2 注射用头孢替唑钠与注射用卡络磺钠配伍后外观、pH值及含量变化
2.3.2 相对百分含量变化 取“2.1”项下配伍溶液适量,于室温下放置,分别于0、1、2、3、4、5、6 h即刻取样,用注射用水稀释50倍,立即进样,测定头孢替唑的峰面积;同上法取“2.1”项下配伍溶液适量,在各时间点即刻用注射用水稀释10倍后立即进样,测定卡络磺钠的峰面积。以配伍0 h含量为100%计算药物相对含量变化,结果见表2。
2.3.3 结论 注射用头孢替唑钠与注射用卡络磺钠在0.9%氯化钠注射液中配伍6 h内,在室温、不避光条件下,配伍液橙黄色澄明、无气泡产生,无沉淀生成;表2结果显示,配伍6 h内,两主药含量变化<2%,pH值变化<0.2;配伍液中两药HPLC图谱峰形、保留时间均与其对照品一致;结果表明,注射用头孢替唑钠与注射用卡络磺钠6 h内配伍基本稳定。
3 讨论
由于配伍溶液中头孢替唑钠(10.0 mg/mL)与卡络磺钠(0.4 mg/mL)的临床用药浓度差别大,前者稀释倍数比后者大5倍;此外,二者的检测波长相差较大(分别为254 nm、364 nm),且在各自检测波长处,另一主药几乎无吸收峰;所以,二者含量测定不能同时进行。故笔者采取平行实验,分别测定配伍溶液中两药的含量。
本实验从外观、pH值和相对百分含量变化考察了注射用头孢替唑钠与卡络磺钠在0.9%氯化钠注射液中的配伍稳定性,结果表明,6 h内两药配伍基本稳定。若两药连续输注时,中间可以不用适量糖或盐的大输液作为间隔。这样既减少了患者的补液量及输注次数,降低了医疗费用,又节省了医患双方的时间,给护理工作带来了方便。
本实验选用HPLC法对注射用头孢替唑与注射用卡络磺钠配伍后含量进行测定,结果表明,此方法灵敏度高、专属性好。
本研究仅考察了配伍液在室温下、6 h内两药在0.9%氯化钠注射液中的配伍稳定性,对其在其他温度下或更长时间内或其他溶媒的配伍情况尚待进一步研究。该实验只做了一个临床用药浓度配比,但在临床上,用药浓度往往根据病情需要而不同,因此,有待进一步完善。
[1] 徐瑞云.药理学实验方法[M].北京:人民卫生出版社,1983: 2.
[2] 陈新谦,金有豫,汤光.新编药物学[M].第15版.北京:人民卫生出版社,2003:524.
[3] 姜红梅,郑芳,朱雪松.卡络磺钠注射液与注射用头孢西丁钠配伍的稳定性[J].医药导报,2010,29(9):1227-1229.
[4] 朱雪松,熊秋菊,郑芳,等.卡络磺钠注射液与注射用加替沙星的配伍稳定性考察[J].中国药房,2011,22(2):149-151.
[5] 何培根,闵新文,郑芳,等.头孢替唑钠、盐酸头孢甲肟在5%转化糖注射液中的配伍稳定性考察[J].安徽医药,2011,15 (5):644-646.
[6] 国家药典委员会.中华人民共和国药典(二部)[Z].北京:化学工业出版社,2010:213.

