甘草甜素对接触性皮炎小鼠表皮内结合珠蛋白的影响
郭 哲,高兴华,夏立新,王雅坤,马丽娟,何春涤,陈洪铎
肝脏在体内平衡被破坏时,会合成一组急性期蛋白,其作用是参与宿主对感染及损伤组织修复中的防御,进而保持体内平衡[1]。结合珠蛋白(Hp)是急性期蛋白之一,在肺、肝、肾上腺、脂肪组织、输尿管、附睾、卵巢、颌下腺、皮肤中均有表达[2-3]。正常小鼠的Hp mRNA表达于表皮角质形成细胞和毛囊上皮细胞中[4]。Hp有抗氧化、抗炎作用[5-7],对淋巴细胞功能有很强的免疫抑制作用。Xie等[8]发现,Hp通过阻止朗格汉斯细胞功能转换和激活T细胞来干预朗格汉斯细胞,起到抑制朗格汉斯细胞功能的作用。Arredouani等[9]发现,接触性皮炎血中Hp浓度升高。本文观察甘草甜素处理后的接触性皮炎小鼠皮肤中的Hp表达改变,现报道如下。
1 材料
1.1 实验动物 BALB/c小鼠126只,由中国医学科学院实验动物研究所提供。均为SPF级雌性,6~8周,体质量(20±2)g。
1.2 实验仪器 pH计(美国 Queue SystemsTM2711型);解剖显微镜(南汇光学仪器厂);电热恒温水箱(河北黄骅航天仪器厂,TDW-2002型);电热恒温干燥箱(天津市泰斯特仪器公司,DH3600A型);光学显微镜(日本Olympus);深低温冰箱(日本SANYO,Altra Low);紫外分光光度计(美国Spectronic GeneSys TM 2711型);电泳仪(北京六一仪器厂,DYY-Ⅲ2型);电泳槽(北京六一仪器厂,DYY-Ⅲ2型);全能型高性能台式冷冻离心机(德国Heaeus,Biofuge Stratos);组织匀浆机(德国Heidohp,Diax 900型);PCR扩增仪(德国Biometra,T-Gradient);紫外凝胶成像系统(英国 Gel workers eD,UVP GDS8000)。
1.3 主要试剂 甘草甜素(GL,商品名:美能,日本美能发源制药公司。2 mL/支,含GL 40 mg)。地塞米松磷酸钠注射液(郑州红惠制药有限公司,1 mL/支,2 mg/mL)。RT-PCR试剂:Trizol RNA提取试剂(Invitrogen公司)和 RT-PCR试剂盒(Takara公司)。原位杂交试剂:Haptoglobin原位杂交检测试剂盒(MK1806)购自武汉博士德公司。引物合成:两对引物由上海生工生物工程技术服务有限公司合成。PCR扩增用引物见表1。
2 方法
2.1 小鼠接触性皮炎模型的建立[10]小鼠于实验前1 d用脱毛剂除去腹部毛,实验第1天和第2天于每只小鼠去毛部位涂1%二硝基氯苯(DNCB,溶于4∶1丙酮∶橄榄油)50 μL各一次致敏。实验第6天,病侧耳内外侧各涂0.5%DNCB 10 μL 1次激发;右耳内外侧各涂4∶1丙酮∶橄榄油10 μL 1次,作为对照。
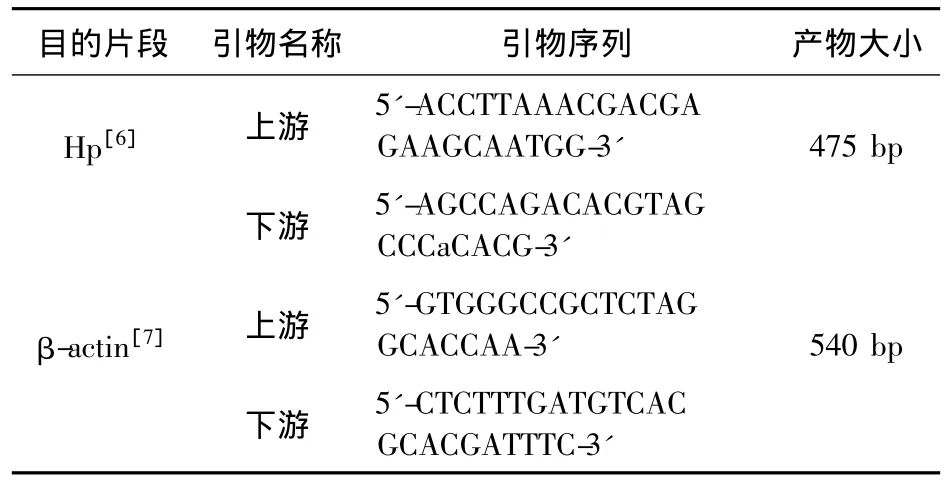
表1 PCR扩增用引物
2.2 动物分组 将126只小鼠随机分成7组,每组18只,分别为生理盐水组,GL 5、10、20、40、80 mg/kg,地塞米松1 mg/kg组(Dexa组)。在激发后腹腔注射药物,每天1次,每次0.2 mL,连续3 d。在激发后24、48、72 h用环钻取下的左右耳皮损称重后分成2份,一份用于原位杂交,另一份于-70℃冻存,以备提取总RNA。
2.3 小鼠皮肤的真表皮分离[10]用刀片刮除小鼠耳朵表面的皮脂和皮屑,除去皮下脂肪。PBS冲洗后,用镊子分离小鼠耳的两层皮肤,刮除软骨,切成0.5 cm×0.5 cm小块,加入EDTA分离液中37℃水浴,1 h后取出皮片将真表皮分开,留做原位杂交。
2.4 RT-PCR操作步骤
2.4.1 组织总RNA的提取 按照每100 mg组织中加1 mL trizol试剂,将分离好的表皮放入适量trizol试剂中,在冰浴中用匀浆机进行匀浆。匀浆速度为4档。将匀浆后的样品,冰浴5 min。按照每1 mL trizol试剂中加入0.2 mL氯仿的标准,加入适量氯仿,用力摇晃15 s,冰浴3 min。4℃以10 000 r/min离心15 min。离心后将上层无色水相移入另一新管中,按照每1 mL trizol试剂中加入0.5 mL异丙醇的标准,加入适量异丙醇。冰浴20 min。4℃以10 000 r/min离心10 min。去除上清,按照每1 mL trizol试剂中加入1 mL 75%乙醇的标准,加入适量75%乙醇。涡旋标本。4℃下,以6 000 r/min离心5 min。去除上清,空气中干燥 10 min。用0.1%DEPC水10 μL溶解RNA。
2.4.2 RNA浓度和纯度测定 取1 μL RNA溶液,用0.1%DEPC水稀释至80 μL,在紫外分光光度仪上测定RNA溶液在260 nm和280 nm处的光密度(OD)值。RNA浓度(μg/mL)=OD260×稀释倍数×40/1 000(μg/mL)。RNA纯度=OD260/ OD280,当OD260/OD280≥1.6时,认为所提取的RNA质量较好,能够进行后续操作。
2.4.3 RT-PCR反应 ①RT反应体系:10×RT缓冲液1 μL,25 mM MgCl22 μL,dNTP混合物(各10 mM)1 μL,逆转录酶0.5 μL,RNA酶抑制剂0.25 μL,Random 9 mers 0.5 μL,总RNA(≤500 ng)2 μL,加0.1%DEPC水至总容积10 μL。②RT反应条件为:30℃ 10 min,42℃ 30 min,99℃5 min,5℃5 min,1循环。③PCR反应体系:cDNA 10 μL,5×PCR缓冲液10 μL,Taq DNA聚合酶0.25 μL,20 pmol的上游或下游引物各0.5 μL,加0.1%DEPC水至总容积50 μL。④PCR反应条件为:94℃2 min,1循环;94℃40 s,60℃40 s,72℃1 min,32循环;72℃8 min,1循环;4℃5 min,1循环。
2.4.4 Hp引物 上 游:5'-ACCTTAAACG ACGAGAAGCAATGG-3';下游:5'-AGCCAGACACGTAGCCCaCACG-3',片段大小为475 bp。内对照βactin:上游:5'-GTGGGCCGCTCTAGGCACCAA-3';下游:5'-CTCTTTGATGTCACGCACGATTTC-3',片段大小为540 bp。
2.4.5 PCR产物检测 将1.5%琼脂糖凝胶置于含0.5×TBE的电泳槽中,取10 μL扩增引物与2 μL 6×上样混合液混合后上样。溴化乙啶染色。电泳结束后,在紫外凝胶成像系统上照相。
2.4.6 质量控制 设立内对照、空白和阳性对照。内对照:用β-actin引物扩增。空白对照:用0.1%DEPC水代替RNA作为模板,进行RT-PCR反应。阳性对照:从小鼠肝脏组织提取RNA作为模板,进行RT-PCR反应。
2.4.7 结果判定 染色后的产物用 FlourChen Gel Imaging System(Alpha America)进行图像分析。结果用Hp扩增产物与内对照β-actin扩增产物密度之比来表示,称为Hp相对转录产物或Hp mRNA水平。每一密度值为4次独立实验所得平均值。每一实验在相同条件下进行。结果以±s表示。
2.5 原位杂交检测
2.5.1 操作步骤 ①表皮用4%多聚甲醛固定液室温固定30 min,蒸馏水充分洗涤。②将表皮放入新鲜配制的0.5%H2O2的甲醇溶液中,室温处理30 min;蒸馏水洗涤3次。③用3%柠檬酸新鲜稀释的胃蛋白酶37℃消化1 min,蒸馏水洗涤1次。④每张片子加预杂交液20 μL后于37℃恒温箱孵育4 h。⑤每张片子加含Hp寡核苷酸探针的杂交液20 μL,盖上原位杂交专用的盖玻片,42℃恒温箱内过夜。⑥37℃ 2×SSC冲洗5 min×2,0.5×SSC冲洗15 min×1,0.2×SSC冲洗15 min ×1;加封闭液,37℃湿盒内孵育30 min。⑦加生物素化鼠抗地高辛抗体,37℃湿盒内孵育60 min,PBS冲洗5 min×4。⑧加SABC(链霉亲合素生物素复合体),37℃湿盒内孵育20 min,PBS冲洗5 min×4。⑨加生物素化过氧化物酶,37℃湿盒内孵育20 min,PBS冲洗5 min×4。⑩加底物AEC (3-氨基-9-乙基卡巴唑)后室温显色30 min,蒸馏水终止。在解剖显微镜下铺片,自然风干后,甘油明胶封片。
2.5.2 质量控制 设立阳性对照和阴性对照。阳性对照为小鼠肝脏组织,阴性对照为不含Hp mRNA的小鼠心脏组织。
2.5.3 结果判定 对每个标本进行观察,胞浆着色呈橘红色为Haptoglobin mRNA阳性。染色结果分5级:无染色,为阴性(-);轻微染色,为弱阳性(±);染色较浅,为阳性(+);染色较深,为较强阳性(++);染色深,为强阳性(+++)。
3 结果
3.1 RT-PCR结果 见表2。激发后24 h,与生理盐水组相比,GL 5 mg/kg和10 mg/kg组小鼠表皮475 bp处扩增带表达明显增强,GL 80 mg/kg和Dexa组扩增带明显减弱。激发后48 h,与生理盐水组相比,GL 5 mg/kg和10 mg/kg组小鼠表皮475 bp处扩增带仍表达增强,GL 80 mg/kg和Dexa未见扩增带。激发后72 h,与生理盐水组相比,各组表皮均未见扩增带。总体上看,48 h扩增带明显弱于24 h。真皮中各时间点均未见Haptoglobin mRNA表达。内对照:所有标本均可用β-actin扩增出540 bp片段。空白对照:未扩增出475 bp片段或540 bp片段。阳性对照:小鼠肝脏组织用Hp引物扩增出475 bp片段,用β-actin扩增出540 bp片段。
3.2 原位杂交结果 见表3。激发后24 h,GL 5 mg/kg和10 mg/kg组染色强于生理盐水组;GL 20 mg/kg和40 mg/kg组染色强度与生理盐水组相似;GL 80 mg/kg和Dexa组染色弱于生理盐水组。激发后48 h,染色强度普遍弱于24 h,GL 5 mg/kg、10 mg/kg组染色强度强于生理盐水组; GL 20 mg/kg和40 mg/kg组染色强度与生理盐水组相似;GL 80 mg/kg和Dexa组未见阳性染色。激发后72 h各组均未见阳性染色。各组真皮内未见Hp mRNA表达。阳性对照:小鼠肝细胞胞浆明显红染。阴性对照:无胞浆特异性染色出现。
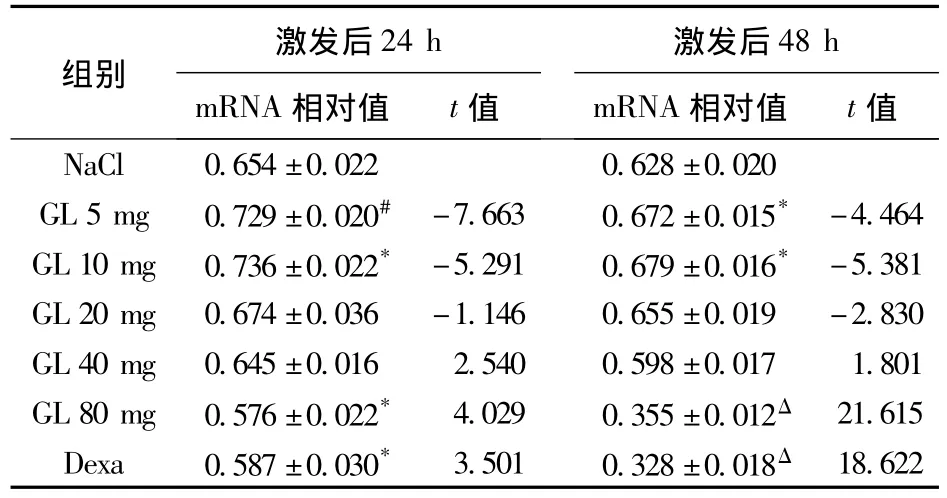
表2 GL对接触性皮炎小鼠表皮Hp mRNA表达的相对值(RT-PCR结果)
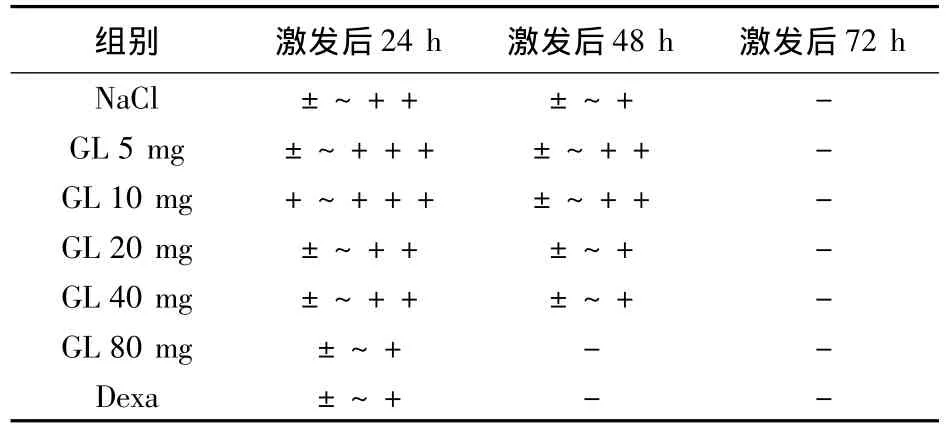
表3 GL对接触性皮炎小鼠表皮Hp mRNA表达强度的影响(原位杂交结果)
4 讨论
无论是用RT-PCR还是原位杂交方法,笔者发现,激发后 24、48 h,与生理盐水组相比,GL 5 mg/kg、10 mg/kg组 Hp mRNA表达增强,GL 80 mg/kg和地塞米松组表达减弱。说明甘草甜素双相调节接触性皮炎小鼠表皮内结合珠蛋白的表达。低剂量GL能增强小鼠表皮内Hp mRNA的表达,高剂量GL和地塞米松能减弱小鼠表皮内Hp mRNA的表达。
LC本身不能合成Hp,通过胞吞及胞吐方式摄取和排出Hp,而角质形成细胞能合成Hp[11]。Kim等[12]认为,Hp抑制表皮内不成熟的LC向成熟的抗原递呈细胞转变,具有免疫调节和抗炎作用,可能是抑制炎症部位过度的炎症反应的反馈因子之一。笔者以前的实验发现,GL5 mg/kg、10 mg/kg组可以使LC密度降低,同时减轻炎症反应,而本次实验又显示,两组表皮内Hp mRNA表达增强,因此,推测Hp可能与LC的密度降低有关。Hp mRNA表达增强,意味着更多的Hp发挥抗炎作用,使不成熟的LC向成熟的抗原递呈细胞转变受到抑制,从而使接触性皮炎小鼠的炎症反应减轻。GL 80 mg/kg和Dexa组Hp mRNA表达减弱,发挥抗炎作用的Hp减少,这也与临床实际情况相一致。笔者认为,GL增加Hp mRNA表达,可能是GL素治疗接触性皮炎的机制之一。Dexa组Hp mRNA表达减弱,说明甘草甜素和地塞米松对Hp的影响是通过不同的机制实现的,两者治疗接触性皮炎的机制也是不同的。
因为皮肤中Hp含量少,RT-PCR方法所用标本不是新鲜标本,原位杂交方法用的是新鲜标本,此外,应用的是铺片而不是切片,所以本文用原位杂交的方法检测Hp mRNA的表达,两种方法各有不足,但结果一致,说明从mRNA水平对Hp进行的检测是真实的。
总之,GL能增强小鼠接触性皮炎表皮内Hp mRNA的表达,说明GL能对急性期蛋白发挥药理作用,这可能是其治疗接触性皮炎的机制之一。
[1] Kazuno S,Fujimura T,Arai T,et al.Multi-sequential surface plasmon resonance analysis of haptoglobin-lectin complex in sera of patients with malignant and benign prostate diseases[J].Anal Biochem,2011,419(2):241-249.
[2] Holland BP,Step DL,Burciaga-Robles LO,et al.Effectiveness of sorting calves with high risk of developing bovine respiratory disease on the basis of serum haptoglobin concentration at the time of arrival at a feedlot[J].Am J Vet Res,2011,72 (10):1349-1360.
[3] Saremi B,Al-Dawood A,Winand S,et al.Bovine haptoglobin as an adipokine:serum concentrations and tissue expression in dairy cows receiving a conjugated linoleic acids supplement throughout lactation[J].Vet Immunol Immunopathol,2012,146(3-4):201-211.
[4] 李萍,夏立新,王合.结合珠蛋白mRNA在小鼠皮肤中的表达及炎症调节[J].中国免疫学杂志,2004,20(6):429-430.
[5] Delanghe JR,Langlois MR,De Buyzere ML,et al.Vitamin C deficiency and scurvy are not only a dietary problem but are codetermined by the haptoglobin polymorphism[J].Clin Chem,2007,53(8):1397-1400.
[6] Watanabe J,Grijalva V,Hama S,et al.Hemoglobin and its scavenger protein haptoglobin associate with apoA-1-containing particles and influence the inflammatory properties and function of high density lipoprotein[J].J Biolhem,2009,284 (27):18292-18301.
[7] 何多姣,李双霞,贾天军,等.结合珠蛋白与肝脏疾病的关系[J].实用医学杂志,2011,27(14):2678-2680.
[8] Xie Y,Li Y,Zhang Q,et al.Haptoglobin is a natural regulator of Langerhans cell function in the skin[J].J Dermatol Sci,2000,24:25-37.
[9] Arredouani M,Matthijs P,Hoeyveld EV,et al.Haptoglobin directly affects T cells and suppresses T helper cell type 2-cytokine releases[J].Immunology,2003,108(2):144-151.
[10] 郭哲,高兴华,王亚坤,等.甘草甜素对小鼠LC的影响[J].中华皮肤科杂志,2005,38(9):557-559.
[11] Wang H,Gao XH,Wang YK,et al.Expression of haptoglobin in human keratinocytes and Langerhans cells[J].Br J Dermatol,2005,153(5):894-899.
[12] Kim IS,Lee IH,Lee JH,et al.Induction of haptoglobin by all trans retinoic acid in THP-1 human monocytic cell line[J].Biochem Biophys Res Commun,2001,284(3):738-742.

