烷基修饰SBA-15的制备及药物缓释性能研究
李 莎, 田金凤, 张 红, 刘晓蒙, 高云鹏, 郭 卓
(1.沈阳化工大学材料科学与工程学院,辽宁沈阳110142; 2.沈阳化工股份有限公司,辽宁沈阳110026)
自成功合成有序介孔氧化硅材料M41s以来,其较高的比表面积、规则且可调的孔道结构等独特的结构特性,已经引起化学、化工和医药等诸多领域的广泛关注[1-2].而由于其无毒、较好的生物兼容性以及安全性等优点,此类材料已经发展为一种新型的药物控/缓释载体材料[3-7].目前,作为药物载体的物质主要有高分子化合物、有机酸、纤维素以及微粉硅胶等.这些传统的药物载体的载药过程是直接使载体和药物机械混合,这种方法难于将药物在载体基质上均匀地分散,从而直接影响药物的释放速率.而介孔分子筛作为药物载体的优势在于其表面丰富的硅羟基作为与药物分子相互作用的活性位点,使药物分子在介孔分子筛孔道中均匀分散,通过改变介孔分子筛和药物分子的组装条件和孔道的各项参数来调节体系的载药量,并且使药物得以缓释或者控释.徐莹璞[8]等通过三甲基氯硅烷对150 nm的介孔分子筛球进行不同程度的修饰,从而延长布洛芬药物的释放时间.曹渊[9]等合成了介孔分子筛MCM-41和氨丙基修饰的MCM-41-(CH2)3NH2,将利尿药物氢氯噻嗪分别与两种材料进行组装,结果表明:经氨丙基修饰后的MCM-41仍具有六方孔道结构及较大的载药量,MCM-41和MCM-41-(CH2)3NH2两种载药体系均能缓释,且释放速率可以通过氨丙基用量进行调节.曹渊、王晓[10]等将介孔分子筛MCM-41与丙烯酸(AA)原位聚合,制备了一种MCM-41/PAA新型复合材料.结果显示:以抗压利尿药物氢氯噻嗪为模型,MCM-41/PAA复合材料具有较高的载药量,在人工胃液和人工肠液的体外模拟释药过程中均具有敏感的pH控释性,从而可以将这种材料应用于肠道靶向控释方向.
1998年,Zhao D Y[11]等利用三嵌段的表面活性剂在强酸条件下合成了介孔SBA-15,与MCM-41相比较,介孔SBA-15的孔径更大,可以达到30 nm以上,而且孔壁也较厚,达到6 nm以上,所以,SBA-15比MCM-41的水热稳定性更好,具有更加优异的化学性质.介孔SBA-15孔道内表面也具有丰富的硅羟基,可以进行烷基化修饰,使内表面结合一些官能团,如氨基、巯基等,这些官能团不但可以改变分子筛孔道内表面的亲疏水性质,还可以作为反应位点与许多官能分子反应.
本论文采用三甲基氯硅烷对介孔分子筛SBA-15进行烷基化修饰,以布洛芬为药物模型,将修饰前后的SBA-15与布洛芬进行组装,研究不同修饰条件的组装体在模拟人工肠液中的释放速率、SBA-15的孔道结构变化对载药量的影响以及不同硅烷修饰量对布洛芬缓释性能的影响.
1 实验
1.1 试剂和仪器
三嵌段表面活性剂(EO20PO70EO20)(P123): Adrich;正硅酸乙酯(TEOS):A.R.级,质量分数28%,沈阳市东兴试剂厂;布洛芬由沈阳药科大学提供.
Siemens D5005 X射线衍射仪(CuKα);Micromertica ASAP 2010M型等温吸附仪;AIPHACENTUART FT-IR型红外光谱仪;Hitachi H-600透射电子显微镜;Perkin-Elmer 2400元素分析仪;Lambda 20紫外-可见分光光度计.
1.2 SBA-15的合成[11]
按n(TEOS)∶n(P123)∶n(HCl)∶n(H2O)= 1∶0.013∶6.3∶183的比例,称取适量模板剂P123(EO20PO70EO20),溶于去离子水中,完全溶解后加入盐酸,搅拌下缓慢加入正硅酸乙酯.先将上述混合物在40℃下搅拌20 h,再将其移入聚四氟乙烯衬垫的自升压反应釜中,100℃烘箱中静止晶化.反应产物经过滤、洗涤、干燥后得到SBA-15原粉.最后将原粉置于马弗炉中,升温速度5℃/min,在550℃下焙烧6 h,去除模板剂.煅烧后得SBA-15.
1.3 三甲基氯硅烷修饰SBA-15的合成[12]
分别称取1 g焙烧后SBA-15,在110℃下干燥24 h,然后分别置于100 mL甲苯中,混合物加热回流2 h后,分别加入三甲基氯硅烷0.2 g、1 g和2 g,然后继续回流搅拌6 h,产物经抽滤、甲苯冲洗后室温下干燥.烷基修饰后的样品分别标记为SBA-15(1∶0.2),SBA-15(1∶1)和SBA-15(1∶2).
1.4 载药量测定
分别称取SBA-15、SBA-15(1∶0.2),SBA-15 (1∶1)和SBA-15(1∶2)各0.1 g于100 mL浓度为0.10 mol/L的10 mL布洛芬标准溶液中,室温搅拌24 h后,漏斗过滤,准确移取1.0 mL滤液,适当稀释后,263 nm测定滤液的吸光度,用差减法计算组装体中布洛芬的含量.载体装载药物后,内外表面都有可能有药物布洛芬分子,吸附在外表面的药物分子无需近一步处理.药物组装体分别标记为Ibu/SBA-15、Ibu/SBA-15(1∶0.2)、Ibu/SBA-15(1∶1)、Ibu/SBA-15(1∶2).
1.5 药物释放
分别称取100 mg Ibu/SBA-15、Ibu/SBA-15 (1∶0.2)、Ibu/SBA-15(1∶1)、Ibu/SBA-15(1∶2),组装体经30 MPa压片后,室温下置于100 mL模拟人工肠液中,定时吸取释放液,紫外法在263 nm测定药物的残留量.
2 结果与讨论
2.1 XRD分析
图1为样品的小角粉末X射线衍射分析图谱.图中曲线(a)为SBA-15,曲线(b)为SBA-15 (1∶1)硅烷修饰,曲线(c)为Ibu/SBA-15,曲线(d)为Ibu/SBA-15(1∶1)组装体.
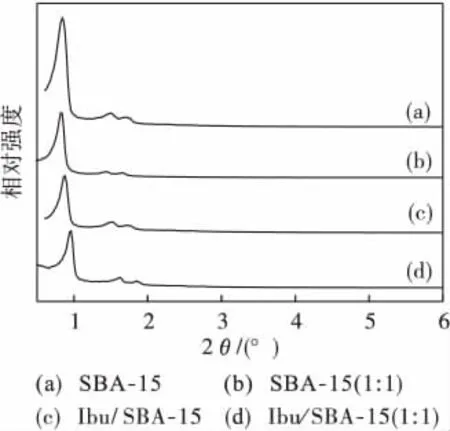
图1 XRD谱图Fig.1 XRD patterns
图中SBA-15出现3个明显的衍射峰,分别归属于六方结构(100)、(110)和(200)晶面的衍射峰,硅烷修饰后SBA-15的强衍射峰依然存在,在组装药物分子后,XRD衍射图谱中均出现3个特征衍射峰,这可以说明硅烷化和组装药物分子后,仍然保持介孔孔道结构的完整性.
2.2 FT-IR分析
图2分别为 SBA-15、SBA-15(1∶1)、Ibu/ SBA-15和Ibu样品在波长500~4 000 cm-1范围的红外光谱图.
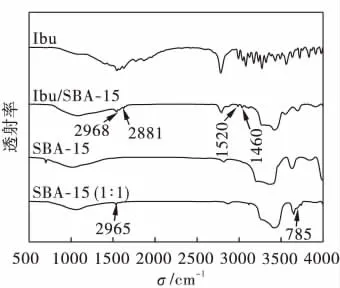
图2 SBA-15、SBA-15(1∶1)、Ibu/SBA-15和Ibu的红外光谱图Fig.2 Infrared spectra of SBA-15、SBA-15(1∶1)、Ibu/SBA-15 and Ibu
由图2可知:SBA-15经硅烷化后,红外光谱图中2 965 cm-2处硅烷化试剂残基C—H伸缩振动吸收十分明显,并在785 cm-1处出现Si—C的伸缩振动峰[13].这说明三甲基氯硅烷已嫁接到介孔的孔壁上.从图2中还可以看出:在药物组装体中,载药后样品的红外光谱图中,可以观察到药物分子季碳原子的伸缩振动峰(1 460和1 520 cm-1)以及烷基 C—Hx的伸缩振动峰2 881和2 968 cm-1).以上红外光谱分析进一步说明药物分子已经负载到介孔分子筛的孔道中.
2.3 碳元素含量分析
实验采用后嫁接法,以三甲基氯硅烷为烷基化试剂,用硅烷化试剂的浓度调节硅烷化程度.可用碳元素含量分析进一步确定硅烷化程度.结果见表1.可见调节硅烷化试剂的浓度可以有效调节硅烷化程度,随着使用三甲基氯硅烷量的增加,碳元素含量增高,说明介孔表面嫁接硅烷基团量增加,提高硅烷化程度.

表1 MCM-41硅烷化后的元素分析Table 1 Elemental analysis date of silylated MCM-41 samples
2.4 氮气吸附-脱附曲线
图3给出了SBA-15、SBA-15(1∶1)和Ibu/ SBA-15(1∶1)N2吸附-脱附等温线.
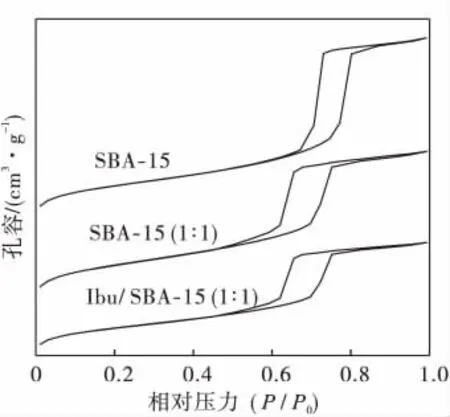
图3 SBA-15、SBA-15(1∶1)和Ibu/SBA-15(1∶1)组装体的氮气吸附-脱附等温线图Fig.3 Nitrogen adsorption-desorption isotherms of SBA-15,SBA-15(1∶1)和Ibu/SBA-15(1∶1)
从图3中可以看出:所有样品的物理吸附等温线都是Ⅳ型,是典型的介孔固体的吸附,都具有H1型滞后环.根据BJH模型计算,焙烧过的SBA-15的BET比表面积为1 080 m2g-1,由吸附分支计算其平均孔径为10.74 nm,孔容为1.18 cm3g-1.组装药物分子后,其比表面积、平均孔径和孔容分别下降为913 m2g-1、7.32 nm和0.58 cm3g-1,说明药物分子已载入介孔分子筛的孔道中,并保持介孔的孔道结构.SBA-15 (1∶1)样品与SBA-15的等温线的形状很相似,只是突跃的拐点向较小P/P0方向移动,说明对氮气的吸附量减少.这是因为经过烷基化修饰后,分子筛孔道内表面变小.当布洛芬组装进分子筛孔道之中,使分子筛孔径尺寸变小,这也说明了Ibu存在于分子筛孔道内.图4是SBA-15 (a)和Ibu/SBA-15(1∶1)(b)组装体的孔径分布曲线.在SBA-15组装药物之前,孔径大小为10.74 nm,而在组装药物分子后,孔径大小为7.32 nm,孔径变小,这也说明药物分子组装进分子筛孔道之中使分子筛孔经变小.
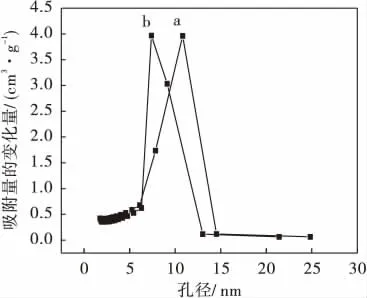
图4 SBA-15(a)和Ibu/SBA-15(1∶1) (b)组装体的孔径分布曲线Fig.4 Pore size distribution curves of SBA-15(a) and Ibu/SBA-15(1∶1)(b)
2.5 TEM
图5是组装药物后 Ibu/SBA-15(1∶1)的TEM图.从图5中可以看出:组装进药物后,分子筛仍然保持具有规则排列的孔道结构.

图5 Ibu/SBA-15(1∶1)的TEM图Fig.5 TEM of the Ibu/SBA-15(1∶1)
2.6 药物的组装量及释放性能
未经修饰的SBA-15载药量为28.32%(质量分数,以下同),硅烷化后样品 Ibu/SBA-15 (1∶0.2)、Ibu/SBA-15(1∶1)和 Ibu/SBA-15 (1∶2)的载药量分别为22.45%、20.72%和19.21%.可见经三甲基氯硅烷修饰后其载药量均有所下降,并且随烷基化程度的提高,其载药量下降.文献报道药物分子在介孔分子筛中的组装量和介孔的BET比表面积相关,比表面积越大,药物的组装量越大[14].未修饰的SBA-15的BET比表面积为 1 080 m2·g-1,经硅烷化后SBA-15(1∶0.2)、SBA-15(1∶1)和SBA-15(1∶2)样品的比表面积分别下降为984、913和872 m2·g-1.所以,硅烷化后BET比表面积均下降,使药物分子组装量下降.
图6为Ibu/SBA-15、Ibu/SBA-15(1∶0.2)、Ibu/SBA-15(1∶1)和 Ibu/SBA-15(1∶2)组装体在人工模拟肠液中药物分子的释放速曲线.
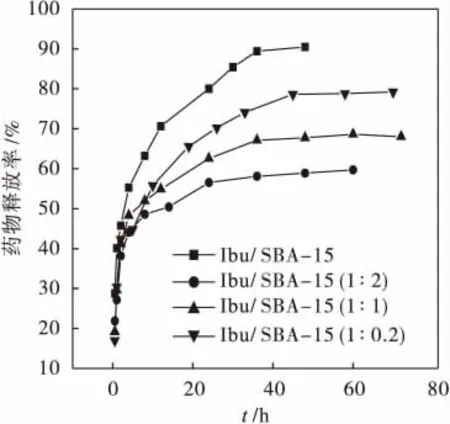
图6 Ibu/SBA-15、Ibu/SBA-15(1∶0.2)、Ibu/SBA-15 (1∶1)和Ibu/SBA-15(1∶2)组装体在人工模拟肠液中药物分子的释放速曲线Fig.6 Release ratio of Ibu from the Ibu/SBA-15、Ibu/SBA-15(1∶0.2)、Ibu/SBA-15(1∶1) and Ibu/SBA-15(1∶2)
从图6中可以看出:这几个分子筛在前几个小时释放药物的速度都比较快,在8 h时大约都释放了50%以上,10 h以后药物释放变得缓慢.对比SBA-15和烷基化的SBA-15药物释放曲线,SBA-15在9 h就达到了70.65%,30 h释药量达到85%左右;而烷基化的SBA-15表现出比SBA-15好的缓释性能,在20 h时,Ibu/SBA-15 (1∶0.2)、Ibu/SBA-15(1∶1)、Ibu/SBA-15(1∶2)的药物释放量分别为66.36%,61.86%和52.85%,随着硅烷化程度的增加,释放速率变慢.接枝量最大的Ibu/SBA-15(1∶2)10 h的释药量为48.96%,24 h时药物释放量也只有56.77%,表现出非常好的缓释性能.释放曲线中的突释是由于分子筛经过烷基化修饰后,使分子筛的孔道由亲水性变成亲油性,增强了分子筛与脂溶性药物布洛芬的作用,这样就使药物的释放速率大大降低,同时,分子筛经过修饰后,孔径变小,孔径大小可以影响药物分子的释放速率,孔径减小,增加了对药物分子的空间位阻,因而减缓了药物分子的释放速率[12].
3 结论
水热法合成介孔分子筛SBA-15,对SBA-15进行了硅烷化修饰,用XRD、红外、N2吸附、TEM等表征方法进行表征.然后将布洛芬组装进烷基化修饰的分子筛中,研究了SBA-15和不同烷基化修饰量SBA-15布洛芬组装体的释药行为,结果显示:SBA-15经三甲基氯硅烷修饰后,孔径减小,但仍然具有规则排列的孔道结构.这两种材料的载药体系均能实现缓释.修饰后释药速率进一步减慢,且随着三甲基氯硅烷接枝量的增加释药速率减慢,可通过三甲基氯硅烷修饰量来调节释放速率.
[1] Kresge C T,Leonowicz M E,Roth W J,et al.Ordered Mesoporous Molecular Sieves Synthesized by a Liquid-crystal Template Mechanism[J].Nature,1992,359:710-712.
[2] Beck J S,Vartuli J C,Roth W J,et al.A Bew Family of Mesoporous Molecular Sieves Prepared with Liquid Crystal Templates[J].J.Am.Chem.Soc.,1992,114(27):10834-10843.
[3] Zhu Y F,Shi J L,Li Y S,et al.Storage and Release of Ibuprofen Drug Molecules in Hollow Mesoporous Silica Spheres with Modified Pore Surface[J].Microporous and Mesoporous Mater,2005,85:75-81.
[4] Zhu Y F,Shi J L,Shen W H,et al.Novel Stimuliresponsive Controlled Drug Release from a Hollow Mesoporous Silica Sphere/Polyelectrolyte Multilayers Core-Shell Structure[J].Angew.Chem.Int.Ed.,2005,44:5083-5087.
[5] Vallet-Regí M,Izquierdo-Barba I,Rámila A,et al.Phosphorous-doped MCM-41 as Bioactive Material[J].Solid State Science,2005,7(2):233-237.
[6] Zeng W,Qian X F,Zhang Y B,et al.Organic Modified Mesoporous MCM-41 Through Solvothermal Process as Drug Delivery System[J].Mater.Res.Bull.,2005,40(5):766-772.
[7] Izquierdo-Barba I,Martinez áfrica,Doadrio A L,et al.Release Evaluation of Drugs from Ordered Three-dimensional Silica Structures[J].Eur.J.Pharm.Sci.,2005,26(5):365-373.
[8] 徐莹璞,王宇,曲凤玉,等.纳米介孔分子筛球作为难溶性药物长效缓释的研究[J].陶瓷学报,2010 (1):5-10.
[9] 曹渊,王晓,白英豪,等.氨丙基修饰MCM-41的制备及载药释药性能研究[J].功能材料,2005(5): 833-836.
[10]曹渊,王晓,吕丽丹,等.MCM-41/PAA的制备及释药性能[J].硅酸盐学报,2010(6):1080-1085.
[11]Zhao D Y,Feng J L,Huo Q S,et al.Triblock Copolymer Syntheses of Mesoporous Silica with Periodic 50 to 300 Angstrom Pores[J].Science,1998,279: 548-552.
[12]曲凤玉.药物分子在介孔分子筛中的组装、自组装及缓/控释研究[D].长春:吉林大学化学学院,2006:76-86.
[13]He J,Shen Y,Yang J,et al.A Nanocomposite Structure based on MCM-48 and Poly(vinyl acetate)[J].Chem.Mater.,2003,15(20):3894-3902.
[14]Qu F Y,Zhu G S,Huang S Y,et al.An Effective Control Release of Captopril Drug by Silylation of Mesoporous MCM-41[J].Chem Phys Chem,2006,7(2):400-406.

