Bmi-1 siRNA对宫颈癌Hela细胞体外增殖能力的影响
刘丹丹,姜 悦,刘 奔,刘纯青,魏 巍,张艳丽,>赵心宇,赵宝霞,孟秀香
(1.大连医科大学 诊断学实验中心,辽宁 大连116044;2.黑龙江省双鸭山市疾控中心,黑龙江 双鸭山155100;3.大连医科大学 检验医学院,辽宁 大连116044;4.山东省济南市第五人民医院 检验科,山东 济南250022)
Bmi-1基因(B-cell-specific Moloney murine leukemia virus insertion site 1)是多梳基因(polycomb group genes,PcG)家族中重要成员之一[1]。Bmi-1基因决定着某些肿瘤干细胞自我更新能力,如白血病干细胞[2]、神经肿瘤干细胞[3]和乳腺癌干细胞[4]等。很多临床研究发现Bmi-1基因与多种肿瘤关系密切,在神经胶质瘤、乳腺癌、肝癌、直肠癌及胃癌等中均发现Bmi-1表达较正常组织增高,且这种表达的增高与肿瘤组织特性(如癌组织大小、分期分级、病程、转移程度等)的相关性研究表明,Bmi-1与肿瘤的恶性程度、侵袭、转移及预后关系密切[5-7]。本文旨在研究Bmi-1 siRNA沉默Hela细胞中Bmi-1表达对Hela细胞增殖能力的影响,并探讨其机制。
1 材料和方法
1.1 siRNA重组质粒的构建与转染
根据GENEBANK中的Bmi-1 mRNA Sequence NM_005180,设计4条Bmi-1 siRNA序列和一条随机序列的阴性对照(表1)。将合成siRNA小片段与进行BamHI+HindIII双酶切的质粒pGenesil-2进行表达载体连接,获得连接有各siRNA小片段的重组质粒。利用FuGENE®HD 试剂(Roche公司)将重组质粒分别转染入Hela细胞中,转染siRNA干扰质粒的Hela细胞分别命名为Hela-S1、Hela-S2、Hela-S3、Hela-S4细胞,转染随机系列阴性对照质粒的Hela细胞命名为Hela-V细胞,未转染的Hela细胞命名为Hela-W细胞。将细胞置于37 ℃、5% CO2、饱和湿度孵箱中培养。质粒pGensil-1(由武汉晶赛公司提供)含有EGFP基因能表达荧光蛋白,用于荧光显微镜观察转染效率。
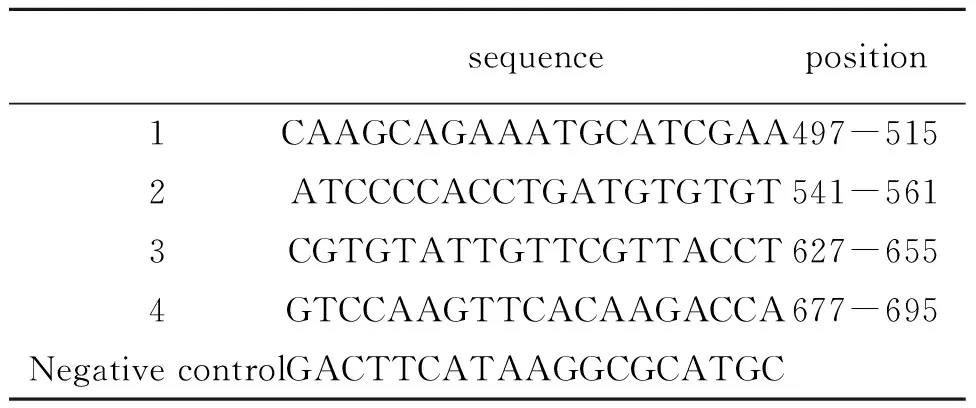
表1 Bmi-1 siRNA序列Tab 1 The siRNA target sequence of Bmi-1 gene
1.2 Bmi-1mRNA水平检测
采用逆转录-聚合酶链反应(RT-PCR)方法检测Bmi-1 mRNA。Bmi-1基因上游引物:5′-TCATCCTTCTGCTGATGCTG-3′,Bmi-1基因下游引物:5′-GCATCACAGTCATTGCTGCT-3′,扩增片断长度为221 bp。以GAPDH作为内参照基因;GAPDH上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,GAPDH下游引物:5′-GAAGATGGTGATGGGATTTC-3′,扩增片断长度为226 bp。引物由大连宝生物公司合成。扩增产物经1%琼脂糖凝胶电泳。紫外凝胶成像系统记录结果。电泳条带强度由图像分析系统进行分析。
1.3 蛋白水平检测
采用Western blot法。转染48 h后收集细胞,按南京KEYGEN公司的说明书提取蛋白。蛋白样品经15%十二烷基硫酸钠-聚丙烯酞胺凝胶电泳后,转至PVDF膜(Millipore 公司),之后与一抗(Bmi-1,CyclinD1,β-actin,Abcam公司)室温振荡孵育2 h,再分别与相应二抗(北京中杉公司)37 ℃孵育1 h,ECL化学发光试剂(北京普利莱公司)检测阳性信号,拍照,凝胶图像处理系统分析。
1.4 细胞存活率检测
转染48 h后收集细胞,用0.4%台盼蓝进行染色,分别计数100个细胞中的死亡细胞数,计算细胞存活率。
1.5 增殖能力的检测
采用MTT法检测Hela细胞的增殖能力。转染48 h后,取4组细胞接种在96孔板中,1 d后每孔加入MTT 10 μL培养4 h,然后加入150 μL DMSO,待结晶完全溶解后,用酶标仪测定吸光度值,检测波长为492 nm。连续测5 d。
1.6 细胞周期的检测
转染48 h后收集细胞,用70%乙醇4 ℃固定24 h,加入RNA酶(终浓度50 μg/mL),37 ℃1 h。加入碘化丙啶(PI,浓度100 μg/mL)溶液染色20~30 min后,在流式细胞仪上进行检测分析。
1.7 克隆形成能力检测
采用平板克隆形成实验:转染48 h后,在六孔板的每个孔中加入400个细胞,培养10 d待细胞形成克隆后,10%甲醛固定20 min后加入结晶紫染液染15 min,用数码相机拍照。计数肉眼可见的集落数。
1.8 Ki-67的检测
Ki-67一抗购自SANTA CRUZ公司;二抗及DAB显色试剂盒均购自福州迈新生物技术开发有限公司。将已消毒的盖玻片置于培养皿中,加入细胞悬液后正常培养细胞进行爬片,2 d后免疫组织化学SP法进行染色。具体操作步骤(按试剂盒说明书进行)如下:PBS中清洗爬片3次,4%多聚甲醛固定,PBS清洗,0.5%Triton X-100透膜处理,正常非动物免疫血清封阻,加Ki-67抗体4 ℃孵育过夜。次日,分别与二抗及链霉素抗生物素蛋白-过氧化物酶常温孵育,再经DAB显色、苏木染、梯度酒精脱水、二甲苯透明,最后以中性树脂封片,复光镜
下观察。此外,阴性对照片以PBS代替一抗。根据染色强度即棕色的强弱来进行定性判断。
1.9 统计学方法
用SPSS13.0软件进行统计学处理。统计数据用mean±SD表示,采用方差分析对实验结果进行统计学分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Hela细胞转染Bmi-1 siRNA后转染效果的观察
转染48 h后,提取6组细胞总RNA,进行RT-PCR反应检测Neo基因的表达,结果见图1。Hela-S1、Hela-S2、Hela-S3、Hela-S4及Hela-V细胞中均有Neo基因的表达,而Hela-W细胞中未见Neo基因的表达。同时将质粒pGensil-1转染入Hela细胞,48 h后,荧光显微镜下观察转染效率(图2)。转染效率达90%左右。
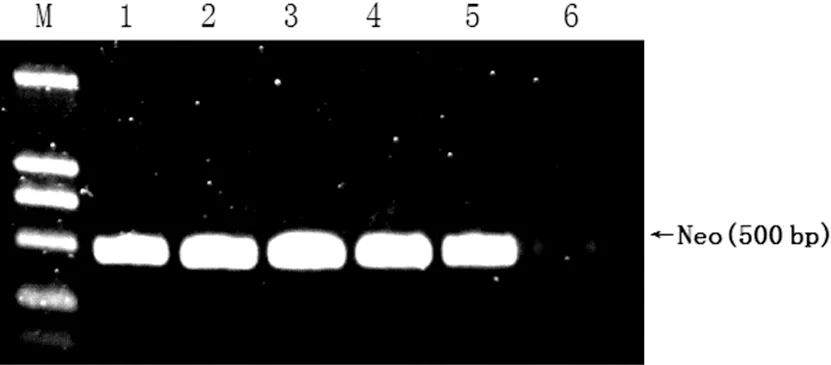
图1 6组细胞中Neo基因表达结果
Fig 1 Confirmation of plasmid transfection by antineomycin mRNA expression Lane M:DL2000;Lane 1、Lane 2、Lane 3、Lane 4、Lane 5、Lane 6分别为Hela-S1、Hela-S2、Hela-S3、Hela-S4、Hela-V和Hela-W

图2 质粒pGensil-1转染Hela细胞后荧光观察 ×100Fig 2 Efficiency of plasmid transfection ×100
2.2 转染Bmi-1 siRNA对Bmi-1表达的影响
转染48 h后,提取6组细胞总RNA,进行RT-PCR反应检测Bmi-1与GAPDH mRNA的水平,结果见图3A。结果显示:Hela-S1、Hela-S2、Hela-S3和Hela-S4细胞中Bmi-1 mRNA表达量与Hela-V和Hela-W两组细胞比较差异有显著性意义,P<0.01。Hela-V组与Hela-W组比较差异无显著性意义,P>0.05。Western blot分析6组细胞中Bmi-1与β-actin蛋白的表达见图3B。结果显示,Hela-S1、Hela-S2、Hela-S3和Hela-S4细胞中Bmi-1蛋白表达量与Hela-V和Hela-W两组细胞比较差异有显著性意义,P<0.05;而Hela-W与Hela-V组比较差异无显著性意义,P>0.05。
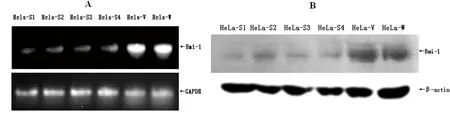
图3 siRNA对Hela细胞Bmi-1表达的影响Fig 3 Effects of Bmi-1 siRNA on Bmi-1 expression and protein translation in Hela cellsA:Bmi-1 mRNA表达;B:Bmi-1蛋白表达
如图3所示,4条干扰链均能抑制Hela细胞中Bmi-1 mRNA及Bmi-1蛋白的表达,选用Hela-S1链和Hela-S3链进行后续实验。
2.3 转染Bmi-1 siRNA对Hela细胞增殖的影响
台盼蓝染色计数细胞的存活率,转染组与对照组比较差异无显著性意义,P>0.05(图4A)。MTT法结果显示:第2天开始Hela-S1和Hela-S3细胞生长速度明显减慢(P<0.05),而Hela-W与Hela-V组比较差异无显著性意义,P>0.05(图4B)。流式细胞术分析细胞周期分布结果为:Hela-W和Hela-V细胞G0-G1期比率是(54.73±4.19)%和(54.96±5.37)%,Hela-S1和Hela-S3组的比率则分别为(76.92±8.25)%和(77.85±6.32)%。与Hela-W和Hela-V比较差异有显著性意义,P<0.05,而Hela-W与Hela-V组比较差异无显著性意义,P>0.05。
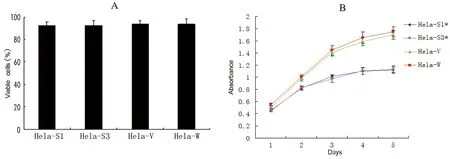
图4 Bmi-1 siRNA对Hela细胞增殖的影响Fig 4 Effects of Bmi-1 siRNA on proliferation of Hela cellsA:台盼蓝实验结果;B:细胞生长曲线*与其他两组细胞相比P<0.05
2.4 转染Bmi-1 siRNA对Hela细胞体外克隆形成能力的影响
将Hela-S1、Hela-S3、Hela-W、Hela-V各组400个细胞接种于六孔板中,10 d后各组细胞形成的集落经结晶紫染色,计数肉眼可见的克隆数目,结果发现Hela-S1、Hela-S3细胞形成的克隆数目与对照组比较差异有显著性意义,P<0.01,克隆的直径明显变小,见图5。
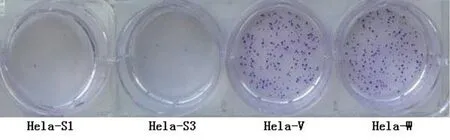
图5 Bmi-1 siRNA对Hela细胞集落形成的影响Fig 5 Effects of Bmi-1 siRNA on colony formation of HeLa cells
2.5 转染Bmi-1 siRNA对Hela细胞Ki-67及CyclinD1表达的影响
组化染色结果显示Bmi-1沉默后Ki-67明显下降(图6);Western blot结果表明:Bmi-1沉默后CyclinD1表达亦明显下降(图7)。
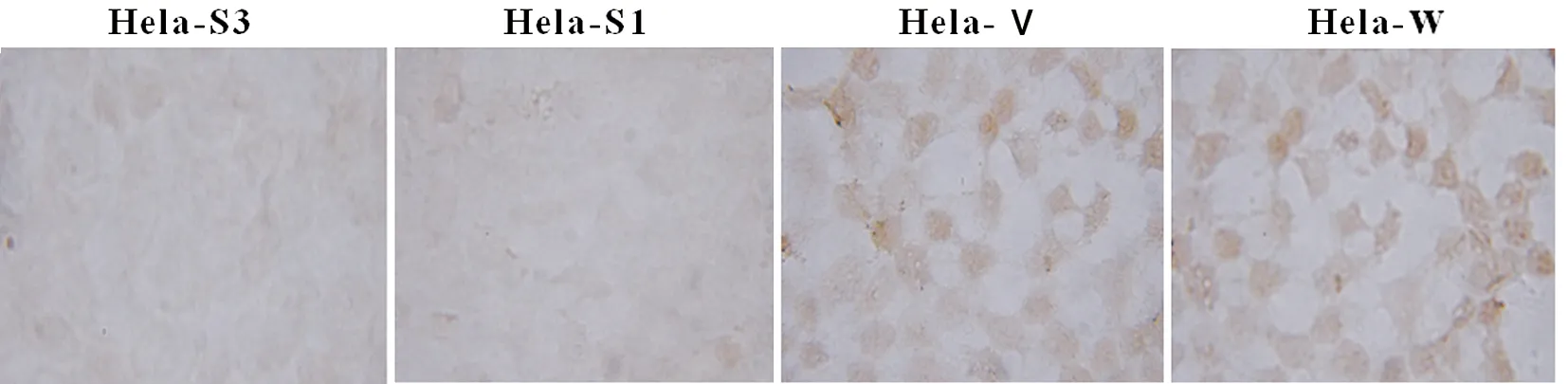
图6 Bmi-1 siRNA对Hela细胞Ki-67表达的影响
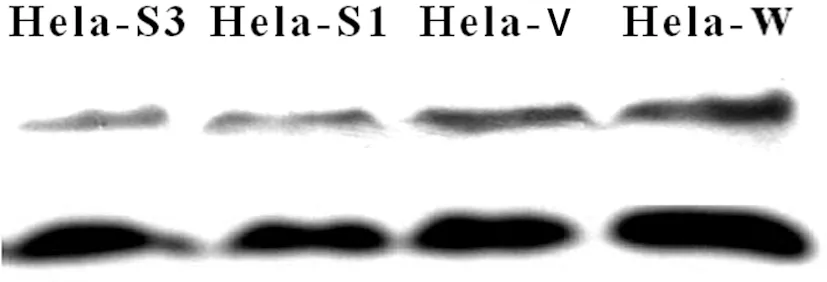
图7 Bmi-1 siRNA对Hela细胞CyclinD1表达的影响
Fig 7 Effect of Bmi-1 siRNA on CyclinD1 expression of Hela cells were analyzed by Western blot
3 讨 论
Xiao J等[8]发现沉默Bmi-1表达能够抑制胃癌细胞的增殖与侵袭,笔者在前期研究中也发现反义RNA能够抑制肺腺癌系A549细胞的增殖[9]。本研究设计了4对针对Bmi-1基因的siRNA及阴性对照的siRNA。发现这4条Bmi-1 siRNA均能沉默Hela细胞Bmi-1基因的表达,便随机选用Hela-S1、Hela-S3条Bmi-1 siRNA作后续实验。
台盼蓝结果显示,干扰组与对照组死亡细胞率相比差异无显著性意义,说明Bmi-1 siRNA不会引起Hela细胞的死亡。MTT结果显示,第2天开始Hela-S1、Hela-S3细胞的A值与对照组相比明显降低,生长速度明显减慢。说明Bmi-1 siRNA是通过抑制Hela细胞的生长速度来抑制其增殖的。而应用流式细胞仪检测各组细胞周期分布情况的结果显示,表达Bmi-1 siRNA的质粒使停滞于G0-G1期的Hela细胞明显增多。说明Bmi-1 siRNA可能是通过阻断细胞周期来抑制Hela细胞增殖的。平板克隆形成实验结果显示,Hela-S1、Hela-S3细胞形成的克隆数目与对照组相比明显减少(P<0.01),克隆的直径明显变小,表明Bmi-1 siRNA抑制Hela细胞中Bmi-1基因的表达对Hela细胞自我更新能力产生了明显的抑制作用。
Bmi-1和肿瘤发生之间最直接的联系就是Bmi-1可以抑制Ink4a/Arf位点的表达,并因此调节细胞周期和细胞增殖。Ink4a/Arf位点是Bmi-1的经典靶基因,该位点可编码2种蛋白质:p16Ink4a和p19arf(在人类为p14Arf)。最近Wu J等[10]发现Bmi-1可通过p16ink4a/CDK4通路调控鼻咽癌细胞的增殖。而Xu Z等[11]发现Bmi-1还可通过调节CyclinD1等细胞周期蛋白参与乳腺癌细胞的增殖。本研究结果显示Bmi-1表达沉默的同时,CyclinD1表达明显下降,Bmi-1是通过p16ink4a/CDK4通路还是PI3K/Akt通路来调控CyclinD1还有待于进一步探讨。
Ki-67是一种细胞核增殖抗原,是公认的准确可靠的监测细胞增殖状态的指标,近年来被认为能较有效评估肿瘤细胞增殖活性的重要标记物之一。因为其半衰期不超过1 h,阳性表达又覆盖了各种增殖期细胞整个有丝分裂期,能够减少在检测过程中出现假阴性或假阳性的结果。因而本实验检测了各组Hela细胞Ki-67的表达情况,结果发现Bmi-1表达沉默后Ki-67表达明显下降,说明二者密切相关,也为Bmi-1促进Hela细胞增殖提供了更有力的证据。
本研究利用Bmi-1 siRNA来干扰Bmi-1基因表达,发现其抑制了Hela细胞的体外增殖及克隆形成能力,同时Ki-67和CyclinD1的表达明显下降,说明Bmi-1参与了宫颈癌的发生过程。可以推测Bmi-1有望成为一个新的宫颈癌细胞标志物和作为针对肿瘤干细胞治疗的靶基因。
[1] Alkema MJ, Bronk M, Verhoeven E, et a1. Identification of Bmi-1 interacting proteins as constituents of a multimeric mammalian polycomb complex[J]. Genes Dev, 1997, 11(2): 226-240.
[2] Lessard J, Sauvageau G. Bmi-1 determines the proliferative capacity of normal and leukaemic stem cells[J]. Nature, 2003, 423(6937): 255-260.
[3] Cui H, Hu B, Li T, et al. Bmi-1 is essential for the tumorigenicity of neuroblastoma cells[J]. Am J Pathol, 2007, 170(4): 1370-1378.
[4] Liu S, Dontu G, Mantle ID, et al. Hedgehog signaling and Bmi-1 regulate self-renewal of normal and malignant human mammary stem cells[J]. Cancer Res, 2006, 66(12): 6063-6071.
[5] Häyry V, Tynninen O, Haapasalo HK, et al. Stem cell protein Bmi-1 is an independent marker for poor prognosis in oligodendroglial tumours[J]. Neuropathol Appl Neurobiol, 2008,34:555-563.
[6] Wang H, Pan K, Zhang HK, et al. Increased polycomb-group oncogene Bmi-1 expression correlates with poor prognosis in hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2008, 134(5):535-541.
[7] Liu JH, Song LB, Zhang X, et al. Bmi-1 expression predicts prognosis for patients with gastric carcinoma[J]. J Surg Oncol,2008, 97:267-272.
[8] Xiao J, Deng C. Knockdown of Bmi-1 Impairs Growth and Invasiveness of Human Gastric Carcinoma cells[J]. Oncol Res, 2009, 11-12 (17):613-620.
[9] 于琦,孟秀香,刘奔,等. 反义Bmi-1RNA转染对人肺癌细胞株A549体外增殖的影响[J]. 中华病理学杂志,2009,38(12):829-832.
[10] Wu J, Hu D, Yang G, et al. Down-Regulation of BMI-1 Cooperates With Artemisinin on Growth Inhibition of Nasopharyngeal Carcinoma Cells [J]. J Cell Biochem, 2011, 112 (7):1938-1948.
[11] Xu Z, Liu H, Lv X, et al. Knockdown of the Bmi-1 oncogene inhibits cell proliferation and induces cell apoptosis and is involved in the decrease of Akt phosphorylation in the human breast carcinoma cell line MCF-7[J].Oncol Rep, 2011, 25(2):409-418.

