小鼠中脑神经干细胞体外培养方法的研究*
肖 莉,石清明,毕文杰,苏炳银△
(1.成都医学院人体解剖与组织胚胎学教研室/发育与再生四川省重点实验室,成都 610083;2.成都军区疾病预防控制中心,成都 610021)
神经干细胞(neural stem cells,NSCs)是具有自我更新能力和多向分化潜能的一类细胞。随着NSCs鉴定、诱导、迁移、整合等技术的成熟,使得NSCs移植治疗帕金森病等神经变性疾病成为可能,且具有巨大的发展和应用前景[1]。中脑源性NSCs因具有向多巴胺能神经元分化的潜能,已成为近年来兴起并得到快速发展的干细胞移植治疗帕金森病的理想种子细胞[2]。已有许多研究小组报道了大鼠、小鼠和人胚胎中脑NSCs的分离和培养方法,但对新生小鼠中脑NSCs的分离培养方法则鲜有报道。本实验分别采用机械法和酶消化法对出生1~3 d的小鼠中脑NSCs进行了分离、培养和免疫组织化学鉴定,为研究NSCs增殖分化及临床应用奠定基础。
1 材料与方法
1.1材料 出生1~3 d的昆明种小鼠SPF级,由成都医学院实验动物中心提供。
1.2主要试剂 DMEM/F12(1∶1)培养基、胎牛血清(Hycolne公司),B27因子(Gibco,美国),碱性成纤维细胞生长因子(basic fibrob last growth factor,bFGF)(Peprotech Inc,美国);NSCs标志物抗巢蛋白(Nestin)多克隆抗体、神经元标志物抗神经元特异性烯醇化酶(NSE)多克隆抗体、星形胶质细胞标志物抗胶质纤维酸性蛋白(glial fibrillary noidic protein,GFAP)多克隆抗体、SABC免疫组织化学试剂盒(均购自Boster公司);0.25%胰蛋白酶和0.02%EDTA购自Hycolne公司,其余试剂均为国产分析纯。
1.3方法
1.3.1NSCs的分离、培养及传代 取出生1~3 d昆明种小鼠,脱颈椎处死后,浸入75%乙醇中5~10 min,用含有双抗的PBS液浸洗2~3次。在超净台中剥离颅骨,无菌条件下取出脑组织,解剖显微镜下,仔细分离中脑组织,剥离脑膜和血管,PBS液浸洗,置于无菌培养皿中,采用机械法和酶消化法2种分离培养方法。(1)机械法:用眼科剪将中脑组织反复剪碎,加入DMEM/F12培养基,混匀后移至离心管中,用吸管反复吹打5~10 min,制成单细胞悬液,1 000 r/min离心10 min,去除上清液,加入DMEM/F12培养基,经200目尼龙滤网过滤,调整细胞浓度为5×105/mL,接种于25 cm2的培养瓶中,在培养基中加入2% B27和20 ng/mL bFGF,置于37 ℃、5% CO2培养箱中培养,3 d半定量换液,7 d传代。(2)酶消化法:用眼科剪反复剪碎中脑组织后,加入0.25%胰酶-0.02%EDTA(1∶1)的消化液(覆盖组织为宜),37 ℃的培养箱中消化5~8 min,加入含有10%胎牛血清的培养基终止消化,吸管吹打混匀,1 000 r/min离心10 min,弃上清,加入DMEM/F12培养基,经200目尼龙滤网过滤,调整细胞浓度为5×105/mL,接种于25 cm2的培养瓶中,在DMEM/F12培养基中加入2% B27和20 ng/mL bFGF,其余培养方法同前。原代培养第7天,在低倍镜(×100)下随机选取5个视野进行细胞计数,对上述2种方法进行统计学分析。原代培养第7天,用吸管反复吹打瓶底,将液体移入离心管中,1 000 r/min离心5 min,吸弃上清液,加入DMEM/F12培养基,2% B27和20 ng/mL bFGF,将神经球吹打成单个细胞或小细胞团,以5×105/mL密度接种于培养瓶中继续培养,每隔5~7天传代1次。
1.3.2NSCs的诱导分化 将生长状态良好的第2代NSCs,吸管反复吹打,离心后用含有10%胎牛血清的培养基诱导分化,接种于6孔板中,倒置显微镜下观察细胞的形态和生长状况。诱导分化7 d后进行免疫细胞化学检测。
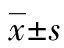

2 结 果
2.1机械法与酶消化法对原代细胞生长的影响 原代培养至24 h后,两组细胞均呈悬浮生长,圆形,大小不等,胞体透明,可见少量细胞碎片。72 h后细胞碎片增多,部分悬浮生长的细胞分裂或聚集为细胞团,即为神经球。每个神经球由2~4个到数十个细胞组成(封2图1)。原代细胞不断增殖,培养至5~7 d,培养基中可见胞体较大,圆形或椭圆形的神经球,其边界清楚,折光性强。每个神经球是由十个至数百个细胞组成,细胞排列紧密,呈“桑葚胚样”(封2图2)。在低倍镜(×100)下观察神经球的数量,机械法的细胞球的数量(34.4±2.07)明显高于酶消化法(24.6±2.88),差异有统计学意义(P<0.05),且酶消化法可见较多的细胞碎片和部分贴壁细胞。
2.2传代培养 原代细胞培养第6~7天,由于细胞体积较大,中央部由于缺乏营养而影响细胞的生长,因此需要及时传代。采用酶消化法,发现随着传代次数的增加,神经球数量无明显增加,部分神经球出现贴壁分化,少数体积较大的细胞由于中央缺乏营养,神经球增殖力明显减弱。采用机械吹打法,细胞生长状态良好,可传至第5代。
2.3NSCs的鉴定 将原代培养7 d的神经球进行免疫细胞化学检测,发现绝大多数神经球在含有10%胎牛血清的DMEM/F12培养基中,2~3 h即可贴壁,神经球Nestin免疫反应呈阳性(封2图3、4)。在高倍镜(×200)下观察,机械法的阳性神经球的数量(14.2±1.92)显著高于酶消化法(8.2±2.17),差异有统计学意义(P<0.05)。
2.4NSCs诱导分化细胞的免疫细胞化学鉴定 将原代或传代培养7 d的神经球在有血清的培养基中进行诱导分化,2~3 h贴壁,4~5 d后可见细胞从神经球中迁移出来,胞体呈星形、锥体形或不规则形(封2图5)。继续培养,细胞伸出突起,7~9 d后突起相互交织成网状(封2图6)。免疫细胞化学染色显示GFAP或NSE免疫反应阳性细胞(封2图7、8)。
3 讨 论
NSCs是一种具有自我增殖及多向分化潜能的前体细胞,近年来已成为治疗中枢神经系统退行性疾病和损伤性疾病的新途径[3-6]。研究发现,NSCs不仅存在于胚胎发育阶段,而且终生存在;不仅存在于最初认为的两个生发区(脑室下区和海马颗粒下区),还存在于中脑、皮层等脑区。目前,绝大多数研究是从小鼠、大鼠和人的胚胎脑中分离培养中脑NSCs。但前期实验中发现采用胚胎小鼠存在操作方法复杂、容易导致污染,且中脑组织相对量较少、分离取材部位不易明确等缺点。本实验选用出生1~3 d的小鼠,成功培养出中脑组织NSCs,具有操作简单、重复性好的特点。
细胞分离分别采用机械法和酶消化法。实验初期用0.25%胰蛋白酶和0.02% EDTA消化中脑组织。细胞培养72 h,可见悬浮生长的神经球,但数量较少。随着传代次数的增加,神经球数量无明显增加,部分神经球出现贴壁分化,少数体积较大的细胞由于中央缺乏营养,神经球增殖力明显减弱。实验中还发现酶消化法对时间的控制非常严格,消化时间最好控制在5~8 min,若消化时间过长即出现消化液的颜色变得清亮,无组织碎块,会影响细胞的生长,甚至由于细胞碎片较多而导致细胞死亡。此外,NSCs表面具有多种生长因子受体,酶消化作用于细胞表面可能会损伤部分细胞膜受体[7]。而机械法操作步骤简便,减少了胰蛋白酶及反复离心对细胞的损伤,免疫组织化学显示原代培养第7天的细胞巢蛋白染色阳性,且神经球的数目明显高于酶消化法,传代后细胞生长状态良好,有利于今后诱导分化及细胞移植实验中对于神经球数量的要求。
目前,NSCs多采用无血清的基础培养基,目的是去除血清中可能诱导NSCs分化的生长因子等干扰因素。同时需添加神经营养添加剂,B27含有必需脂肪酸、抗氧化剂、维生素等成分,是无血清培养基的理想添加剂[8]。此外,还需添加促进细胞有丝分裂的生长因子,已证实bFGF对NSCs增殖的早期阶段发挥促有丝分裂的作用[9]。本实验采用含有2% B27和20 ng/mL bFGF的DMEM/F12培养基,成功地培养出了中脑NSCs。
巢蛋白是在中枢神经系统干细胞中发现的一种神经元中间丝蛋白,其表达始于神经胚形成时,成熟的神经元和胶质细胞中无此蛋白,是目前最常用的NSCs特异性分子标志[10-15]。本实验对贴壁2~3 h的神经球行Nestin免疫细胞化学染色,结果显示呈阳性反应。当加入含10%胎牛血清的DMEM/F12培养基中继续培养4~5 d后,神经球发生贴壁分化,免疫细胞化学显示NSE和GFAP呈阳性。表明获得的细胞为NSCs,具有分化为神经元和神经胶质细胞潜能的NSCs。
综上所述,本实验成功分离培养出新生小鼠中脑NSCs,并观察其生物学特性。在以后的研究中,将重点探讨中脑NSCs体外定向诱导分化为多巴胺能神经元
的条件,分析其调控机制,为其作为种子细胞进行体内移植治疗帕金森病提供实验学基础。
[1]Arias-Carrion O,Yuan TF.Autologous neural stem cell transplantation:a new treatment option for Parkinson's disease?[J].Med Hypotheses,2009,73(5):757-759.
[2]丁继固.中脑神经干细胞转基因治疗帕金森病:可能与否?[J].中国组织工程研究与临床康复,2010,14(10):1855-1860.
[3]Taupin P.Stem cell engineering for cell-based therapy[J].Neural Eng,2007,4(3):R59-63.
[4]Fauza DO,Jennings RW,Teng YD,et al.Neural stem cell delivery to the spinal cord in an ovine model of fetal surgery for spina bifida[J].Surgery,2008,144(3):367-373.
[5]Gritti A,Bonfanti L.Neuronal-glial interactions in central nervous system neurogenesis:the neural stem cell perspective[J].Neuron Glia Biol,2007,3(4):309-323.
[6]Bithell A,Williams BP.Neural stem cells and cell replacement therapy:making the right cells[J].Clin Sci(Lond),2005,108(1):13-22.
[7]Wachs FP,Couillard-Despres S,Engelhardt M,et al.High efficacy of clonal growth and expansion of adult neural stem cells[J].Lab Invest,2003,83(7):949-962
[8]Willerth SM,Faxel TE,Gottlieb DI,et al.The effects of soluble growth factors on embryonic stem cell differentiation inside of fibrin scaffolds[J].Stem Cells,2007,25(9):2235-2244.
[9]Wachs FP,Couillard-Despres S,Engelhardt M,et al.High efficacy of clonal growth and expansion of adult neural stem cells[J].Lab Invest,2003,83(7):949-962.
[10]Shafey D,Mackenzie AE,Kothary R.Neuro developmental abnormalities in neuro Sphere-derived neural stem cells from SMN-depleted mice[J].Neuro Sci Res,2008,86(13):2839-2847.
[11]Corti S,Nizzardo M,Nardini M,et al.Isolation and characterization of murine neural stem/progenitor cells.based on Prominin-1 expression[J].Exp Neurol,2007,205(2):547-562.
[12]Cacci E,Villa A,Parmar M,et al.Generation of human cortical neurons from a new immortal fetal neural stem cell line[J].Exp Cell Res,2007,313(3):588-601.
[13]Lagace DC,Whitman MC,Noonan MA,et al.Dynamic contribution of nestin-expressing stem cells to adult neurogenesis[J].Neurosci,2007,27(46):12623-12629.
[14]Oshima K,Teo DT,Senn P,et al.LIF promotes neurogenesis and maintains neural precursors in cell populations derived from spiral gangtion stem cells[J].BMC Dev Biol,2007,12(7):112-116.
[15]Wang TT,Jing AH,Luo XY,et al.Neural stem cells:isolation and differentiation into cholinergic neurons[J].Neuro Report,2006,17(13):1433-1436.

