樟子松愈伤诱导及植株再生的初步研究
张文泉,闫 伟
樟子松愈伤诱导及植株再生的初步研究
张文泉,闫 伟
(内蒙古农业大学 林学院,内蒙古 呼和浩特 010019)
以樟子松成熟胚为外植体,研究不同生长调节剂组合对樟子松愈伤组织诱导及分化的影响,并获得了完整的再生植株。结果表明:诱导愈伤组织的最佳培养基组合为MS+1.5 mg/L 2,4-D +0.5 mg/L 6-BA,愈伤组织分化的最佳培养基组合为MS+ 0.2 mg/L IAA +1.5 mg/L 6-BA,樟子松不定芽伸长生长的适宜基本培养基为1/2MS+0.1%活性炭,诱导生根的最佳培养基组合为1/4MS+0.5 mg/L NAA+0.2 mg/L IBA。
樟子松;组织培养;植株再生
樟子松Pinus sylvestris var. mongolica Litv.是松科松属高大常绿乔木树种,是欧洲赤松的一个地理变种,其材质良好,防风固沙作用显著,具有抗寒、抗旱、耐贫瘠、适应性强且较速生等特点,是我国北方主要造林和防风固沙树种。但樟子松结实间隔期长,籽粒空瘪率高,种子不能很快满足生产上的需要[1],组织培养作为一项生物技术为快速繁殖松属树种提供了一条有效的途径。当前国内对樟子松离体培养虽有研究,但至今未有对其愈伤诱导途径的报道,因此,对樟子松愈伤诱导及植株再生研究具有一定的理论和实践意义[2-8]。本研究以樟子松成熟胚为外植体, 诱导产生愈伤组织后, 愈伤组织分化获得到再生植株, 建立了植株再生体系。
1 材料与方法
供试材料种子采自内蒙古自治区呼伦贝尔市鄂温克族自治旗红花尔基樟子松国家森林公园。
1.1 供试外植体
供试材料为樟子松成熟胚。
1.2 实验方法
1.2.1 材料消毒
精选的种子用 30℃左右温水浸泡 24 h,0.5 %KMnO4溶液消毒 10~20 min,在超净工作台上剥去外壳,无菌水冲洗干净后,用75%酒精表面消毒 1 min,无菌水冲洗 2 次,之后再用 10%的NaClO 溶液消毒 20 min,无菌水冲洗 5~6 次,用无菌滤纸吸去表面水分。于无菌条件下用细镊子剥去胚乳,取出成熟种胚用于接种。
1.2.2 愈伤组织的诱导
将成熟种胚接种到以 1/2MS 为基本培养基,附加 20 g/L 的蔗糖、8 g /L 的琼脂、不同质量浓度的2,4-D(0.5,1.5,2.5 mg/L)与 6-BA(0.5 ,1.0 ,1.5 mg/L)组合,NAA(0.5 ,1.0 mg/L)与 6-BA(0.5 ,1.0 ,1.5 mg/L)组合,pH值调至 5.8 的培养基上诱导愈伤组织。黑暗处理 15 d 后,转移至光强为1 500 Lx 的光照条件下培养,培养时间为16 h/d,培养温度为 (25±1) ℃。每处理接种 32个外植体。20 d 后观察统计愈伤组织诱导率。

1.2.3 愈伤组织的分化
将获得的愈伤组织转移至 1/2MS 为基本培养基,附加 20 g/L 的蔗糖、8 g /L的琼脂、不同质量浓度的 6-BA(0.5,1.0,1.5,2.0 mg/L)与 IBA(0.2,0.5 mg/L)组合培养基上,pH 值调至 5.8,诱导不定芽,35 d 后统计愈伤组织分化情况及平均芽数。
不定芽诱导率=(产生不定芽的愈伤组织数/接种愈伤组织数总数)×100 %;
平均不定芽数=不定芽总数/被诱导的胚数。
1.2.4 芽的伸长
将获得的不定芽接入伸长培养基中,芽伸长采用 1/2MS 为基本培养基,附加20 g/L 的蔗糖,8/L 的琼脂,添加不同质量浓度的活性炭 (0,0.03,0.05 ,0.1,0.15 ,0.2 mg/L)的培养基,pH值调至 5.8,不加任何激素。选择合适的活性炭质量浓度。
1.2.5 不定根的诱导
将高 1 cm 左右的芽接种到生根培养基上进行根的诱导。生根培养基以1/2MS、1/4MS 为基本培养基, 附加 20 g/L 的蔗糖、8 g/L 的琼脂,添加不同质量浓度的萘乙酸(NAA)和吲哚乙酸(IBA),40 d 后统计生根情况。
不定根诱导率=(产生不定根的芽数/接种芽总数)×100 %。
2 结果与分析
2.1 愈伤组织的诱导和外植体选择
以樟子松成熟胚作为外植体,7 d后成熟胚均有愈伤组织产生,成熟胚膨大,叶面卷曲,开始出现肉眼可见的愈伤组织。樟子松成熟胚形成的愈伤组织从形态上可分为两种类型:一种是淡黄色、光滑致密、球状突起的愈伤组织,后转为绿白色(见图1);另一种是形成了不规则的黄白色,质地较为疏松的愈伤组织(见图2)。从愈伤组织诱导正交试验结果直观分析 (见表1) 表明, 愈伤诱导过程中细胞生长素2,4-D与NAA比较,2,4-D较优于NAA。从表1可以看出,不同实验中的诱导结果有很大差异,其中水平组合为第2组实验中诱导效果最好,诱导率为91.6 %。
本试验筛选樟子松愈伤组织诱导培养基为MS+ 1.5 mg/L 2,4-D +0.5 mg/L 6-BA。
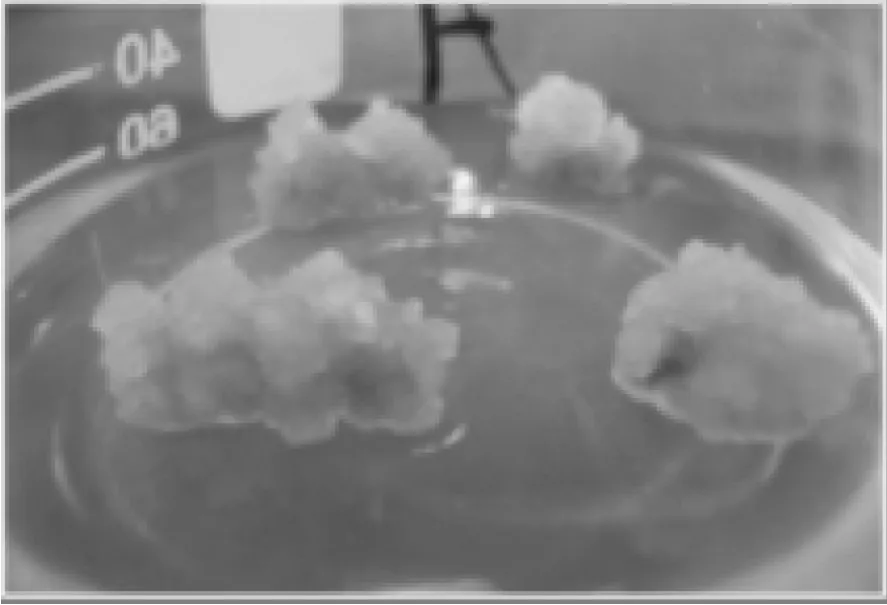
图1 成熟胚形成的愈伤1Fig.1 Foraminate callus in mature embryo 1

图2 成熟胚形成的愈伤2Fig.2 Foraminate callus in mature embryo 2
2.2 愈伤组织的分化
愈伤组织接入分化培养基上培养,光照培养15 d左右,已经出现了分化的迹象。继续培养20 d后,部分愈伤组织上形成绿色的芽点,芽点进一步发育35 d左右,形成不定芽或芽丛。每块愈伤组织上不定芽的数量多少不等,有的仅形成1个不定芽,最多的可达7个(见图3)。其中不同质量浓度的激素对愈伤组织的分化存在较大差异(见表2),当6-BA为1.5 mg/L、IAA为0.2 mg/L时,出芽率最高。因此,本试验中樟子松愈伤组织分化的培养基为MS+6-BA 1.5 mg/L +IAA 0.2 mg/L。
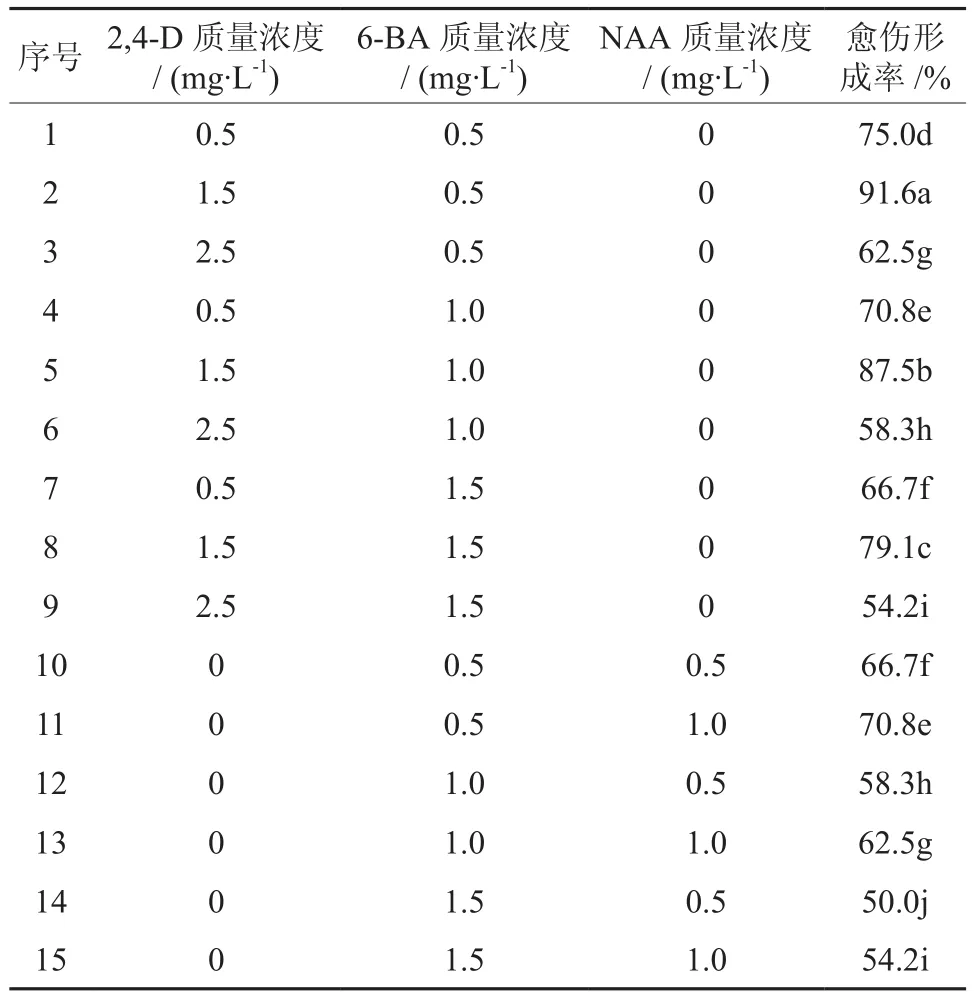
表1 外植体在不同激素质量浓度的 MS 培养基上愈伤形成率†Table 1 Effects of different hormone and different concentration of hormone in MS medium on inductivity of callus

图3 形成多个不定芽Fig.3 Adventitious bud in vitro shoot
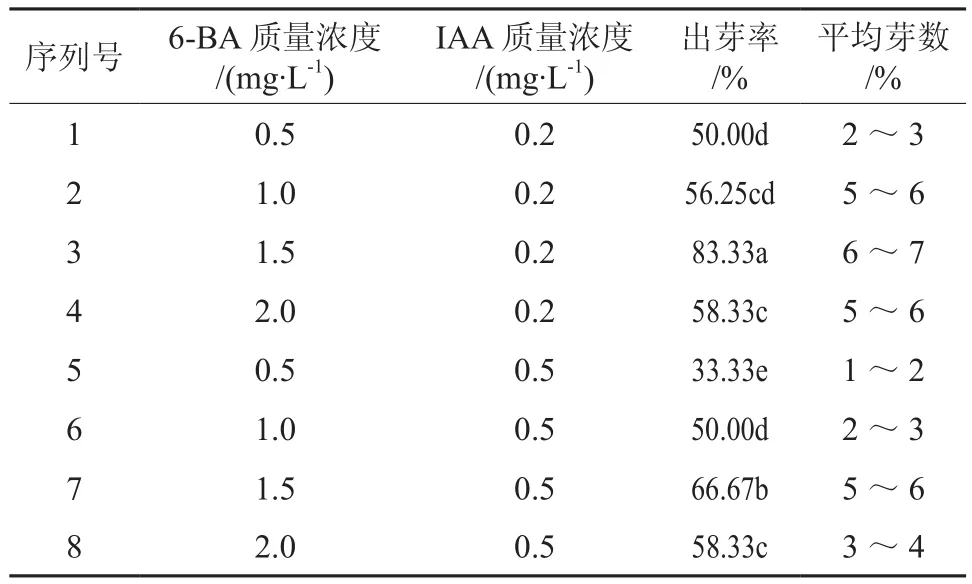
表2 不同质量浓度的激素组合对愈伤组织分化的影响Table 2 Effects of different hormone and different concentration on callus differentiation
2.3 芽的伸长
大量组织培养试验证明活性炭对芽的伸长生长具有一定的促进作用,本试验结果(见图4)表明,活性炭的加入对樟子松不定芽的生长与伸长具有一定的促进作用,不同浓度活性炭的加入对芽伸长存在显著性差异,当加入的活性炭浓度为0.1%时,最有利于丛生芽苗的伸长生长,当活性炭浓度高于这个值后芽的伸长生长开始受到抑制,这可能是由于活性炭在吸附有害物质的同时也吸附了矿质元素。因此,在樟子松丛生芽的伸长生长过程中,加入0.1%的活性炭较为适宜(见图5)。

图4 芽的伸长生长Fig.4 Elongation growth of bud
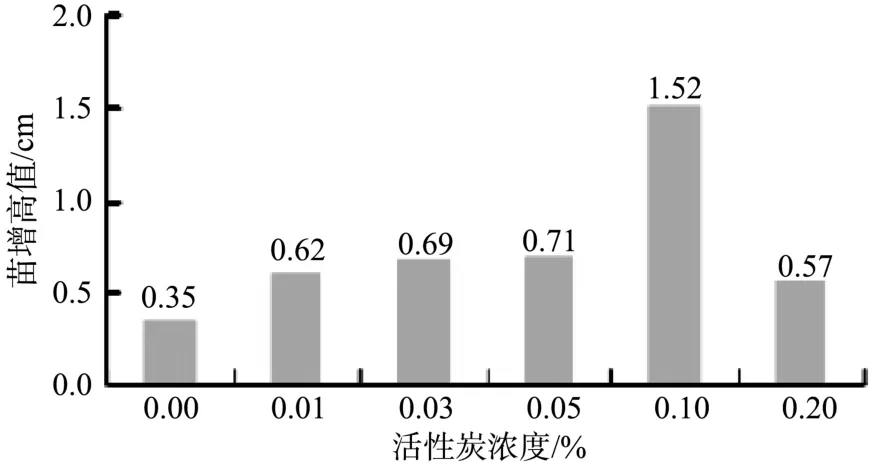
图5 活性炭对不定芽伸长生长的影响Fig.5 Influence of activated charcoal on growth of adventitious buds
2.4 不定根的诱导
将高1 cm左右的芽接种到生根培养基上进行根的诱导,1周后观察到部分无根幼苗茎基部有愈伤组织产生,随后形成不定根,2周后即可获得完整的再生植株(见图6,7),4周时,根长可达1.5 cm左右。不定根诱导试验结果(见表3)表明:培养基中大量元素质量浓度对樟子松芽的生根具一定的影响,降低培养基中的大量元素质量浓度有利于樟子松不定芽的生根,1/4MS培养基对樟子松不定芽生根最为有效,在以1/4MS为培养基且不加任何激素的情况下,培养一段时间偶尔有不定根产生。培养基中单独加入生长素可明显提高不定芽的生根率,NAA的效果比IBA好,在含有NAA的1/4MS生根培养基中同时加入低质量浓度的IBA对樟子松不定根的诱导有明显的促进作用,生根率达60 %。

图6 根系诱导Fig.6 Roots induced

图7 完整的再生植株Fig.7 Complete regeneration plant
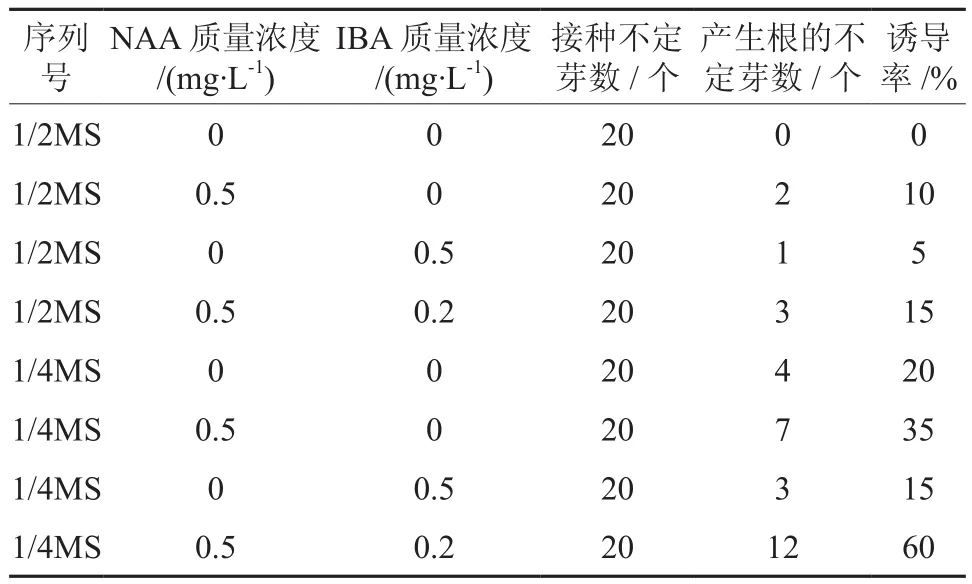
表3 不同培养基和 NAA、IBA 对不定根诱导的影响Table 3 Effects of different media with different NAA and IBA on adventitious root inductions
3 讨 论
植物形成愈伤组织后,再分化形成完整植株,在离体植物快繁中是普遍存在的现象[9-11]。关于樟子松通过此途径获得再生植株的研究,国内外尚未见报道, 本试验研究表明,利用樟子松成熟胚作为外植体,通过脱分化形成愈伤组织,再分化形成不定芽而产生再生植株。
其中培养基配方正确与否直接影响着外植体的脱分化与再分化[12],特别是各种诱导培养基和8 种不同的愈伤组织分化培养基。激素的调配也尤为重要,本实验设计了15种不同的诱导愈伤组织的激素组合,其中以 2,4-D 1.5 mg/L 和 6-BA 0.5 mg/L 培养基的愈伤组织形成率较高, 而且在愈伤诱导过程中,2,4-D 对樟子松的影响大于 NAA,6-BA 为 1.0 mg/L、IAA 为 0.2 mg/L 时,出芽率最高,且与其它培养基存在显著差异,明显表现出激素组合的优势。
为了使增殖后的芽苗进一步伸长生长,可利用去掉植物激素,降低矿质盐、维生素及蔗糖等方法[13],附加吸附物质如活性炭,对芽的生长也有促进作用[14]。
本研究表明,在以 1/2MS 为基本培养基,去掉植物激素的情况下,附加 0.1%的活性炭对樟子松不定芽的伸长生长起到良好的促进作用,这也许与活性炭在一定程度上吸附了不定芽在生长过程中代谢出的有害物质有关,与齐力旺等[15]对油松封顶芽的组织培养,郑均宝等[16]对油松离体胚子叶的组织分化和无根试管苗,阙国宁等[17]对火炬松、湿地松、晚松组培繁殖的研究结果一致。
针叶树组织培养中诱导生根往往比较困难,生根率低严重制约着针叶树的离体快速繁殖。促进针叶树生根的方法通常有:降低培养基无机盐的质量浓度、降低蔗糖的质量浓度、加入不同种类和配比的激素、培养基中加入活性炭、诱导前期用激素进行刺激、试管外生根等[18-24]。本试验结果表明,基本培养基、生长素种类和质量浓度等对樟子松不定芽生根有较大影响。培养基中大量元素含量减半(由1/2MS降到1/4MS)有利于樟子松不定根的诱导,1/4 MS培养基对诱导樟子松不定芽生根效果较好,在不含生长素的情况下偶尔有不定根产生,这与Thorpe总结针叶树中再生植株形成过程中芽生根的结论一致。
[1] 康 明,田建强,郑均宝.樟子松成熟胚的离体培养与不定芽的形成[J].河北林学院学报,1993,8(4):273-276.
[2] 彭丽萍,董丽芬.樟子松组织培养不定根诱导的研究[J].西北林学院学报,2008 ,23(1):100-103.
[3] Mathur G, Nadgauda R. In vitro plantlet regeneration from mature zygotic embryos of Pinus wallichiana[J]. Plant Cell Reports,1999,19:74-80.
[4] Gonzzalez M V, Rey M, Tavazza R. In vitro adventitious shoot formation on cotyledons of Pinus pinea[J]. Hort Science, 1998,33 :4,749-750.
[5] Druart P, Wulf O D. Activated charcoal catalses sucrose hydrolysis during autoclaving[J]. Plant Cell, Tissue and Organ Culture,1991,32(1): 97.
[6] Jang J C, Tainter F H. Microp ropagation of shortleaf, Virginia and loblolly×shortleaf pine hybrids viaorganogenesis[J]. Plant Cell, Tissue and Organ Culture,1991,25 (1): 61-67.
[7] Saborio F, Dvorak W, Donahue J, et al. In vitro regeneration of plantlets from mature embryos of Pinus ayacahuite[J]. Tree Physiology, 1997(17) : 787-796.
[8] Niemi K, Scagel C, Hêggman H. Application of ectomycorrhizal fungi in vegetative propagation of conifers[J].Plant Cell,Tissueand Organ Culture,2004,78:83-91.
[9] 郝玉华.我国植物组织培养的发展现状与前景展望[J] .江苏农业科学,2008,(4):20-23.
[10] 张建瑛,杨 玲.蔷薇科植物体细胞胚胎发生及影响因素研究进展[J] .生物技术通报,2007,3:35-38.
[11] 王雪婧,罗建勋.林木体细胞胚胎发生的研究进展[J] .四川林业科技,2007,28(2):24-28.
[12] 张法勇.木本植物组织器官发生植株再生研究进展[J] .河北林果研究,2005,20(3):34-38.
[13] Haddock P G. Sapling sugar pine grown from excised mature embryos[J]. Jour Forestry,1994,52:434-437.
[14] Debergh P c, Zimmerman R h. Micro prpagation technology and application[M]. Netherlands:Kluwer Academic Publishers, 1991.
[15] 齐力旺,杨云龙.油松封顶芽的组织培养[J].植物生理学通讯,1995,31(1):40-41.
[16] 郑均宝,潘冬梅,陈正华.油松离体胚子叶的组织分化和无根试管苗的形成[J] .河北林学院学报,1994,9(2):97-101.
[17] 阙国宁,房建军,葛万川,等.火炬松、湿地松、晚松组培繁殖的研究[J].林业科学研究,1997,10(3):227-232.
[18] Druart P, Wulf O D. Activated charcoal catalses sucrose hydrolysis during autoclaving[J]. Plant Cell, Tissue and Organ Culture,1991,32(1) :97.
[19] Saborio F, DvorakW, Donahue J, et al. In vitro regenerationof plant-lets from mature embryos of Pinus ayacahuite[J]. Tree Physiology, 1997(17):787-796.
[20] 张守英,杜小光,李 玲.兴安落叶松组织培养不定根诱导的研究[J].林业科技通讯,1993(5):8-10.
[21] 王 虹,张金凤.针叶树组织培养繁殖技术研究进展[J].河北林业科技,2004(4):14-18.
[22] 彭丽萍,董丽芬.樟子松组织培养不定根的诱导 [J].中南林业科技大学学报,2008,28(1):93-97.
[23] 石进朝,陈兰芬,王 晶,等.变叶金银木组织培养研究 [J].中南林业科技大学学报,2011,31(6):116-121.
[24] 李永欣,王晓明,陈明皋,等.外源激素对美洲冬青组织培养的影响 [J].中南林业科技大学学报,2010,30(1):65-68.
Preliminary study on calliferous induction and plant regeneration of Pinus sylvestris var. mongolica Litv
ZHANG Wen-quan, YAN Wei
(Forestry College, Inner Mongolia Agricultural University, Huhhot 010019, Inner Mongolia Autonomous Region, China)
The effects of various combination of growth regulating agents on the callus induction and differentiation of mature embryo of Pinus sylvestris var. mongolica Litv were studied, and complete regeneration plant was established. The results indicate that the optimum medium for callus induction from leaves was MS+ 1.5 mg/L 2,4-D+0. 5 mg/L 6-BA; the optimum medium for callus differentiation was MS+ 0.2 mg/L IAA + 1.5 mg/L 6-BA; the best medium for increasing the height of cluster buds was 1/2MS+0.1% activated carbon and the adventitious root was induced on 1/4 MS++0.5 mg/L NAA+0.2 mg/L IBA.
Pinus sylvestris var. mongolica Litv;tissue culture;plant regeneration
S791.253; Q943.1
A
1673-923X(2012)11-0037-05
2012-05-20
国家自然科学基金项目(31060111)
张文泉(1984-),男,湖南娄底人,博士研究生,主要从事林木菌根生物技术方面的研究
闫 伟(1959-),男,内蒙古呼和浩特人,教授,博士研究生导师,主要从事林木菌根生物技术方面的研究;E-mail:weiyan @imau.edu.cn
[本文编校:谢荣秀]

