聚合物微球支载手性磺酰二胺的合成研究
邓佳,卢翠芬,杨桂春,陈祖兴
(湖北大学化学化工学院,湖北 武汉 430062)
手性二胺是一类重要的手性配体,可与Ru等多种过渡多金属形成配合物[1-2],在催化不对称氢化还原[3]、羟醛缩合[4]和Michael加成等反应[5]中表现出良好的化学产率和光学产率.为了方便手性配体和催化剂的有效分离、纯化、回收和循环使用,提高其使用率,降低成本,Itsuno等成功地将手性磺酰二胺支载在交联聚苯乙烯上进行固相不对称催化[6],但固相反应是非均相反应,反应时间长,效率低下.Liu等将手性二胺支载在树状化合物上,均相催化不对称反应取得良好的效果[7].聚合物微球是一类分子内交联聚合物,具有高的比表面积,低的分散液粘度,稳定的分散性等特点,是一类良好的可溶性聚合物载体,具有固相有机合成和经典液相反应的优点,进行均相反应,反应快、可在线检测,分离纯化方便[8-9].
文中以苯甲醛为原料,经系列反应制备含有双键的手性磺酰二胺单体,再与苯乙烯和二乙烯基苯溶液聚合得到一类结构新颖的、未见文献报道的含有手性磺酰二胺单元的可溶性聚合物微球,可作为手性配体,催化不对称反应,便于分离纯化、回收循环使用.合成路线如Scheme 1所示.
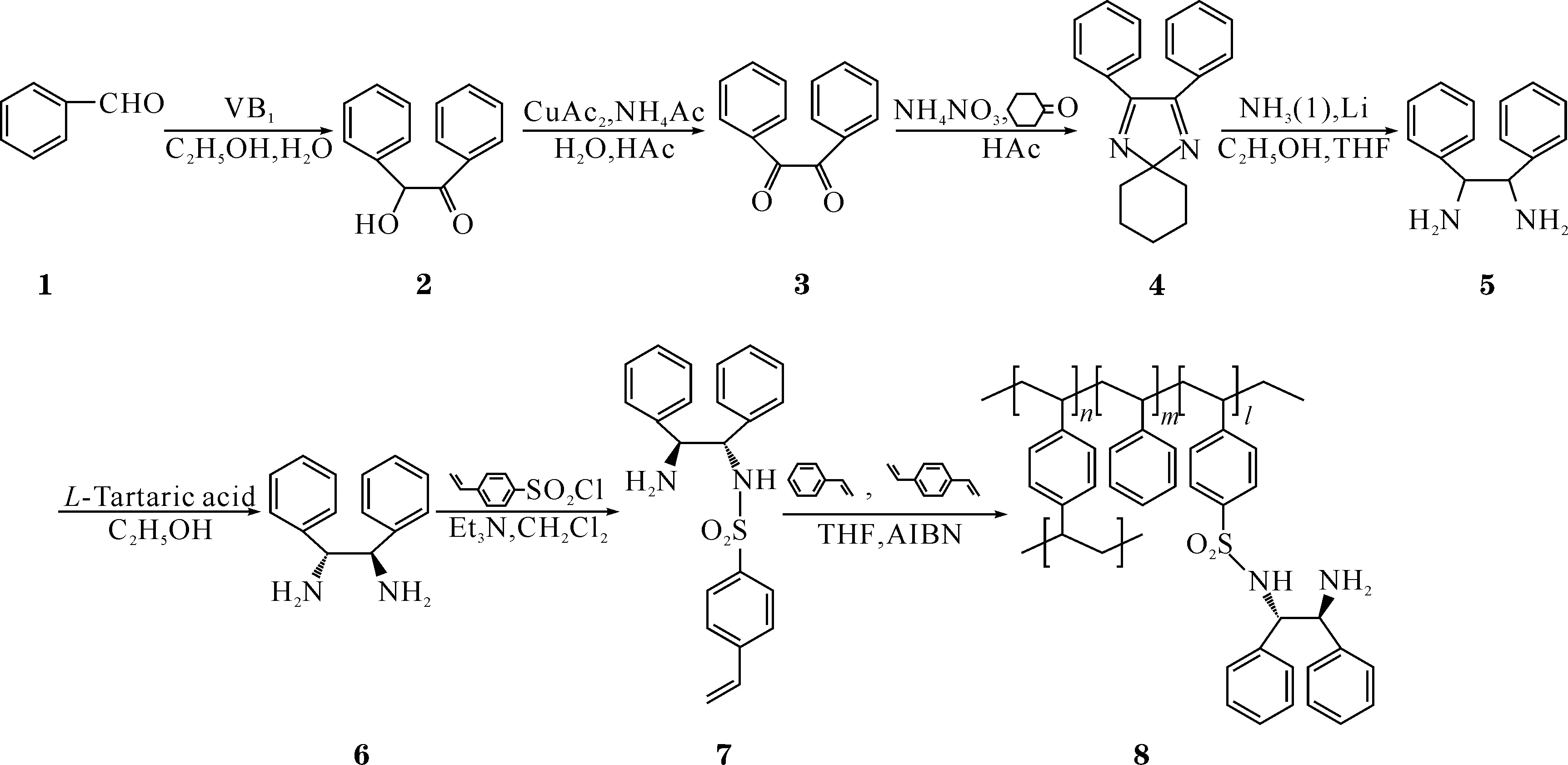
Scheme 1聚合物微球支载手性磺酰二胺的合成路线
1 实验部分
1.1 仪器及试剂处理
1.1.1 仪器 熔点仪:WRS-IA 数字熔点仪,上海精密科学仪器有限公司,温度未经校正;红外光谱仪:PE-Spectrum One 型,NaCl-单晶片涂片;核磁共振仪:INOVA (600 MHz),以CDCl3为溶剂,TMS为内标;元素分析仪:Vario EL Ⅲ (德国);高效液相色谱仪:UltiMate3000;扫描电镜:OPTON(法国)DSM-950型;TLC紫外灯检测仪:河南予华仪器有限公司,254 nm和365 nm紫外光照射.
1.1.2 试剂处理 苯甲醛:CP,减压蒸馏;四氢呋喃:AR,钠丝回流;偶氮二异丁腈(AIBN):AR,乙醇重结晶;N,N-二甲基甲酰胺 (DMF):AR,加入氢化钙,80 ℃加热5 h,减压蒸馏;苯乙烯(St)和二乙烯基苯 (DVB):AR,10%的氢氧化钠溶液洗涤,水洗至 pH=7,无水MgSO4干燥后减压蒸馏,加入分子筛贮藏于冰箱中;其他试剂均为AR,未经处理直接使用.
1.2 实验步骤

1.2.2 1,2-二苯基-1,2-乙二酮3的合成 化合物2(16.8 g,9.5 mmol),醋酸铜 (1.38 g,6.9 mmol),硝酸铵 (19.07 g,238.4 mmol)溶于80%醋酸 (150 mL),加热至回流反应1.5 h.待反应完全后将溶液倾入大量水中,析出黄绿色固体.过滤,适量水洗涤滤饼至滤液呈无色.真空干燥滤饼,得黄色固体3(16.4 g,产率98.1%).mp: 92~93 ℃[lit: 94~95 ℃][11];IR(NaCl):υ=1 659 cm-1;1H NMR:δ=7.51 (t,4H,Ar—H),7.64~7.67 (m,2H,Ar—H),7.97 (t,4H,Ar—H).
1.2.3 1,2-二苯基螺咪唑4的合成 化合物3(12.13 g,57.76 mmol),环己酮 (5.95 g,60.7 mmol),醋酸铵 (44.5 g,578 mmol)溶于冰醋酸 (100 mL),回流反应2 h.反应结束后将溶液倒入大量水中,析出淡黄色固体.过滤后滤饼用混合试剂(乙酸乙酯∶石油醚=1∶1,V∶V) 重结晶得到白色固体4(10.6 g,产率63.7%).mp:87 ℃[lit: 87~90 ℃[12];IR (NaCl):υ=1 609 cm-1;1H NMR:δ=1.73 (s,2H,—CH2—),1.82 (s,4H,—CH2—),1.96 (t,4H,J=6.0 Hz,—CH2—),7.34~7.51 (m,10H,Ar—H).
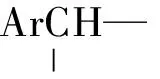
1.2.5 (S,S)-1,2-二苯基乙二胺6的合成 化合物5(5 g,23.6 mmol),L-酒石酸 (3.54 g,23.6 mmol) 加入热的乙醇/水 (V∶V=1∶1) 混合溶剂 (70 mL),在搅拌条件下缓慢冷却至室温,析出白色沉淀.过滤,滤饼用乙醇/水混合溶剂再次重结晶,如此反复4~5次,用1 mol/L氢氧化钠将酒石酸盐溶解后再用二氯甲烷萃取,除去溶剂得6(1.13 g,产率45%).其ee%值为98%.(HPLC检测的色谱条件:流动相为正己烷∶异丙醇=20∶1(V∶V);流速为0.4 mL/min;检测波长为254 nm,保留时间为13.4 min(R构型),16.9 min(S构型).柱前衍生为双磺酰胺,正相OD—H柱检测).
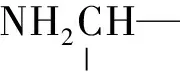
1.2.7 聚苯乙烯微球支载手性磺酰二胺8的合成 化合物7(0.38 g,1.0 mmol),二乙烯基苯 (0.055 g,0.42 mmol),苯乙烯 (0.73 g,7.0 mmol) 溶于绝对无水 (THF 21.6 mL),加入 AIBN (0.041 g,0.28 mmol),通氮气,回流反应4 d,期间补加AIBN (0.02 g,0.14 mmol).反应结束后除去溶剂后加入适量二氯甲烷溶解,将溶液逐滴滴加入冰甲醇中,析出白色固体.过滤,滤饼用甲醇洗涤(10 mL×3)后真空干燥,得聚合物8(0.97 g,产率83%).IR (NaCl):υ=3 271,1 330 cm-1;13C NMR(CDCl3):δ=38.0,49.5,124.7,126.6,127.0,127.3,144.4;元素分析:计算值C,84.98%;H,7.08%;N,2.42%;实测值C,81.63%;H,5.46%;N,2.41%.支载容量0.86 mmol/g.产品由扫描电镜检测,粒径在300 ~600 nm之间.
2 结果与讨论
2.1光学拆分拆分过程中要控制好加入溶剂的量,特别是重结晶过程中,加入溶剂量较多或较少都无法得到光学纯度较高的产物.当手性二胺与溶剂量为1∶10~1∶15 (m∶V) 时,产率较高,光学纯度最高.
2.2聚合反应在聚合过程中要充分考虑反应体系中各物质的浓度,总物质量浓度应控制在0.5 mol/L左右得到粒径较为均匀的聚合物,较大或较小都无法得到微球状聚合物.
3 结论
以苯甲醛为原料,经安息香缩合、氧化、成环、还原、手性拆分、磺酰化反应制备含有双键的手性磺酰二胺分子,再与苯乙烯和交联剂二乙烯基苯共聚合成了聚合物微球支载手性磺酰二胺,经IR,1H NMR,13C NMR及元素分析等结构表征,所得结果与化合物结构相吻合.该微球在DCM,THF,DMF,甲苯等良溶剂具有很好的溶解性,在甲醇,乙醚,正乙烷等贫溶剂中不溶,因而在良溶剂中可进行均相反应,反应完毕后,通过贫溶剂沉淀洗涤,聚合物微球支载手性磺酰二胺催化配体和催化剂可回收重复使用.
[1] Youssef L,Bennani K,Stephen Hanessian.Trans-1,2-diaminocyclohexane derivatives as chiral reagents,scaffolds,and ligands for catalysis[J].Chem Rev,1997,97: 3161-3195.
[2] Omid Soltani,Martin A Ariger,Erick M Carreira.Transfer hydrogenation in water: enantioselective,catalytic reduction of (E)-β,β-disubstituted nitroalkenes[J].Organic Letter,2009,11:4196-4198.
[3] Murata K,Ikariya T,Noyori R. New chiral rhodium and iridium complexes with chiral diamine ligands for asymmetric transfer hydrogenation of aromatic ketones[J].J Org Chem,1999,64: 2186-2187.
[4] Uragami M,Tomioka K,Koga K.Highly enantioselective aldol reaction mediated by mixed aggregates derived from a lithium ester enolate and tetradentate chiral lithium amides[J].Tetrahedron: Asymmetry,1995,6:701-704.
[5] Suzuki T,Torii T. Catalytic asymmetric michael reactions using a chiral rhodium complex[J].Tetrahedron: Asymmetry,2001,12: 1077-1081.
[6] Shinichi Itsuno,Miyuki Takahashi,Yukihiro Arakawa,et al. Synthesis of polymers containing chiral 1,2-diamine derivatives and their application to asymmetric reactions[J].Pure Appl Chem,2007,79: 1471-1479.
[7] Liu Weiguo,Cui Xin,Cun Linfeng,et al. Novel dendritic ligands of chiraI 1,2-diamine and their application in asymmetric hydrogenation simple aryl ketones[J].Synlett,2005,10:1591-1595.
[8] Li H,Pang Z B,Jiao Z F,et al. Synthesis and application of a microgel-supported acylating reagent by coupled ring-opening metathesis polymerization and activators re-generated by electron transfer for atom transfer radical polymerization[J].J Comb Chem,2010,12:255-259.
[9] Shimomura O,Clapham B,Spanka C,et al. Application of microgels as polymer supports for organic synthesis:[J].J Comb Chem,2002,(4): 436-441.
[10] Bernd Plietker. RuO4-catalyzed Ketohydroxylation of olefins[J].J Org Chem,2003,68: 7123-7125.
[11] Asha Chacko,Beena Mathew.Polystyrene-supported polyoxyethylene bound potassium permanganate as a heterogeneous oxidizing agent[J].J Appl Polymer Sci,2003,90: 3708-3717.
[12] Zhou Yan,Anna Andreou,Eldar Biktagirov,et al. Comparison of birch wit ctrochemical reduction of 2,3-diphenyl-1,4-diazaspiro[4.5]deca-1,3-diene[J].Electrochem Commun,2010,12: 1493-1497.
[13] Braddock D C,Redmond J M,Hermitage S A,et al. A convenient preparation of enantiomerically pure (+)-(1R,2R)-and (-)-(1S,2S)-1,2-diamino-1,2-diphenylethanes[J].Adv Synth Catal,2006,348: 911-916.
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

