遗传校正β-地中海贫血患者特异性iPSCs的功能探讨
周 林 郑陈光 杨 泽
β-地中海贫血是一种十分常见的遗传性血细胞紊乱性疾病,它以β珠蛋白合成减少为特征,影响转录、剪接或翻译的HBB基因的点突变或微小缺失是其常见的分子缺陷。重型β地中海贫血,又称Cooley’s贫血,患者多表现为重度贫血及肝脾肿大。如果不进行治疗,将会影响患者的生长发育,严重者可危及其生命。在中国,β-地中海贫血多发于广东、广西和海南一带,严重威胁着该地区数百万人的生命健康。然而,目前还没有有效的治疗措施。
现研究发现,通过超表达分化型体细胞的几个转录因子可以获得诱导性多功能干细胞(iPSCs),而这些细胞具有治愈多种遗传性及退行性疾病的潜能[1,2]。Hanna J等研究发现,患有人源化链状细胞性贫血的模型鼠,通过移植已进行靶基因遗传校正的iPSCs,可以产生造血干细胞进而得到治愈[3]。
目前,本课题组已由一个2岁的β-41/42纯合子的地中海贫血患者的皮肤组织切片中获得了纤维母细胞,成功地构建了患者特异性iPS细胞并对其基因变异完成遗传校正。本研究旨在前期研究结果的基础上,将遗传校正的iPSCs移植入SCID小鼠中,探讨其在SCID小鼠体内的表达情况。该结果将对未来β-地中海贫血的个体化治疗的研究提供重要的理论依据。
1.方法
1.1 SCID小鼠胫骨内移植 将8~10周的体重相同的雌性免疫缺陷SCID小鼠随机分成4组:α-MEM组、piPSHP组、ciPS-HP组与hES-HP组,对其进行6小时的Co-60照射。同时,收集5×105派生于piPSCs、ciPSC和hESCs的CD34+定向造血祖细胞,经MACS浓缩后,在IMDM培养基中悬浮,然后转入一个28 G的胰岛素注射器内。移植时,将注射器针头垂直插入小鼠胫骨并轻轻转动,使其管内的悬浮细胞注入胫骨内,完成对SCID小鼠的胫骨内注射移植。
1.2 移植后iPS细胞的功能检测 移植6周后,收集外周血、移植和非移植的骨髓细胞或脾细胞,进行一下检测:①使用特异性人类HLAABC抗体和人类CD71抗体进行流式细胞计数分析,检测SCID的移植细胞的红细胞生成能力;②采用western blot技术分析其β-珠蛋白和γ-珠蛋白的表达情况。
2.结果
2.1 红细胞生成能力检测 移植6周后,收集SCID小鼠外周血、移植与非移植的骨髓细胞和脾血细胞,使用特异性人类HLAABC抗体和人类CD71抗体分别进行流式细胞计数分析,检测遗传校正的iPS细胞在SCID移植鼠中的红细胞生成能力。结果发现:除注射有α-MEM的正常对照小鼠外,其他三组小鼠的外周血及骨髓细胞中均可以检测到相同比率的HLA-ABC+细胞,骨髓细胞及脾血细胞中可以检测到相同比率的早幼红细胞。这些研究结果显示移植入SCID小鼠体内的iPS细胞具有生成红细胞的功能。
2.2 β-珠蛋白与γ-珠蛋白的表达情况 分别收集4组移植鼠的外周血,采用western blot技术分析其β-珠蛋白与γ-珠蛋白的表达情况。结果显示:ciPSC-HP组小鼠β-珠蛋白的表达水平低于hESC-HP组的,其β-珠蛋白的表达水平仅是 hESC-HP组的一半,而α-MEM组和piPSCHP组小鼠的外周血中均未检测到人类β-珠蛋白的表达;除α-MEM组外,在其他三组中均可以检测到γ-珠蛋白的表达。hESC-HP、piPSC-HP与ciPSC-HP组的γ-珠蛋白的表达水平相似。这些研究结果表明:遗传校正的iPSCs在体内经定向造血干细胞分化后可以同hESCs一样,可以产生人类β-珠蛋白与γ-珠蛋白(见图1)。
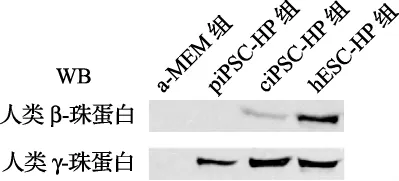
图1 β-珠蛋白和γ-珠蛋白在移植后的SCID小鼠外周血中的表达情况
3.讨论
在本研究中,我们将将β-地中海贫血患者特异性iPS细胞的基因变异进行遗传校正后,移植入免疫缺陷SCID小鼠中,检测移植入SCID小鼠的iPS细胞的功能,结果发现:移植入SCID小鼠体内的iPS细胞具有生成红细胞能力,可以提高SCID小鼠的红细胞生成量,还可以产生人类特异性β-珠蛋白与γ-珠蛋白。这一研究结果为iPSC应用于临床治疗重症β地中海贫血提供了新的理论依据。
校正患者特异性iPS细胞的遗传变异是实现个体化再生医学的至关重要的一步。我们的研究结果初步证明,遗传校正的iPS细胞在移植入免疫缺陷SCID小鼠中后,可以在SCID小鼠体内发挥其生成红细胞和合成β-珠蛋白与γ-珠蛋白的生物学功能,在一定程度上达到治疗β-地中海贫血的效果,具有潜在的临床应用价值。
然而,在实现iPSCs应用于临床治疗β-地中海贫血之前,还有大量的问题亟需我们解决,还有重重困难需要克服。首先,获得高质量的iPS细胞是将来进行进一步的基因操作的重要前提。最新的蛋白质、mRNA和micro RNA改造iPS细胞技术,为获得更为有效的患者特异性iPS细胞提供了较为理想的方法[4~6]。另外,还需要进一步优化校正后的iPS细胞定向分化为特异细胞类型的方法。最近的研究发现,不论是在体内还是体外,细胞可以由一种类型转换为另一种类型。然而,目前还不知道这些转换后的细胞是否具有分化功能,因为这些细胞的端粒长度可能不会得到适当的修复[7]。值得注意的是,在iPSCs中,端粒的长度可以得到修复[8,9]。总之,我们的研究为iPSC技术结合基因靶向作用,应用于临床治愈遗传性疾病如重症β地中海贫血的潜在性,提供了强有力的理论依据。
4.结论
我们的研究结果显示:将遗传校正的iPSCs移植入SCID小鼠体内后,将会提高定向造血干细胞生成正常红细胞的能力,并且还可以产生人类β-珠蛋白与γ-珠蛋白。该研究结果为“iPSCs可用于临床治疗β-地中海贫血”这一设想提供了理论依据,为治愈遗传变异性血液病带来了希望。
1 Park IH,Zhao R,West JA,et al.Reprogramming of human somatic cells to pluripotency with defined factors[J].Nature,2008,451:141-146.
2 Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318:1917-1920.
3 Hanna J,Wernig M,Markoulaki S,et al.Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin[J].Science,2007,318:1920-1923.
4 Warren L,Manos PD,Ahfeldt T,et al.Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA[J].Cell Stem Cell,2010,7:618 -630.
5 Miyoshi N,Ishii H,Nagano H,et al.Reprogramming of mouse and human cells to pluripotency using mature microRNAs[J].Cell Stem Cell,2011,8:633 -638.
6 Kim D,Kim CH,Moon JI,et al.Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J].Cell Stem Cell,2009,4:472 -476.
7 Szabo E,Rampalli S,Risueno RM,et al.Direct conversion of human fibroblasts to multilineage blood progenitors[J].Nature,2010,468:521-526.
8 Agarwal S,Loh YH,McLoughlin EM,et al.Telomere elongation in induced pluripotent stem cells from dyskeratosis congenita patients[J].Nature,2010,464:292-296.
9 Marion RM,Strati K,Li H,et al.Telomeres acquire embryonic stem cell characteristics in induced pluripotent stem cells[J].Cell Stem Cell,2009,4:141 -154.

