干旱胁迫下曼地亚红豆杉生理响应研究
马 均,何业华,马明东
(1.四川农业大学 风景园林学院, 四川 成都 611100;2.华南农业大学 园艺学院,广东 广州 511042)
干旱胁迫下曼地亚红豆杉生理响应研究
马 均1,何业华2,马明东1
(1.四川农业大学 风景园林学院, 四川 成都 611100;2.华南农业大学 园艺学院,广东 广州 511042)
以4年生曼地亚红豆杉扦插苗为试材,实验前1个月将苗木移栽至花盆中置于大棚内进行正常水分管理。将苗木分为3组,每组10株,3个重复,分别进行干旱胁迫。重度干旱(从试验开始时停止浇水),中度干旱(试验期间3 d浇1次水,浇水量为对照的50%), 对照(充足供水)。在重度干旱和中度干旱下分别胁迫35 d,研究曼地亚红豆杉对不同程度干旱胁迫的生理响应,以分析曼地亚红豆杉的抗旱性及抗旱机理。结果表明,水分胁迫下曼地亚红豆杉Pn、E、Gs与对照相比显著下降,Ci在胁迫初期升高,胁迫21 d后下降。水分利用效率(RWUE)先升高后下降,羧化效率(RCE)显著下降。叶绿素a、叶绿素b和总叶绿素含量在胁迫后与对照没有显著差异;Fv/Fm在胁迫期间没有显著变化,而IPI随胁迫强度增加和胁迫时间延长显著下降。推测曼地亚红豆杉在干旱胁迫下叶绿素含量和光系统II(PSII)光能转化能力保持相对稳定,对水分有较高的利用效率,引起光合下降的主要是非气孔因素,即羧化效率的显著下降。在水分胁迫条件下,曼地亚红豆杉SOD活性、POD活性,MDA含量、Pro含量都呈现先升后降的变化,说明曼地亚红豆杉在水分胁迫初期能通过增加保护酶活性来提高对逆境下产生的过氧化物的清除能力,同时增加细胞中游离脯氨酸等渗透调节物质来提高植株的吸水保水能力,维持自身水分平衡,具有较强的抗旱性。
曼地亚红豆杉;水分胁迫;生理响应; 叶绿素荧光
曼地亚红豆杉(Taxus mediacv.hicksii)为常绿灌木,萌发力强,耐修剪,耐寒,生长速度快,对环境适应性强[1-2]。紫杉醇含量高且稳定,是中国红豆杉品种含量的8~10倍[3],且可全株利用。该树种是筛选出的紫杉醇含量高的优良品种[4],可以广泛应用于我国的退耕还林、荒山荒坡改造等工程中,是提高林农收益的重要经济树种。但在曼地亚红豆杉引种栽培中由于水分条件限制,出现了生长速度降低的现象,这严重影响了红豆杉产业的发展。植物在水分胁迫条件下,会通过自身生理生化过程的调整来适应逆境。干旱胁迫会引起植物叶片气孔关闭,光合速率下降,叶绿素含量下降,超氧化物歧化酶(SOD)、过氧化氢酶 (CAT) 活性下降,游离脯氨酸(Pro)和MDA含量升高[5-7]。水分亏缺对植物生长发育的影响超过其它胁迫之和,具体表现在植物的株高、基径、根长与侧根数减少,叶重比降低而根重比增加[8-9]。通过对逆境下曼地亚红豆杉生理响应的研究,可以进一步了解干旱胁迫对曼地亚红豆杉的伤害机理和曼地亚红豆杉在水分胁迫条件下的抗性机制。但到目前为止,水分胁迫对曼地亚红豆杉生长发育影响的研究未见报道。本试验从光合生理、保护酶活性、渗透调节物质含量、过氧化产物积累等方面较为全面地研究了曼地亚红豆杉对干旱胁迫的生理响应,分析了曼地亚红豆杉的抗性强弱及其抵御干旱的主要生理途径,以期为曼地亚红豆杉的高产栽培提供理论依据。
1 材料与方法
1.1 试验设计
试验于四川农业大学都江堰分校实习苗圃进行,试验材料为4年生曼地亚红豆杉扦插苗,实验前1个月将苗木移栽至花盆中置于大棚内,基质为腐质土∶河沙∶壤土按3∶1∶1混合而成。移栽后进行正常水分管理。将苗木分为3组,每组10株,3个重复,分别进行干旱胁迫。重度干旱(从试验开始时停止浇水),中度干旱(试验期间3 d浇一次水,浇水量为对照的50%), 对照(充足供水)。当重度干旱含水量达到10%~15%,中度干旱含水量达到20%~25%时开始进行生理指标测定,每7 d测定1次,连续测定5次。
1.2 测定项目和方法
1.2.1 光合速率及光合效率测定
选择植株中上部当年生枝条中部完全展开功能叶,用英国ADC BioScientif i c 公司的Lci便携式光合测定仪直接测定光合速率(Pn),气孔导度(Gs),蒸腾速率(E),胞间CO2浓度(Ci)等指标。于测定日上午10 h进行,每处理随机测定3个植株,每植株测定3个叶片,每叶片测定10个值,
取平均值作为该处理测定值。并计算水分利用效率(RWUE)=Pn/E,羧化效率(RCE)=Pn/Ci。
1.2.2 叶绿素a荧光参数测定
用便携式荧光测定仪(Pocket PEA Chlorophyll Fluorimeter,英国Hansatech)测定各项荧光参数,测定叶片的部位与光合作用的测定部位相同,测定前先暗适应20 min,测定暗适应后的叶片的最小荧光产量(Fo)、最大荧光产量(Fm)、光系统II的最大量子产量(Fv/Fm),光合性能指数(IPI)。测定时调整叶片使其受光量尽量一致,以减少误差,每天在上午10 时左右测定,每项指标测定3盆,每盆测定3个叶片,取其平均植作为测定值。
1.2.3 叶绿素含量的测定
称取新鲜叶片0.5 g,剪碎,加入10 mL丙酮-乙醇等体积混合液,置于暗处,待叶片组织变白后,取上清液于663 nm和645 nm处测定吸光度,按Arnon法[10]计算叶绿素含量。
1.2.4 其它生理生化指标的测定
各处理于每株苗木中上部选取当年生功能叶片,混合后采用随机抽样法进行取样。SOD活性参照植物生理学实验教程[11],POD活性测定采用愈创木酚法,丙二醛含量测定参照现代植物生理学实验指南,游离脯氨酸含量测定采用酸性茚三酮比色法[12]。生理生化指标的测定均进行3次重复。
1.3 数据分析
采用Excel软件处理数据、制图,采用SAS软件进行LSD显著性差异检验。
2 结果与分析
2.1 干旱胁迫对曼地亚红豆杉叶片光合特征的影响
由图1~4可以看出,随干旱胁迫强度增加和胁迫时间的延长,曼地亚红豆杉的净光合速率、蒸腾强度、气孔导度都显著(p<0.05)下降,与对照间有显著差异,且各自的变化趋势与净光合速率变化趋势基本一致。当水分亏缺时,气孔导度减小,尤其在重度干旱的情况下,气孔导度显著(p<0.05)下降。气孔阻力的增加也减少叶片水分散失,因此导致蒸腾速率显著(p<0.05)下降。蒸腾拉力是植物体内物质运输的动力来源,蒸腾受阻,光合作用随之下降。同时,水分作为光合作用的原料之一,当其供应不足时,也直接导致光合速率的降低。如图5所示,在蒸腾速率显著下降的情况下,曼地亚红豆杉的水分利用效率在胁迫前期重度干旱处理和对照没有显著差异,而中度干旱水分利用效率显著高于对照。在胁迫3个星期后,两种试验处理的水分利用效率都下降,显著低于对照。这说明曼地亚红豆杉在干旱胁迫较短时间内,能通过提高水分利用效率来保证在气孔开度减小的情况下保持一定的光合能力。而随着胁迫时间的延长,这种调节能力相对减弱,水分利用效率下降。在胁迫条件下,曼地亚红豆杉Ci提高,这说明在干旱胁迫下,气孔开度减小,但对CO2的消耗也显著下降,因此并未导致叶肉中CO2供应的不足。造成其光合作用下降的主要原因不是CO2的缺乏,而是非气孔因素,是叶肉细胞光合活性的下降造成的[13]。胁迫21 d后,由于气孔的持续关闭,Ci值下降,显著低于对照,气孔限制成为Pn下降的主导因子。羧化效率(RCE)是反映植物叶片中活化的Rubisco量的多少与植物对CO2利用能力的重要指标[14]。由图6可以看出,随着胁迫强度的增加和胁迫时间的延长,曼地亚红豆杉的羧化效率显著(P<0.05)下降。羧化能力的下调可能是导致净光合速率下降的主要因素。
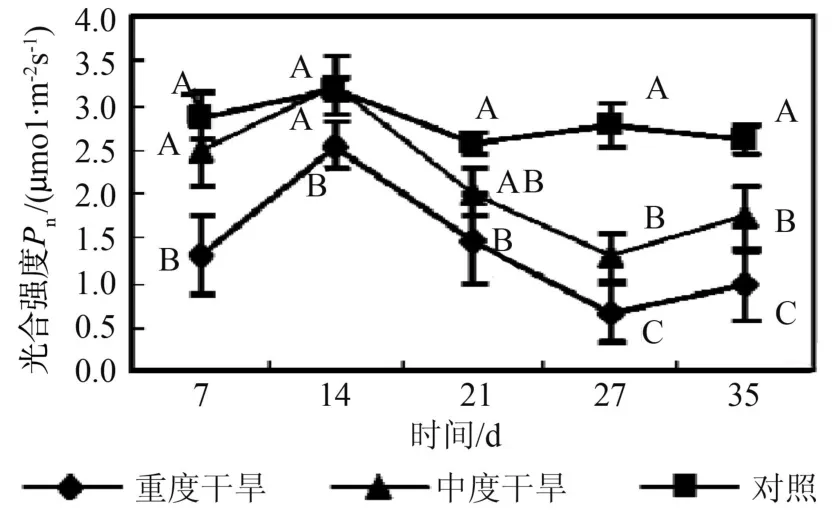
图1 干旱处理对曼地亚红豆杉光合强度的影响Fig.1 Effects of water stress on Pn

图3 干旱处理对曼地亚红豆杉胞间CO2浓度的影响Fig.3 Effects of water stress on Ci
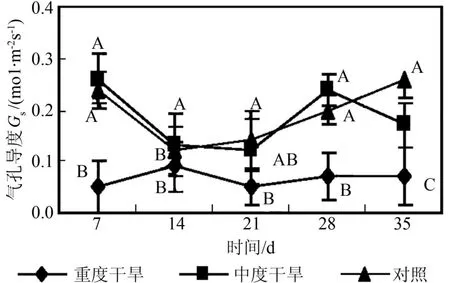
图5 干旱处理对曼地亚红豆杉水分利用效率的影响Fig.5 Effects of water stress on utilization ratio of water
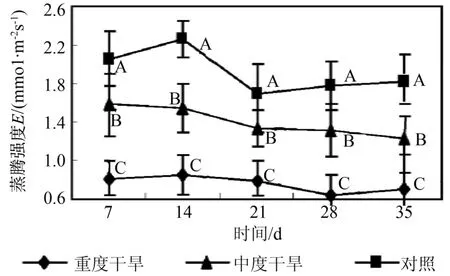
图2 干旱处理对曼地亚红豆杉蒸腾强度的影响Fig.2 Effects of water stress on E
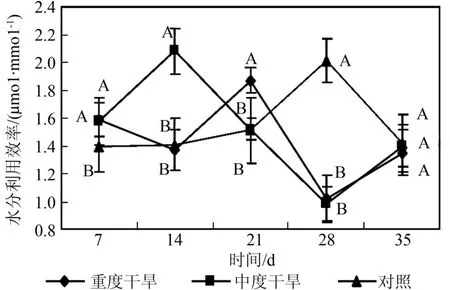
图4 干旱处理对曼地亚红豆杉气孔导度的影响Fig.4 Effects of water stress on Gs
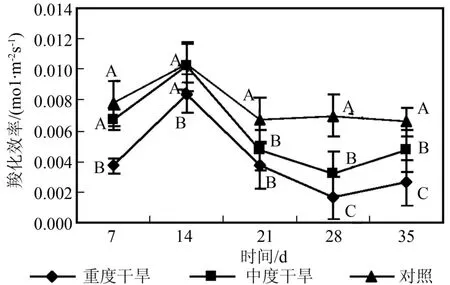
图6 干旱处理对曼地亚红豆杉竣化效率的影响Fig.6 Effects of water stress on carboxyl lotion ration
2.2 干旱胁迫对曼地亚红豆杉叶片光合色素含量的影响
叶绿素是植物进行光合作用的主要色素,叶片的叶绿素含量与组成同植物光合作用密切相关。不同程度干旱胁迫对曼地亚红豆杉叶绿素含量的影响如表1所示。在干旱胁迫7 d时,重度干旱和中度干旱处理叶片叶绿素a,叶素b以及总叶绿素含量都显著(P<0.05)低于对照。在胁迫第2星期到第3星期时,干旱处理叶片叶绿素含量升高,均显著(P<0.05)高于对照,这可能是由于在干旱胁迫前期,细胞含水量下降,单位鲜重材料中叶绿素含量升高。胁迫4星期后,对照与处理间叶绿素含量没有显著差异。这可能是由于随着干旱的持续,叶肉细胞通过生理代谢调节,使叶绿素含量维持在一定的正常水平,以维持光合作用的正常进行。说明干旱胁迫条件下曼地亚红豆杉净光合速率的下降并不是由光合色素含量下降引起。

表1 不同干旱胁迫强度对曼地亚红豆杉叶片叶绿素含量的影响†Table 1 Effects of water stress on chlorophyll content
2.3 干旱胁迫对叶绿素荧光参数的影响
光被光合器官吸收后,驱动光合作用,部分光能以热的形式逸散或以荧光的形式辐射出去,因此绿色植物发射的叶绿素荧光可以作为反映植物光合活性的指标[15-16]。Fv/Fm是暗适应下PSII反应中心完全开放时的最大光化学效率。反映PSII反应中心最大光能转换效率[17]。由图7可以看出,在干旱胁迫下,随胁迫强度的不同和胁迫时间的延长,处理和对照间Fv/Fm值没有显著差异,都基本稳定在0.8~0.85之间。这说明,在试验处理的胁迫条件下,曼地亚红豆杉的光合反应中心,尤其PSII没有明显破坏,保持着较强的光能转换能力。其净光合速率的降低并不是因为光合系统II受到破坏。
以光合吸收为基础的光合性能指数PI是JIP-test快速荧光动力曲线参数中对环境变化最敏感的参数,可以准确反应植物光合机构的状态,常用来估计整个光化学反应对环境的响应[18-19]。由图8可以看出,随着干旱胁迫强度增加,曼地亚红豆杉IPI值显著(P<0.05)下降,中度干旱和重度干旱间差异显著,且都显著低于对照。这说明整个光化学反应对干旱胁迫很敏感,在干旱胁迫下,光合性能显著降低。这与净光合速率的变化规律相一致。
2.4 干旱胁迫对曼地亚红豆杉保护酶活性的影响
植物细胞中的氧浓度较高,特别是在叶细胞中更高,极易在逆境下形成氧化胁迫,导致细胞的氧化伤害[20]。植物为保护自身免受伤害也形成了一套相应的抗氧化保护系统,其中超氧化物歧化酶(SOD),过氧化物酶(POD)在植物的抗氧化胁迫中起着极为重要的作用。其作用是将超氧化物阴离子自由基歧化为O2和H2O2[20-21]。研究表明,植物抗性和SOD密切相关[22]。由图9可以看出,在干旱胁迫处理下,SOD活性都表现出先升后降的趋势,中度干旱和重度干旱在胁迫约4星期后达到最大值,显著高于对照。POD活性比对照显著提高,但重度干旱和中度干旱间没有显著差异(图10)。水分胁迫前3星期,POD活性增强较慢,第4星期
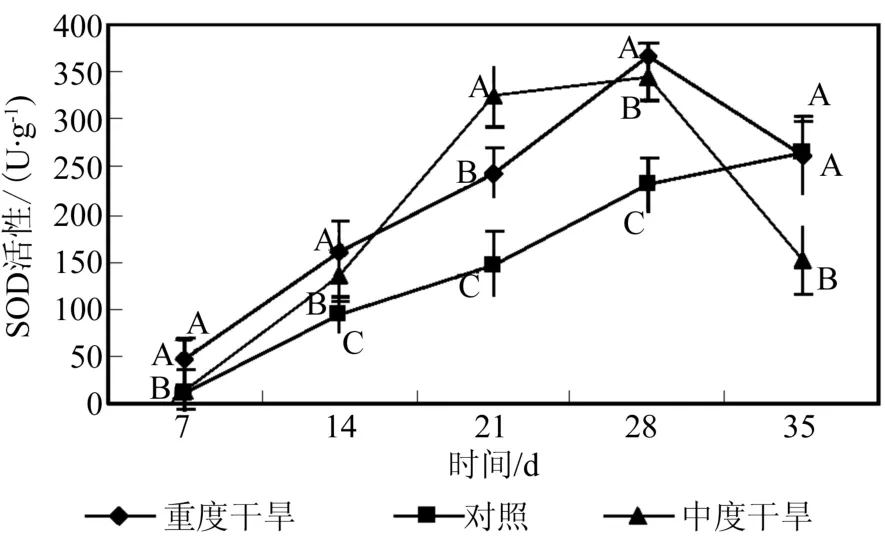
图9 干旱处理对曼地亚红豆杉SOD活性的影响Fig.9 Effects of water stress on SOD activity
2.5 干旱胁迫对曼地亚红豆杉MDA含量的影响
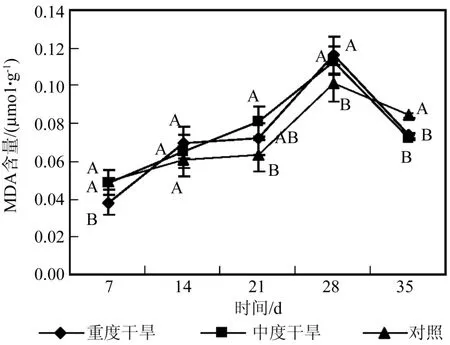
图11 干旱处理对曼地亚红豆杉MDA含量的影响Fig.11 Effects of water stress on MDA contents
丙二醛是膜脂过氧化的主要产物之一,常作为判断膜脂过氧化作用的主要指标[25],在甘蔗中MDA含量的变化最能表明抗旱性的差异,即使是短暂的干旱[26]。由图11可知,曼地亚红豆杉在干旱胁迫条件下,MDA含量快速升高。表明在胁迫条件下,过氧化物的大量积累,会对生物膜产生严重破坏。一般认为抗旱性强的品种丙二醛含量低于抗旱性弱的品种[27]。曼地亚红豆杉在干旱胁迫条件下,MDA含量与对照差异不显著,这说明曼地亚红豆杉的抗旱性较强。时增强明显,然后迅速下降,下降后POD活性与对照没有显著差异。这说明曼地亚红豆杉的抗旱性较强[23-24],在胁迫初期能通过加强SOD的合成或活性提高来抵御氧化伤害。而POD活性的增加对水分胁迫的响应相对滞后。但酶系统的防御能力是有局限性的,在胁迫4星期后SOD和POD酶活性有所下降,与对照间没有显著差异。这可能是由于干旱胁迫己经破坏了曼地亚红豆杉叶片正常的生理功能,保护酶活性受到了抑制,这种变化趋势与苗木的生长情况基本一致。

图10 干旱处理对曼地亚红豆杉POD活性的影响Fig.10 Effects of water stress on POD activity
2.6 干旱胁迫对曼地亚红豆杉游离Pro含量的影响
脯氨酸是一种重要的有机渗透调节物质,在干旱胁迫条件下,细胞内会积累游离脯氨酸,进行渗透调节,以维持细胞膨压及正常生理功能[28]。但也有研究认为逆境条件与游离脯氨酸含量变化无关[29]。由图12可以看出,干旱胁迫下,曼地亚红豆杉Pro含量先升后降,在胁迫处理第3星期时达到高峰。细胞以增加溶质降低渗透势的方式来降低水势,维持细胞的水分平衡。但某种溶质含量的大量增加也会对细胞生理代谢平衡产生影响,所以胁迫后期Pro含量下降。这与孔德鑫等[9]的结果不一致,可能是由于不同的植物对干旱有不同的响应机制。

图12 干旱处理对曼地亚红豆杉Pro含量的影响Fig.12 Effects of water stress on Pro contents
3 讨 论
不同作物在干旱胁迫下光合速率下降的机理可能不同,可以是通过气孔因素限制光合作用的进行,也可以是非气孔因素造成的。本实验设定的两种干旱胁迫均导致了曼地亚红豆杉叶片Pn的降低。重度干旱胁迫下Gs下降,显著低于对照,此时的Pn也显著低于对照,但此时的Ci值略有上升,到胁迫3星期时,胁迫处理高于对照。因此,该阶段干旱胁迫下曼地亚红豆杉Pn的降低不是由气孔性因素造成的,因只有当Ci与Pn一起下降且Gs增加时,Pn的下降才主要由气孔因素造成[14]。胁迫3星期后,由于气孔的持续关闭,Ci值下降,显著低于对照,气孔限制成为Pn下降的主导因子。曼地亚红豆杉在水分胁迫前期,能在气孔开度减小,水分吸收减少的情况下,充分利用体内水分,水分利用效率显著高于对照,但这种适应能力也是相对的,胁迫3星期后水分利用效率低于对照。羧化效率在整个胁迫期间都显著下降,这可能是由CO2溶解度降低、Rubisco酶对CO2的亲和力降低、RuBP再生能力下降引起的,这也可能是干旱胁迫下引起曼地亚红豆杉净光合速率下降的主要因素。
叶绿素作为光合作用中最重要的色素分子,参与光合作用中光能的吸收、传递和转化。在胁迫初期,叶绿素a、叶绿素b和总叶绿素含量都显著下降,这是植物在感知胁迫后通常的表现[18]。胁迫4星期后处理与对照间叶绿素含量没有显著差异,说明曼地亚红豆杉能通过生理代谢的调节将叶绿素含量维持在一定的正常水平,具有较高的抗逆性。
叶绿素荧光是探测和分析植物光合功能的重要手段,为研究光系统及其电子传递过程提供了丰富的信息,是研究植物光合生理状况以及植物与逆境胁迫关系的理想探针[30-32]。本实验结果表明,在不同程度的干旱胁迫下,PSII的最大光能转换效率(Fv/Fm)与对照基本无显著差异。说明本实验胁迫处理对曼地亚红豆杉PSII反应中心没有产生明显伤害,仍保持较高的光反应能力。但以光合吸收为基础的光合性能指数PI在干旱胁迫下显著下降,这说明整个光化学反应对干旱胁迫很敏感,整体光合性能降低。
由光合生理的分析可以推测曼地亚红豆杉在干旱胁迫下叶绿素含量和光系统II(PSII)光能转化能力保持相对稳定,对水分有较高的利用效率,引起光合下降的主要是非气孔因素,即羧化效率的显著下降。
曼地亚红豆杉在不同程度水分胁迫条件下,SOD、POD活性都表现出先升后降的变化,说明曼地亚红豆杉在水分胁迫的初期能够通过提高保护酶的活性来清除逆境下产生的超氧化合物,减少逆境对植株的伤害来适应逆境。同时,曼地亚红豆杉在水分胁迫下还能通过增加渗透调节因子游离脯氨酸的含量来提高植株的吸水和保水能力,维持自身的水分平衡,以抵御干旱的影响。但这种适应是有一定限度的,当水分胁迫1个月后,各项生理指标都显著下降。胁迫期间,重度干旱与中度干旱,及其与对照间,丙二醛含量差异不显著,说明在干旱胁迫过程中,丙二醛没有显著的积累,这与其保护酶的活性显著提高一致。实验结果还表明,曼地亚红豆杉能忍受较强的水分胁迫,胁迫强度对其生理生化的影响没有极显著差异,而胁迫时间的持续对其影响更显著。所以,曼地亚红豆杉对水分胁迫具有较强的抗性,干旱持续时间较干旱强度的大小对其生理生化的影响更为明显。
[1] 张照喜,喻 泓,杜化堂.曼地亚红豆杉径枝生长关系研究[J].武夷科学,2005,25(1):47-52.
[2] 蒲春林,万 军,刘世彬, 等.曼地亚红豆杉繁殖栽培技术[J].林业科技开发,2005,19(3):60-62.
[3] 王占和.曼地亚红豆杉及其市场前景[J].特种经济动植物,2005,(3):32.
[4] 毛锁云,王海珍.曼地亚红豆杉的栽培利用前景[J].江苏林业科技,2002,29(1)∶50-51.
[5] 常红军,秦毓茜.干旱和盐胁迫对草地早熟禾草坪质量及其叶绿素荧光参数的影响)[J].西北植物学报,2008,28(9):1850-1855.
[6] 李 玲,徐志防,韦 霄,等.金钟藤和葛藤在干旱与复水条件下的生理比较[J].广西植物,2008,28 (6):806-810.
[7] 陈少瑜,郎南军,李吉跃,等.干旱胁迫下坡柳等幼苗质膜相对透性和脯氨酸含量的变化[J].广西植物,2006,26(1):80-84.
[8] Wallin G, Karlsson P E, Sell den G. Impact of four years exposure to different levels of ozone, phosphorus and drought on chlorophyll, mineral nutrients, and stem volume of Norway spruce, Pica abides[J].Physiol Plant, 2002, 114:192-206.
[9] 孔德鑫,梁惠凌,韦记青,等.土壤干旱胁迫对毛鸡骨草幼苗生长及某些生理特性的影响[J].广西植物,2010,30(4):521-525.
[10] Arnon D I. Copper enzymes in isolated chloroplasts: poly phenol oxidase in betavulgaris [J]. Plant Physiol, 1949, 24: 1.
[11] 熊庆娥.植物生理学实验教程[M].四川:四川科技技术出版社,2003.
[12] 中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999:305-306.
[13] 沈允钢,施教耐,许大全.动态光合作用[M].北京:科学出版社,1998,129.
[14] 许大全.光合作用效率[M].上海:上海科技出版社,2002.
[15] 张雪洁,谭晓风,袁 军,等.低磷胁迫对油茶叶绿素荧光参数的影响[J].经济林研究,2012,30(2):48-51.
[16] 吕芳德,徐德聪,侯红波,等.5种红山茶叶绿素荧光特性的比较研究[J].经济林研究,2003,21(4):4-7.
[17] 韩光明,赵明辉,陈温福.水稻超绿突变体光合特性的初步研究[J].北方水稻,2008,38(3):26-28.
[18] 韩瑞宏,卢欣石,高桂娟,等.紫花苜蓿对干旱胁迫的光合生理响应[J].生态学报,2007,27(12):5229-5237.
[19] 冯建灿,胡秀丽,毛训甲.叶绿素荧光动力学在研究植物逆境生理中的应用[J].经济林研究,2002,20(4):14-18.
[20] 蒋明义,郭绍川.水分亏缺的氧化胁迫和植物的抗氧化作用[J].植物生理学通讯,1996,32(2):144-150.
[21] Sen Gupta A, Webb R P, Holaday A S, et al. Overexpression of wuperoxide dismutase protects plants from oxidative stress.Induction of ascorbate peroxidase in superoxide dismutaseoverexpressing plants[J]. Plant Physiol,1993, 103:94.
[22] Alberte R S, Thornber J P, Fiscus E L. Water stress effects in the content and organization of chlorophyll in mesophyll and bundle sheach chlorplasts of maise[J]. Plant Physiology,1977, 59: 351-353.
[23] 时连辉,牟志美,姚 健.不同桑树品种在土壤水分胁迫下膜伤害和保护酶活性变化 [J].蚕业科学,2005,31(1):13-17.
[24] 胡景江,顾振瑜,文建雷,等.水分胁迫对元宝枫膜脂过氧化作用的影响 [J].西北林学院学报,1999,14(2):7-11.
[25] 陈立松,刘星辉.作物抗旱鉴定指标的种类及其综合评价[J].福建农业大学学报,1997,26(1):48-55.
[26] 梁 强,叶燕萍,桂 杰,等.喷施黄腐酸对干旱胁迫下甘蔗苗期叶绿素荧光参数及丙二醛的影响[J].广西植物,2009,29(4): 527-532.
[27] 陈立松,刘星辉.果树对水分胁迫的反应与适应性 [J].干旱地区农业研究,1999,17(1):88-94.
[28] 李 敏,程存刚,康国栋,等.干旱处理对不同苹果品种生化指标的影响[J].北方果树,2006,(4):11-13.
[29] 张显强,罗在柒,唐金刚.高温和干旱胁迫对鳞叶藓游离脯氨酸和可溶性糖含量的影响[J].广西植物,2004,24(6):570-530.
[30] 李娟娟,许晓妍,朱文旭,等.淹水胁迫对丁香叶绿素含量及荧光特性的影响[J].经济林研究,2012,30(2):43-47.
[31] 许耀照,曾秀存,郁继华,等.水杨酸对高温胁迫下黄瓜幼苗叶绿素荧光参数的影响[J].西北植物学报,2007,27(2):267-271.
[32] 徐德聪,吕芳德,潘晓杰.叶绿素荧光分析技术在果树研究中的应用[J].经济林研究,2003,21(3):88-91.
Physiological response of Taxus media cv. Hicksii to water stress
MA Jun1, HE Ye-hua2, MA Ming-dong1
(1.College of Landscape Architecture of Sichuan Agricultural University, Chengdu 611100, Sichuan, China; 2. College of Horticulure,Agriculural University of South China, Guangzhou 511042, Guangdong, China)
Cuttages ofTaxus mediacv.hicksiiwere treated with serious draught and moderate draught for 35 days to study the changes in their photosynthesis and fl uorescence parameters under water stress. The results show that the net photosynthesis (Pn), transpireation coeff i cient (E), stomatal conductance (Gs) decreased evidently compared with the contrast. The intercellular CO2concentration (Ci) at the early stage increased and the decreased 3 weeks after stressed. The water utilization eff i ciency (RWUE) increased at the early stage and then decreased, the carboxylation eff i ciency (RCE) decreased evidently. Chlorophyll a, Chlorophyll b and total chlorophyll content didn’t change evidently compared with the contrast. And the intrinsic photochemical eff i ciency (Fv/Fm) didn’t change evidently during water stress, but the photosynthesis performance index (IPI) decreased evidently with the water stress increased and the stress time expanded.All the results suggested that the chlorophyll content, the light convert capability of PSII kept relative stabilization, and could use water with relatively high eff i ciency. The main factors that led to the decrease of photosynthesis were the non-stomatal limitations, namely the evident decrease of the carboxylation eff i ciency. The results also show that all the physiologyical and biochemical indexes increased at the prophase of water dress, and then decreased. It suggested thatTaxus mediacv.hicksiihad a comparatively high draught resistance.It could increase the eliminate ability of peroxides by increasing the activity of SOD and POD. It also could increase the ability of water sucking and keeping by increasing the contents of Pro.
Taxus mediacv.hicksii;water stress; physiology response;chlorophyll fl uorescence
S791.49;S723.1
A
1673-923X(2012)12-0147-07
2012-06-13
四川省教育厅重点研究项目“曼地亚红豆杉水分、光照、温度胁迫生理响应研究”(2006B014)
马 均(1975-),女,四川内江人,博士,副教授;研究方向:植物生理及生物技术;Tel:028-82652812;E-mail:junma365@hotmail.com
[本文编校:邱德勇]

