阿魏酸对脂多糖诱导的小鼠小胶质细胞炎性反应的抑制作用
黄 丰, 邓华明, 朱苗苗, 肖 飞, 杨 丽, 张在军, 肖 瑛, 聂 红
(1. 暨南大学 药学院中药药理教研室, 广东 广州 510632; 2. 暨南大学 医学院药理教研室, 广东 广州 510632;3. 暨南大学 药学院中药学教研室, 广东 广州 510632; 4. 暨南大学 药学院新药研究所, 广东 广州 510632)
阿魏酸对脂多糖诱导的小鼠小胶质细胞炎性反应的抑制作用
黄 丰1,*, 邓华明1, 朱苗苗1, 肖 飞2, 杨 丽3, 张在军4, 肖 瑛4, 聂 红1
(1. 暨南大学 药学院中药药理教研室, 广东 广州 510632; 2. 暨南大学 医学院药理教研室, 广东 广州 510632;3. 暨南大学 药学院中药学教研室, 广东 广州 510632; 4. 暨南大学 药学院新药研究所, 广东 广州 510632)
阿魏酸是川芎、当归等中药的有效成分之一, 具有较强的抗氧化活性和抗炎作用。小胶质细胞是脑内常驻的免疫效应细胞, 极易被激活而导致脑内发生慢性神经性炎症反应, 与阿尔茨海默病等神经退行性疾病的发生发展密切相关。该研究采用脂多糖(LPS)刺激小胶质细胞(BV-2)活化, 研究阿魏酸对炎症反应的抑制作用。结果表明, 2.5~22.5 μg/mL的阿魏酸浓度依赖性的抑制一氧化氮(NO)、前列腺素E2(PGE2)、白介素-1β(IL-1β)等炎症因子的产生, 以及一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)蛋白的表达, 其作用机制可能与其抑制Toll样受体4(TLR4)表达有关。
阿魏酸; 脂多糖; 小胶质细胞; 神经性炎症; 阿尔茨海默病
小胶质细胞(Microglia, MG)在中枢神经系统(central nervous system, CNS)中, 约占神经胶质细胞总数的19%, 发挥内源性免疫防御作用。在病理条件下, 其介导的慢性炎症反应是阿尔茨海默病(Alzheimer s disease, AD)等神经退行性病变的重要病理特征之一。因此, 抑制小胶质细胞活化对治疗AD等神经退行性疾病具有重要意义。阿魏酸(ferulic acid, FA)是当归、川芎、升麻等中药的有效成分之一, 具有抑制小胶质细胞活化和多种炎症因子表达的作用(Kim et al, 2004; Jin et al, 2008), 但阿魏酸抑制小胶质细胞活化的机制, 尚待进一步研究。
AD的炎症模型主要建立在细胞模型上, 通过致炎因子或缺氧缺血条件诱导神经元或神经胶质细胞产生炎症反应。利用LPS激活小胶质细胞建立AD等神经退行性疾病的炎症模型是国际上公认的造模手段。本研究采用LPS刺激具原代的小胶质细胞形态学、表型以及各项功能特点的 BV-2细胞株, 建立炎症模型, 研究阿魏酸对炎症反应的抑制作用。
1 材料和方法
1.1 主要实验材料和仪器
BV-2细胞株购自北京协和医科大学细胞中心;阿魏酸、吲哚美辛(indometacin, INDO)购自广州市药检所; 脂多糖、地塞米松(dexamethasone, DEX)、氨基胍(aminoguanidine, AG)、二甲基亚砜(dimethyl sulfoxide, DMSO)购自美国Sigma公司; TLR4抑制剂MST510购自美国eBioscience公司; BCA蛋白浓度测定试剂盒、RIPA裂解液、环氧合酶-2(cyclooxygenase-2, COX-2)选择性抑制剂 NS-398购自江苏海门市碧云天生物技术研究所;RPMI-1640培养基购自美国Gibco公司; 胎牛血清购自杭州四季青生物工程有限公司; 噻唑蓝(methylthiazoletetrazolium, MTT)购自美国 Axygen公司; 一氧化氮(nitric oxide, NO)试剂盒购自南京建成生物工程研究所; 白细胞介素-1β(interleukin1β,IL-1β)、前列腺素 E2(prostaglandin E2, PGE2)ELISA试剂盒购自美国 R&D公司; 兔抗鼠的 COX-2、β-actin多克隆抗体购自美国Cell Signaling Technology;兔抗鼠的诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)多克隆抗体购自美国 BD 公司; 兔抗鼠的TLR4多克隆抗体、过氧化物酶偶联的羊抗兔多克隆抗体购自美国Santa cruz公司; 各种生化试剂(Tris-Base、SDS、甘氨酸、过硫酸胺、甲叉双丙烯酰胺、Tween20等)均为美国Amersco公司进口分装; 预染marker购自加拿大MBI Fermentas公司;PVDF膜购自美国Millipore公司; 脱脂奶粉购自美国Difco公司; 20X LumiGLO(R) Reagent and 20X Peroxide 化学发光液购自美国 Cell Signaling Technology; CO2培养箱(美国Shellab公司); 超净工作台(苏州净化设备厂); 全波长多功能酶标仪(奥地利TZCAN公司); 倒置显微镜(日本Nikon公司); 垂直电泳槽、蛋白转印槽、电泳仪和电源(美国Bio-rad公司)。
1.2 细胞培养
实验用小鼠小胶质细胞株 BV-2为贴壁细胞,置于RPMI-1640培养液(含10%胎牛血清, 100 U/mL青霉素, 100 U/mL链霉素)中, 于37 ℃, 5% CO2培养箱中培养, 根据细胞代谢情况, 1~2 d换液, 至指数生长期备用。
1.3 MTT法测阿魏酸对BV-2细胞活性的影响
将指数生长期的 BV-2细胞配制成细胞悬液接种于96孔板, 密度为5×104个/mL, 待细胞贴壁后,分别加入不同浓度的阿魏酸(0.83、2.5、7.5、22.5、67.5 μg/mL)孵育24 h后, 弃掉上清液, 加培养基作用24 h后弃上清液, 加入10 μL的MTT, 90 μL培养基孵育4 h后, 弃上清, 加入150 μL的DMSO, 充分震荡使结晶溶解后, 于 570 nm 下测各孔的 OD值。实验中分别设立对照孔(不加药物的细胞空白孔)和调零孔(不接种细胞空白孔), 每组设6个复孔, 细胞的存活率(%)=1−〔(对照孔−调零孔)−(实验孔−调零孔)〕/(对照孔−调零孔)×100 %。
1.4 硝酸还原酶法检测阿魏酸对NO的抑制作用
取指数生长期的细胞配制成细胞悬液, 分别接种于 24 孔板中, 5×105个/mL, 每孔 1 000 μL, 设正常组, DMSO组, LPS组, 阿魏酸药物组(2.5、7.5、22.5 μg/mL), 吲哚美辛药物组(4 μg/mL), 氨基胍药物组(11 μg/mL)。待细胞贴壁后, 加入各浓度药物预孵育1 h后, 加入100 ng/mL LPS刺激12 h后检测NO的生成量, 按照南京建成 NO检测试剂盒说明书操作。
1.5 酶联免疫法测阿魏酸对 IL-1β、PGE2的抑制作用
取指数生长期的细胞配制成细胞悬液, 分别接种于 24 孔板中, 5×105个/mL, 每孔 1 000 μL, 设正常组, DMSO组, LPS组, 阿魏酸药物组(2.5、7.5、22.5 μg/mL), 吲哚美辛药物组(4 μg/mL), NS-398(3 μg/mL)药物组, 地塞米松药物组(4 μg/mL)。待细胞贴壁后, 加入各浓度药物预孵育 1 h后, 加入 100 ng/mL LPS刺激24 h后检测IL-1β、PGE2的表达量,按照ELISA试剂盒说明书操作。
1.6 免疫印记法检测阿魏酸对 iNOS、COX-2、TLR4蛋白表达的影响
取指数生长期的 BV-2细胞接种于 6孔板中,5×105个/mL, 每孔 1 000 μL。待细胞贴壁后, 加入各浓度药物预孵育1 h后, 加入100 ng/mL LPS刺激12 h后, 弃上清, 用预冷的PBS洗涤3次, 加100 μL的RIPA裂解液, 冰上作用30 min后, 用细胞刮把细胞刮下, 12 000×g, 4 ℃离心15 min, 将上清液移到1.5 mL的EP管中进行蛋白定量和免疫印记。蛋白定量根据BCA蛋白浓度测定试剂盒说明书进行。各实验组取等量蛋白20 μg进行电泳分析。电泳结束后将蛋白转移至 PVDF膜上, 用含 5%脱脂奶粉的TBST(10 mmol /L Tris-HC1, pH 7.5, 150 mmol/L NaC1, 1% Tween-20)于室温下脱色摇床上摇动封闭1 h。然后分别与抗iNOS、COX-2、TLR4抗体(1∶1 000)4 ℃孵育过夜, 洗脱一抗后与二抗(1∶2 000)孵育1 h, 洗脱二抗后采用发光液作用1 min后, 通过X-胶片显影、定影。
1.7 统计学分析
各项实验重复三次, 使用 SPSS13.0中的 Oneway ANOVA 中的Bonferroni Test 进行多个样本间的两两比较,P<0.05 为结果具有显著性差异。
2 结 果
2.1 阿魏酸对BV-2细胞活性的影响
由图1的结果可知, 浓度为0.83~67.5 μg/mL的阿魏酸组的细胞活力分别为 98.5%、96.9%、99.4%、100.5%、97.1%。与正常组相比, 细胞活力无统计学差异。这说明在该浓度范围内阿魏酸对细胞活性无明显影响。以下实验将采用 2.5~22.5 μg/mL的浓度范围。
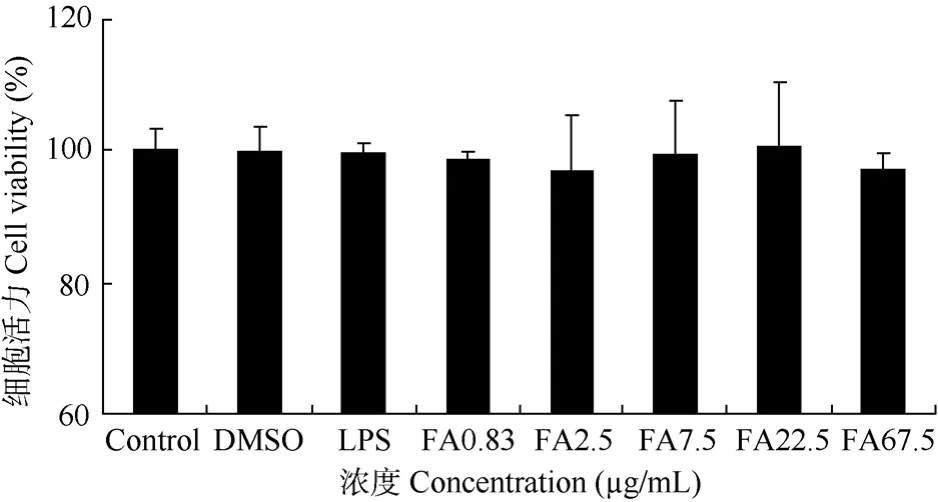
图1 阿魏酸对BV-2细胞的活性的影响Fig. 1 Cytotoxicity effects of FA on BV-2 cells
2.2 阿魏酸抑制NO的生成
NO由神经胶质细胞活化所产生的炎症因子之一, 是神经性炎症的一个重要检测指标。实验采用硝酸还原酶法检测阿魏酸对LPS诱导BV-2细胞生成的NO的影响。图2A结果显示, LPS组的NO生成量显著性高于正常组, 增量为 156.34%。DMSO组与正常组相比,无显著性差别。与 LPS组相比,2.5~22.5 μg/mL的阿魏酸呈浓度依赖性降低NO的产生, 其抑制率分别为 9.66%、22.43%、41.27%。非甾体类抗炎药物吲哚美辛(INDO)和iNOS选择性抑制氨基胍(AG)均显著性抑制NO的生成, 抑制率分别为47.77%和56.17%。
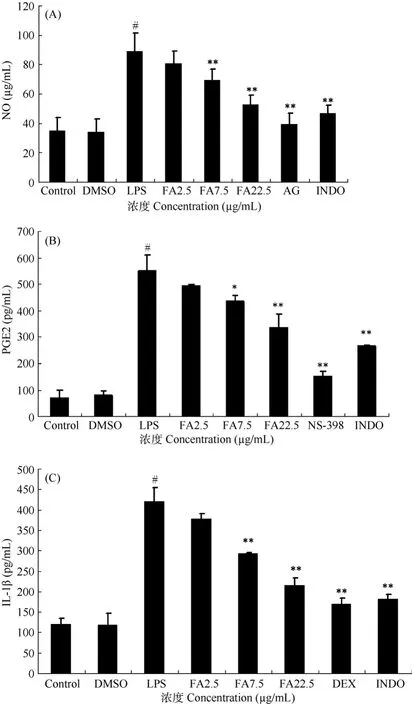
图2 阿魏酸对LPS诱导BV-2生成NO(A)、PGE2(B)和 IL-1β(C)的影响Fig. 2 Effect of FA on LPS-induced NO (A),PGE2 (B), IL-1β (C) production in BV-2 cells
2.3 阿魏酸抑制PGE2的表达
PGE2作为主要的炎症介质, 在 AD等神经退行性疾病的炎症反应过程中发挥着重要的作用。本实验应用PGE2 ELISA试剂盒检测不同浓度阿魏酸对PGE2表达的影响。图2B结果显示, LPS组的PGE2表达显著性高于正常组的表达量, 增加678%。DMSO组与正常组相比无显著性差别。与LPS组相比, 2.5~22.5 μg/mL阿魏酸对PGE2的抑制率分别为:10.5%、20.9%、39.2%, PGE2表达显示呈浓度依赖降低。非甾体类抗炎药物吲哚美辛(INDO)和COX-2选择性抑制NS-398均显著性抑制PGE2的生成, 抑制率分别为51.9%和72.3%。
2.4 阿魏酸抑制IL-1β的表达
IL-1β是神经性炎症反应中的重要的炎症因子之一, 能启动细胞因子恶性循环, 最终导致炎症反应的级联放大。因此, 抑制 IL-1β的表达对保护神经细胞具有重要意义。
本实验应用IL-1β ELISA试剂盒检测不同浓度阿魏酸对IL-1β表达的抑制作用。图2C结果显示,LPS组的 IL-1β表达显著性高于正常组的表达量,增加 252.5%。DMSO组与正常组相比,无显著性差别。与LPS组相比, 2.5~22.5 μg/mL阿魏酸浓度依赖降低IL-1β的表达, 其抑制率分别为:10.2%、30.4%、49.1%。抗炎类药物地塞米松(DEX)和吲哚美辛(INDO)均显著性抑制 IL-1β的生成, 抑制率分别为59.9%和56.9%。
2.5 阿魏酸抑制iNOS、COX-2蛋白的表达
iNOS和COX-2分别是NO和PGE2生成的限速酶, 正常时无表达或表达量低, 在LPS等多种神经毒性物质刺激下, 表达量增加, 并促使 NO和PGE2的生成。
本实验采用 Western blotting检测了 iNOS、COX-2蛋白的表达。AG为iNOS的抑制剂, NS-398为 COX-2抑制剂。图 3A、3B结果显示, 正常组iNOS和 COX-2蛋白表达量极少, 经 LPS刺激后,iNOS、COX-2蛋白表达量明显上调, 阿魏酸可以抑制iNOS、COX-2蛋白表达, 并呈浓度依赖性。
2.6 阿魏酸抑制TLR4蛋白的表达
为了进一步探讨阿魏酸抑制 LPS诱导小胶质细胞炎症反应的分子机制, 本实验采用 Western blotting检测了TLR4蛋白的表达。MST510为TLR4抑制剂, 图3C结果显示, 正常组TLR4表达量极少,LPS组的TLR4蛋白表达量较正常组明显增加, 阿魏酸可以抑制TLR4蛋白表达, 并呈浓度依赖性。
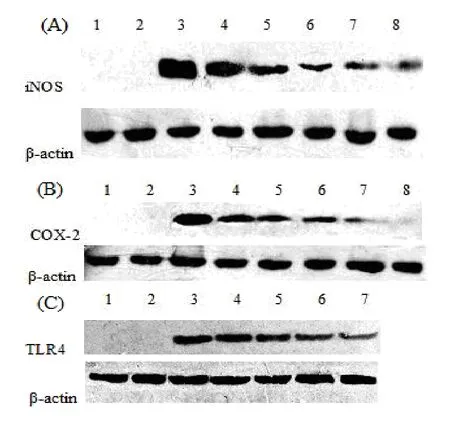
图3 阿魏酸对iNOS(A)、COX-2(B)、TLR4(C)蛋白表达的影响Fig. 3 Effect of FA on LPS-induced expression of iNOS(A)、COX-2(B)、TLR4(C)protein
3 讨 论
在AD等神经退行性病变的发生和发展过程中,小胶质细胞发挥着“双刃剑”的作用。在炎症的初期, 小胶质细胞通过吞噬作用清除病原微生物和死亡的细胞以维持脑内的平衡。随着AD等神经退行性病变的发展, 活化的小胶质细胞释放炎症因子,部分炎症因子会与小胶质细胞表面的受体结合, 如Toll/IL-1受体(Toll/IL-1 receptor , TIR), 进一步激活小胶质细胞, 形成恶性正反馈环路, 使得脑内的慢性炎症反应级联放大(Rothwell & Luheshi, 2000;Eitan et al, 2009)。所以, 寻找能减少脑内炎症反应的药物, 具有十分重要的意义。由于阿魏酸具有较强的抗炎活性, 因此, 我们通过体外培养小胶质细胞建立神经性炎症模型, 研究阿魏酸对LPS诱导小胶质细胞活化所产生的炎症反应的抑制作用, 并重点探讨阿魏酸抑制小胶质细胞活化的分子机制。
作为脑内主要的免疫效应细胞, 小胶质细胞发挥着类似巨噬细胞的功能, 在受到刺激时易被激活,分泌大量的炎症因子。NO虽然是多种生理功能的重要调节分子, 但在AD等神经退行性疾病的发病过程中, 大量的NO是造成神经细胞损伤死亡的重要炎症因子之一, NO可导致宿主细胞和邻近细胞的损伤。iNOS是NO生成过程中最主要的限速因子, 是炎症中的一种反应性酶类, 其表达不但是反应性胶质细胞增生的标志之一, 还与神经元损伤有关, 正常时无表达或表达量低, 在LPS等多种神经毒性物质刺激下, 表达量增加, 从而导致 NO的产量增加, 因此, 直接抑制iNOS和NO的产生, 是炎症治疗的有效手段之一。我们的研究发现, 阿魏酸能明显抑制LPS诱导的BV-2细胞的NO的生成和iNOS蛋白的表达, 这可能是阿魏酸以通过抑制小胶质细胞活化, 从而抑制神经性炎症的功能之一。
针对 AD等神经退行性疾病的慢性炎症理论,非甾体抗炎药(non-steroidalant-inflammatory drugs,NSAIDs)被应用于临床测试, 其主要是通过 COX-1和COX-2途径起作用的。COX-2是一些炎症因子的诱导酶, 炎症因子、LPS、促细胞分裂剂等分子以及损伤、低氧、局部缺血等试验条件和多种神经变性疾病, 均可诱导产生COX-2(Smith et al, 2000;Ho et al, 1999)。PGE2是COX-2途径和免疫调节过程的代谢产物, 是急慢性炎症疾病的一个重要的检测指标。COX-2在AD患者海马神经元内表达增加,尤其在AD早期COX-2的水平可作为病变的标志并最终影响AD的进展(Ho et al, 1999)。这些结果为早期用COX-2抑制剂治疗AD提供了理论基础。虽然长期服用NSAIDs可降低AD的患病风险, 但是长期应用会导致严重的胃黏膜损伤和肾功能障碍等。因此, 安全性高、作用效应好的新型药物是有效治疗AD的方向之一。IL-1β在神经退行性疾病中具有重要作用, 一方面表现为 IL-1β能抑制神经元钙通道电流, 从而减少钙过载发生而具有保护神经细胞的功能(Zhou, 2010); 另一方面IL-1β不但可以激活星形胶质细胞释放炎症因子, 还可以启动“细胞因子循环”, 与其受体结合, 诱导相关的信号转录因子表达增加, 使得脑内使得脑中长期慢性炎症存在, 引发大量的神经细胞的死亡(Sheng et al, 2001)。研究发现, 阿魏酸是能够显著地抑制 COX-2蛋白以及致炎因子PGE2和IL-1β的表达。
TLRs是机体内可识别并结合病原相关分子模式的重要受体之一, 通过启动不同的信号途径参与机体相关免疫调节, 与AD等神经退行性疾病发病过程密切相关。在AD病人脑内, TLR呈现出的高表达状态, 例如, TLR2和TLR4(Walter et al, 2007)。TLR4属于 TLR家族, 其配体主要为细菌产物, 易被LPS等病原体相关分子模式激活, 引发免疫炎症反应。文献报道, LPS作用人源小胶质细胞, 激活TLR4, 从而导致肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)和白细胞介素-6(interleukin 6, IL-6)等炎症因子的高表达(Chan et al, 2003; Becher et al,1996)。LPS与小胶质细胞表面的 TLR4受体结合,导致受体发生二聚化, 激活p38促分裂原活化蛋白激酶(p38 mitogen-activated protein kinase, P38MAPK)、c-Jun氨基末端激酶(c-Jun N-terminal kinases, JNK)、核因子κB (Nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB) 等多条信号转导途径,最终诱导 NO、COX-2、IL-1β等炎症因子产生(Byrd-Leifer et al, 2000; Andrew & Ismar, 2005)。国内外现有的关于阿魏酸抗炎作用的分子机制的研究主要集中在中下游 NF–κB/MAPK/JNK 激酶方面。我们着重研究阿魏酸对炎症因子的影响以及与上游 TLR4介导相关的免疫炎症反应的关系, 以期对阿魏酸抑制神经性炎症的作用机理有新的认识。在验证阿魏酸能显著抑制由 LPS诱导小鼠小胶质细胞活化所产生的炎症因子之后, 我们进一步探讨阿魏酸的作用机制。实验结果显示, 经 LPS刺激BV-2小胶质细胞后, 各药物组的TLR4蛋白表达较正常组有明显增加, 而各浓度的阿魏酸药物组的TLR4蛋白表达量较LPS组下降, 表明阿魏酸神经保护作用的机制可能是抑制 MAPK、NF-κB等信号通路的上游分子靶点 TLR4的表达, 从而减少下游产物NO、COX-2、IL-1β等炎症因子表达。
本部分实验证实, 阿魏酸具有抑制小胶质细胞活化, 抑制神经性炎症的作用, 其机制可能是阿魏酸通过抑制TLR4相关的免疫信号通路达到抑制神经性炎症的效果。神经退行性疾病是一个复杂多机制的参与过程, 阿魏酸的保护作用是否涉及到其他机制, 还有待继续研究。
Andrew GB, Ismar RH. 2005. The role of Toll-like receptors in the host response to viruses [J].Mol Immunol, 42(8): 859-867.
Becher B, Fedorowicz V, Antel JP. 1996. Regulation of CD14 expression on human adult central nervous system-derived microglia [J].J NeurosciRes, 45(4): 375-381.
Byrd-Leifer CA, Block EF, Takeda K, Akira S, Ding A. 2000. The role of MyD88 and TLR4 in the LPS-mimetic activity of Taxo1 [J].Eur J Immunol, 31(8): 2448-2457.
Chan A, Seguin R, Magnus T, Papadimitriou C, Toyka KV, Antel JP, Gold R.2003. Phagocytosis of apoptotic inflammatory cells by microglia and its therapeutic implications: termination of CNS autoimmune inflammation and modulation by interferon-beta [J].Glia, 43(3):231-242.
Eitan O, Kathleen JG, Justin DL, Sung-Chun T, Mark PM, Thiruma VA.2009. Toll-like receptors in neurodegeneration [J].Brain Res Rev,59(2): 278-292.
Jin Y, Yan EZ, Li XM, Fan Y, Zhao YJ, Liu Z, Liu WZ. 2008.Neuroprotective effect of sodium ferulate and signal transduction mechanisms in the aged rat hippocampus [J].Acta Pharmacol Sin,29(12): 1399-1408.
Kim HS, Cho JY, Kim DH, Yan JJ, Lee HK, Suh HW, Song DK. 2004.Inhibitory effects of long-term administration of ferulic acid on microglial activation induced by intracerebroventricular injection of β amyloid peptide (1 - 42) in mice [J].Biol Pharm Bull, 27(1): 120-121.
Ho L, Pieroni C, Winger D, Purohit DP, Aisen PS, Pasinetti GM. 1999.Regional distribution of cyclooxygenase-2 in the hippocampal formation in Alzheimer’s disease [J].J Neurosci Res, 57(3): 295-303.
Sheng JG, Jones RA, Zhou XQ, McGinness JM, Van Eldik LJ, Mrak RE,Griffin WS. 2001. Interkeukin-1 promotion of MAPK-p38 over expression in experimental animals and in Alzheimer's disease:potential significance for tau protein phosphorylation [J].Neurochem Int, 39(5-6): 341-348.
Smith WL, DeWitt DL, Garavito RM. 2000. Cyclooxygenases: structural,cellular, and molecular biology [J].Annu Rev Biochem, 69: 145-182.
Rothwell NJ, Luheshi GN. 2000. Interleukin 1 in the brain: biology,pathology and therapeutic target [J].Trends Neurosci, 23(12): 618-625.
Walter S, Letiembre M, Liu Y, Heine H, Penke B, Hao W, Bode B, Manietta N, Walter J, Schulz-Schuffer W, Fassbender K. 2007. Role of the toll-like receptor 4 in neuroinflammation in Alzheimer's disease [J].Cell Physiol Biochem, 20(6): 947-956.
Zhou C. 2010. Inhibition effect of IL-1β on calcium channels currents in cultured cortical neurons of rat [J].Zool Res, 31(1): 89-93. [周辰. 2010.白介素 1β对培养的大鼠皮层神经元钙通道电流的抑制作用. 动物学研究, 31(1): 89-93.]
Inhibitory effect of ferulic acid on in fl ammatory response in microglia induced by lipopolysaccharides
HUANG Feng1,*, DENG Hua-Ming1, ZHU Miao-Miao1, XIAO Fei2, YANG Li3,ZHANG Zai-Jun4, XIAO Ying4, NIE Hong1
(1.Department of Pharmacology of Traditional Chinese Medicine,College of Pharmacy,Jinan University,Guangzhou510632,China; 2.Department of Pharmacology,School of Medicine,Jinan University,Guangzhou510632,China; 3.Department of Traditional Chinese Medicine,College of Pharmacy,Jinan University,Guangzhou510632,China; 4.Institute of New Drug Research,College of Pharmacy,Jinan University,Guangzhou510632,China)
Ferulic acid (FA) is a natural compound that expresses antioxidant and anti-inflammatory activities.Microglial cells are innate immune cells that reside within the central nervous system (CNS). Activated microglia mediated neuronal immunity contributes to the neurodegeneration associated with Alzheimer's disease. In this study, we investigated the inhibitory effect of FA on neuroinflammation in BV-2 microglial cells induced by lipopolysaccharides(LPS). Our study showed that FA significantly suppressed the production of nitric oxide (NO), prostaglandin E2 (PGE2),interleukin-1β (IL-1β), and decreased induced type II nitric oxide synthase (iNOS) and cyclooxygenase-2 (COX-2)protein in LPS-stimulated BV-2 microglia cells in a dose dependent manner. We hypothesized that this was achieved by suppressing the protein level of Toll-like receptor 4 (TLR4).
Ferulic acid; Lipopolysaccharides; Microglia; Neuroinflammation; Alzheimer's disease
R965; R282.71; R749.16
A
0254-5853-(2011)03-0311-06
10.3724/SP.J.1141.2011.03311
2011-03-07;接受日期:2011-04-19
广东省医学科研基金项目(A2010344); 暨南大学药学院211工程和重点实验室创新研究项目∗
Corresponding author),E-mail: hftxyy@yahoo.com.cn
- Zoological Research的其它文章
- 白介素1β对大鼠皮层神经元钠电流的急性作用
- 尼罗罗非鱼Orexin前体基因的克隆、组织分布及其在摄食调控中的表达
- Effects of urethane on the response properties of visual cortical neurons in young adult and old cats
- Phylogenetic evaluation of the taxonomic status of Papilio maackii and P. syfanius (Lepidoptera: Papilionidae)
- Genetic differentiations between randomly and selectively bred pig populations in Yunnan, China
- 棕颈钩嘴鹛分子系统发育及分类关系初探

