盐度和甜菜碱对鲈鱼BHMT mRNA表达的影响
钱云霞, 宋娟娟
(宁波大学 生命科学与生物工程学院, 浙江 宁波 315211)
盐度和甜菜碱对鲈鱼BHMT mRNA表达的影响
钱云霞*, 宋娟娟
(宁波大学 生命科学与生物工程学院, 浙江 宁波 315211)
甜菜碱高半胱氨酸甲基转移酶(BHMT, EC 2.1.1.5)催化甜菜碱的甲基转移给高半胱氨酸(Hcy), 而分别生成二甲基甘氨酸和蛋氨酸。利用 RT-PCR和 SMART RACE的方法从鲈鱼(Lateolabrax japonicus)肝脏中克隆了BHMT全长cDNA。该序列全长1 461 bp, 5'端非翻译区72 bp, 3'端非翻译区183 bp, 开放阅读框1 206 bp, 可编码一个由 401个氨基酸组成的蛋白质, 该蛋白质相对分子质量为 44.32 kD, 等电点为 7.21。氨基酸序列分析表明,BHMT具有较高的保守性, 鲈鱼BHMT与人、小鼠等 9个物种的同源性为77%~93%, 其中与黄鲈(Perca flavescens)同源性最高, 为93%。用RT-PCR分析BHMT基因在10个组织中的表达结果表明, 只有在肝、肠和肾中有较高的表达。 RT-PCR和定量PCR表明, 鲈鱼从盐度25的海水转入盐度12的海水后, 肝、肠和肾BHMT基因表达量有增加, 而将鲈鱼从盐度为25的海水转入盐度为29的海水后, 肝、肠和肾的BHMT基因表达则减少。腹腔注射甜菜碱可增加鲈鱼 BHMT基因在肝、肠和肾三个组织中的相对表达量。这些结果表明, 甜菜碱可诱导鲈鱼BHMT 基因表达, 而BHMT在适应鱼类环境渗透压变化中起重要作用。
鲈鱼; BHMT; 克隆; 组织表达; 盐度
甜菜碱化学名为N-三甲基甘氨酸, 在生物体内它是胆碱代谢的中间产物, 广泛存在于各组织中,在细胞的线粒体中生成后释放到胞浆。由于甜菜碱的三个甲基都是有效的活性甲基, 因而它是体内最有效的甲基供体之一(Wettstein et al, 1998)。同时,甜菜碱还是重要的渗透压调节剂。研究表明, 哺乳动物的肝脏和肾脏细胞为保持细胞体积的稳定会在细胞高渗收缩时累积甜菜碱, 在细胞低渗肿胀时释放甜菜碱(Garcia & Burg, 1991; Wettstein et al,1998)。在鱼类, 甜菜碱可以使大西洋鲑(Salmo salar)从淡水进入海水时减少盐度变化的刺激, 当鱼类的饵料中含有甜菜碱时, 肌肉含水率降低, 保持渗透压平衡的能力提高(Junnila, 2000)。目前, 甜菜碱在渗透压调节中的作用已经在许多生物中得到证实,包括微生物、植物和其它动物(Polat & Beklevik,1998.)。
体内甜菜碱的代谢分解主要是通过甜菜碱高半胱氨酸甲基转移酶(Betaine homocysteine methyltransferase, BHMT, EC 2.1.1.5 )催化, BHMT是一种 Zn2+依赖的巯基甲基转移酶(Neece et al,2000), 将甜菜碱的一个甲基转移给高半胱氨酸后分别生成二甲基甘氨酸和蛋氨酸(甲硫氨酸)(Sandra et al, 2000), 从而降低高半胱氨酸(也叫同型半胱氨酸)的浓度, 因为高浓度的高半胱氨酸可引发心血管疾病(Pajares & Perez-Sala, 2006)。虽然高半胱氨酸可以通过转硫作用生成胱硫醚而排出体外, 但从节约蛋氨酸的角度出发, 由BHMT催化的高半胱氨酸的再甲基化在蛋氨酸循环中尤为重要(Pajares &Perez-Sala, 2006)。高半胱氨酸还可由蛋氨酸合成酶(methionine synthetase, MS, EC 2.1.1.13 )催化生成蛋氨酸, 该酶与辅酶 B12结合, 催化 N5-甲基四氢叶酸的甲基转移到高半胱氨酸上生成蛋氨酸, 因而叶酸缺乏时补充甜菜碱是治疗人类高半胱氨酸血症的重要手段(Schäfer et al, 2007)。BHMT基因序列已在许多生物中被报道(Fisher et al, 2002), 但是鱼类 BHMT到目前为止仅见于黄鲈(Perca flavescens)、金头鲷(Sparus aurata)、大西洋鲑、斑马鱼(Danio rerio)、牙鲆(Paralichthys olivaceus)等。
鲈鱼(Lateolabrax japonicus), 属鲈形目鮨科鲈属, 是一种广盐性、肉食性的鱼类, 因其肉质细美,营养丰富, 广受国内外市场青睐, 是我国沿海主要海水养殖鱼类之一。本实验通过PCR和RACE技术克隆了鲈鱼BHMT基因全长, 并对其进行了结构分析, 通过RT-PCR方法检测了BHMT基因在鲈鱼组织中的分布, 同时检测了盐度和甜菜碱对鲈鱼各组织中BHMT基因表达的影响, 为今后研究BHMT功能及鱼类渗透压调节机制奠定基础。
1 材料与方法
1.1 总RNA的提取和cDNA的合成
克隆基因所用鲈鱼取自浙江象山黄避岙养殖场, 属厦门沿海的南方种群, 活体解剖, 快速取出肝脏, 用Trizol法提取总RNA, 用Thermo公司的ND-1000型微量紫外分光光度计测定其浓度, 并取1 μg总RNA按照TaKaRa公司的PrimeScript™ 1st Strand cDNA Synthesis Kit说明书逆转录第一链cDNA。
1.2 核心片段的获取
据已知大西洋鲑、金头鲷、牙鲆、斑马鱼和黄鲈 BHMT保守序列设计引物 BHMT F1:5'GTCATGCAGACNTTCACYTTCT-3'和 BHMT R1:5'-GGTGGCYTCCTTSTGCT GC-3', 以鲈鱼肝脏cDNA为模板扩增BHMT基因的中间片段。引物均由Generay Biotech公司合成。PCR条件如下:94 ℃预变性 4 min; 94 ℃ 30 s, 57~55 ℃30 s, 72℃1 min, 各 1 个循环; 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃1 min, 34个循环; 最后 72 ℃延伸 5 min。使用Beyotime公司生产的凝胶回收试剂盒回收PCR产物, 然后与 pMD18-T载体进行连接, 转化E. coliDH5α感受态细胞后, 于含氨卞青霉素(终浓度 100 μg/m L)的LB琼脂平板上37 ℃过夜培养, 筛选阳性克隆菌株, 经pMD18-T载体通用引物PCR鉴定,正确的克隆要送上海Invitrogen生物有限公司测序。
1.3 3'RACE扩增和5'RACE扩增
RACE PCR扩增按照 Clontech公司的SMARTTMRACE cDNA Amplification Kit的说明书进行。取1 μg肝脏总RNA按照说明书合成3'Ready cDNA和5'Ready cDNA。根据获得的中间片段序列,设计特异性引物 3'RACE P1:5'-CCTGTGACCTGGCACGAG AAGTAGC-3'和 5'RACE P1:5'-CCTGATGTGGTAAGGCTCAAATCCGC A-3', 分别以3'READY cDNA和 5' READY cDNA为模板,3'RACE P1和5'RACE P1引物, 以及试剂盒提供的通用引物UPM进行3'RACE和5'RACE第一轮PCR反应。PCR反应条件如下:94 ℃ 30 s, 72 ℃ 3 min, 5个循环; 94 ℃ 30 s, 70 ℃ 30 s, 72 ℃ 3 min, 5 个循环:94 ℃ 30 s, 68 ℃ 30 s, 72 ℃ 3 min, 25 个循环;最后72 ℃延伸8 min。以第一轮PCR产物稀释50倍作为模板, 设计巢氏引物3'RACE P2:5'-CTGCTGCGGATTTGAGCCTTACC-3'和 5'RACE P2 :5'-ATGGATGGGCACTTGGGACGACC-3'。再以3'RACE P2、5'RACE P2和试剂盒提供的引物Nest-UPM分别进行第二轮PCR扩增。PCR反应条件如下:预变性94 ℃ 3 min; 94℃ 30 s, 68 ℃ 30 s,72 ℃ 3 min, 30个循环; 最后72 ℃延伸10 min。产物的回收、测序方法同1.2。
1.4 鲈鱼BHMT基因cDNA序列和蛋白质序列的
分析
获得鲈鱼BHMT cDNA全长序列后, 用Bioedit软件推测其编码的氨基酸序列, 在 NCBI中用BLAST进行同源性检索, 并用MEGA 4中的临位相联法(Neighbor-joining, NJ)构建BHMT氨基酸序列系统进化树。构建系统树所用动物及其BHMT序列号如下:黄鲈(Perca flavescens, ABU63967)、金头鲷(Sparus aurata,ABF06673)、大西洋鲑(Salmo salar,NP_001133157)、斑马鱼(Danio rerio, NP_001012498)、牙鲆(Paralichthys olivaceus, ABM88795)、非洲爪蟾(Xenopus laevis, NP_001088416)、人(Homo sapiens,NP_001704)、黑猩猩(Pan troglodytes, XP_517686)、小鼠(Mus musculus, NP_057877)、牛(Bos taurus,NP_001011679)。
1.5 盐度对鲈鱼BHMT表达的影响
盐度实验在室内白色圆桶内进行, 每桶水体积为 100 L, 水温(25±0.1)℃, pH 7.2±0.1, 期间不间断充气, 实验用鲈鱼平均体重 120 g, 实验选取 15条平均体重为120 g的鲈鱼, 分成3组, 实验海水盐度为 25±0.1。实验开始后, 高盐组:逐步换入部分曝气人工高盐水24 h后盐度升至29;低盐组:换入部分曝气自来水24 h后盐度降为12;对照组:换取部分海水盐度保持在25。再经过5 h后,各组取5条鲈鱼。实验期间不投饵, 没有鲈鱼死亡。用Sigma公司生产的MS-222(1:2000)麻醉后快速取出肌肉、心、眼、脑、鳃、肝、肠、肾、脂、脾等10个组织, 提取总RNA, 逆转录成cDNA, RT-PCR检测实验组和对照组鲈鱼各组织 BHMT基因的表达。 RT-PCR跨内含子引物为:BHMT F2:5'-TGTGACCTGGCACGAGAAGTAG-3'; BHMT R2:5'-TGTGGTAAGGCTCAAATC CGCA-3', PCR产物长度为610 bp。以18S作为内参对照, 引物为18S F:5'-GTAGTTCCGACCATAAACGATGCC-3'; 18S R:5'-AGAAGTTGGACGCCGACCGCAC-3', PCR产物长度为373 bp。18S的扩增条件为:预变性94 ℃,4 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 28 个循环;72 ℃ 10 min。BHMT基因的扩增条件为:预变性94 ℃ 4 min; 94 ℃ 30 s, 55 ℃ 50 s, 72 ℃ 1 min, 35个循环; 72 ℃ 10 min。用Gel-Pro Analyzer 4凝胶定量分析软件分析电泳图片, 求得的 BHMT基因与18S PCR产物量的比值, 并用此值代表BHMT基因mRNA的相对表达量。
Real-Time Quantitative PCR检测盐度对鲈鱼肝、肠和肾BHMT mRNA表达的影响。取各组鲈鱼肝、肠和肾 1 μg总 RNA按照 TaKaRa公司的PrimeScript™ RT Reagent Kit说明书逆转录第一链cDNA。BHMT的Real-Time Quantitative PCR引物为:BHMT F3:5'-CTGGGGCACAAATCAACGAG-3'和 BHMT R3:5'-ATGTCTCCCTCTGGTCCGAT G-3'。扩增条件为:95 ℃ 10 s; 95 ℃ 5 s, 56 ℃ 30 s,72 ℃ 20 s , 40个循环; 最后72 ℃延伸10 min, PCR产物长度为295 bp。作为内参对照β-actin的引物为β-actin F : 5'-TGTGCAAAGCCGGATTCG-3'和β-actin R : 5'-CCTCTCTTGCTCTGGGCTTCA-3',PCR产物长度为142 bp。扩增条件为:95 ℃ 10 s;95 ℃ 5 s, 56 ℃ 30 s, 72 ℃ 20 s, 40个循环。扩增在 Rotor-Gene 6000荧光定量 PCR仪上进行。Real-Time Quantitative PCR 结束后对扩增产物进行熔解曲线分析, 以确保特异性扩增, 根据标准曲线计算样品中 BHMT基因 mRNA 的拷贝数。设定对照组BHMT在肝脏中的表达量为1, 根据BHMT在各组中的表达相对量作图。实验结果用 SPSS统计软件进行Ttest检验,P<0.05表示差异有显著性。
1.6 甜菜碱对鲈鱼肝、肠和肾BHMT基因表达的影响
鲈鱼大小和养殖条件同 1.5对照组, 甜菜碱(Sigma公司)以 PBS为溶剂, 注射浓度为:400 mg/kg体重, 注射量为 0.1 mL, 另设 PBS对照组。鲈鱼用MS-222麻醉后腹腔注射。实验期间鲈鱼生活状态良好, 无死亡。注射5 h麻醉后解剖鲈鱼, 实验组和对照组各4条鲈鱼, 取肝、肠和肾组织, 用Real-Time Quantitative PCR检测甜菜碱对鲈鱼肝、肠和肾 BHMT基因表达的影响, 具体方法同1.5。
2 结 果
2.1 鲈鱼BHMT全长cDNA的克隆和序列分析
利用兼并引物BHMT F1和BHMT R1从鲈鱼肝脏cDNA中扩增得到长度为954 bp的片段, 与预期大小相符, PCR产物克隆测序后经BLAST分析确认为鲈鱼BHMT的核心序列。根据该核心序列设计巢式PCR引物, 分别克隆得到517 bp的3'RACE产物和1 151 bp的5'RACE产物。将获得的3'、5'末端序列与核心序列拼接最终得到 BHMT基因的全长cDNA序列。结果表明, BHMT基因cDNA序列全长为1 461 bp, 含一个1 206 bp的开放阅读框, 73~75 bp处为起始密码子ATG, 1 276~1 278 bp处为终止密码子TGA, 编码一个由401个氨基酸组成的蛋白质(图1), 典型加尾信号AATAAA位于polyA起点上游14 bp。http://ca.expasy.org/tools/线软件分析表明,该蛋白质相对分子质量为44.32 k、等电点为7.21, 已经递交GenBank, 序列号为:HQ008859。
2.2 BHMT的同源性比较和系统发育分析
将鲈鱼与黄鲈等十个物种的 BHMT进行氨基酸序列 BLAST分析后发现, 鲈鱼与同为鲈形目的黄鲈同源性最高, 为 93%; 与鲈形目的金头鲷、鲑形目的大西洋鲑、鲤形目的斑马鱼、鲽形目的牙鲆也都有较高的同源性, 分别为 91%、83%、82%和80%; 与非洲爪蟾的同源性为80%; 与人、黑猩猩、牛及小鼠的同源性分别为79%、79%、78%和77%。用 http://www.expasy.ch/prosite/分析 BHMT配体结合位点, 发现三个(210、292、293)可以与Zn2+结合的半胱氨酸残基位点, 将鲈鱼BHMT的氨基酸序列与人、小鼠和黄鲈氨基酸序列比对分析发现这三个半胱氨酸残基位点对应于人和小鼠的第 217、299和300位(图2)。
用软件 MEGA 4中的临位相联法(Neighborjoining, NJ)构建 BHMT氨基酸序列系统进化树(图3), 其结果表明, 整棵树分成两簇:哺乳类和两栖类形成一簇, 鱼类独立成簇。鲈鱼与黄鲈、金头鲷有着较近的亲缘关系, 而与西洋鲑、斑马鱼及牙鲆亲缘关系较远, 这与传统分类学上结果相符, 因为鲈鱼、金头鲷、黄鲈同属鲈形目。

图1 鲈鱼BHMT全长cDNA序列及其编码的氨基酸Fig. 1 The full-length cDNA and deduced amino acid sequence of BHMT from Lateolabrax japonicus

图2 人、小鼠、黄鲈和鲈鱼BHMT氨基酸序列比较Fig. 2 The Comparison of BHMT amino acid sequences from Homo sapiens, Mus musculus,Perca flavescens and Lateolabrax japonicus
2.3 鲈鱼BHMT基因的组织表达及盐度对其表达
的影响
用RT-PCR分析BHMT基因在鲈鱼肌肉、心、眼、脑、鳃、肝、肠、肾、脂、脾 10个组织中的表达, 结果只在肝、肠和肾有610 bp的目的条带出现, 且在肝和肾的表达量明显高于肠(图4A)。经过29 h的29度高盐度作用和经过29 h的12度低盐度作用, 鲈鱼BHMT基因仍然只在肝、肠和肾三个组织有表达(图4B和4C)。用Gel-Pro Analyzer 4凝胶定量分析软件分析上述RT-PCR电泳图, 结果表明,高盐度组鲈鱼BHMT基因mRNA在肝、肠和肾三个组织的表达低于对照组(盐度 25度), 而低盐度组在肝、肠和肾三个组织的表达高于对照组(图5A)。用定量PCR进一步检测盐度对鲈鱼BHMT基因在肝、肠和肾的表达的影响发现, 和 RT-PCR检测结果一样, 高盐度组鲈鱼肝、肠和肾三个组织BHMT基因的mRNA表达量显著下降, 分别是对照组的 49%(P<0.05)、81% (P<0.05)和 28% (P<0.05)。低盐度组鲈鱼BHMT基因mRNA在肝、肠和肾中的表达量高于对照组, 分别是对照组的 1.38倍(P<0.05)、1.63 倍(P<0.05)、1.91倍(P<0.05), 见图5B。

图3 鲈鱼与其他物种BHMT氨基酸序列进化树Fig. 3 Phylogenetic tree of BHMT amino acid sequence ofLateolabrax japonicus and those of other species

图4 鲈鱼各组织BHMT在盐度刺激后的RT-PCR电泳图谱Fig. 4 The RT-PCR electrophoresis pattern of Lateolabrax japonicus BHMT after salinity challenge
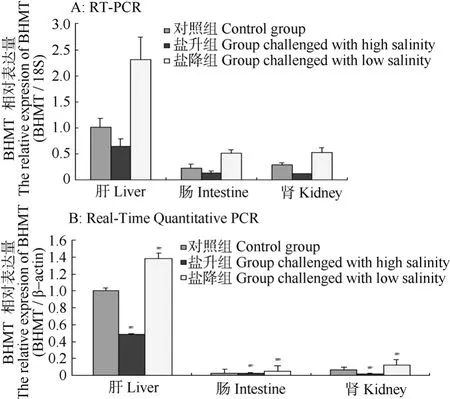
图5 盐度对鲈鱼肝、肠和肾BHMT表达的影响Fig. 5 Effect of salinity on the expression of Lateolabraxjaponicus BHMT in liver, intestine and kidney
2.4 甜菜碱对鲈鱼肝、肠和肾BHMT基因表达的影响
用定量 PCR检测甜菜碱对鲈鱼肝、肠和肾组织BHMT基因的表达, 结果表明,鲈鱼在经过5 h的甜菜碱作用后, BHMT基因在肝、肠和肾组织中的表达量均有增加, 分别是对照组的 2.13倍(P<0.05)、4.18倍(P<0.05)和9.59 倍(P<0.05), 见图6。
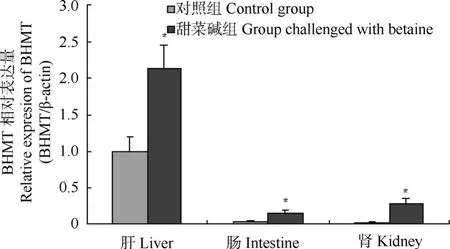
图6 定量PCR检测甜菜碱对鲈鱼肝、肠和肾BHMT表达的影响Fig. 6 Effect of betaine on the expression of Lateolabrax japonicus BHMT in liver, intestine and kidney by Real-time quantitative PCR analysis
3 讨 论
BHMT是一个由6个相同的亚基组成的甲基转移酶, 位于胞浆中, 催化胆碱氧化途径中甜菜碱的甲基转移反应, 使高半胱氨酸甲基化生成蛋氨酸。和另一个催化 N5-甲基四氢叶酸的甲基转移使高半胱氨酸甲基化生成蛋氨酸的MS一样, BHMT也具有 Zn2+依赖的硫醇和硒醇甲基转移酶家族的结构特征(Breksa & Garrow, 1999), 即具有G(ILV)NCX结构的基序 A和具有(ALV)X(2)(LV)GGCCX(3)PX(2)I结构的基序 B(Millian & Garrow, 1998;González et al, 2004)。人BHMT的基序A和B分别是GVNCH218和VRYIGGCCGFEPYHI307(Breksa &Garrow, 2002)。研究表明, 人BHMT这两个结构基序中的三个半胱氨酸(217、299和300)与Zn2+结合后才激活高半胱氨酸, 但如果将其中的任何一个半胱氨酸进行突变,BHMT都将无法与Zn2+结合而失去催化功能(Pajares & Perez-Sala, 2006)。对鲈鱼BHMT基因cDNA序列分析表明, 鲈鱼BHMT由401个氨基酸组成, 其基序A与人BHMT基序A一样, 为GVNCH211, 基序B为IRYIGGCCGFEPYHI300,三个半胱氨酸分别位于 210、292和 293, 与人BHMT的同源性也达到79%, 推测我们克隆的鲈鱼BHMT是具有催化功能的酶。
BHMT在哺乳动物各组织中有广泛的表达(Waditee & Incharoensakdi, 2001; Mckeever et al,1991), 主要集中在肝和肾, 在肝中的表达, 甚至占全部蛋白质的 0.6%~1.6%(Yamashita et al, 2000;Mckeever et al, 1991)。但BHMT的表达特征也因生物物种而异, 如人、猪和大鼠在肾中的表达量就较低(Yamashita et al, 2000), 而羊的胰腺、猕猴的晶状体中 BHMT均有很高的表达量(Mckeever et al,1991)。鲈鱼BHMT的表达模式与哺乳动物基本一致, 我们用 RT-PCR检测鲈鱼的肌、心、眼、脑、鳃、肝、肠、肾、脂、脾10个组织, BHMT只在肝、肠和肾有较高的表达。
Craig(2004)研究表明, 机体对BHMT的调控主要发生在转录水平, 食物是引起其表达变化的最主要因素之一。当喂以蛋氨酸缺乏的食物时, 大鼠肝脏的BHMT mRNA含量和酶活性均有提高(Park &Garrow, 1999)。蛋氨酸含量受到限制时, 食物中增加甜菜碱和胆碱等甲基供体能更大程度地诱导BHMT的表达(Martin & Finkelstein, 1981), 并且这些甲基供体的吸收量和 BHMT的表达量之间存在剂量相关性(Junnila, 2000), 同样在鸡饵料中加入甜菜碱后,BHMT的活性可增加(Craig, 2004)。BHMT是催化分解甜菜碱的, 因而当体内甜菜碱含量升高后刺激 BHMT基因的表达量增加(Balinska &Paszewski, 1979)。由于BHMT的启动子上有许多激素的调控元件, 所以激素的刺激也能引起BHMT表达的变化, 氢化可的松、皮质醇和曲安西龙都能增加BHMT的活性和mRNA水平, 而生长激素只能诱导 BHMT mRNA转录(Pajares & Perez-Sala,2006)。在不受激素影响的HepG2细胞系中用荧光素酶报告基因系统研究发现, 甜菜碱和含硫氨基酸的浓度能改变BHMT启动子活性, 但是它们是如何启动BHMT基因转录的分子机制尚不清楚(Lu et al,2010)。在本实验中, 鲈鱼腹腔注射甜菜碱后, 肝、肠和肾BHMT基因的表达量都有所上升, 表明鱼类跟其他脊椎动物一样, 甜菜碱能改变 BHMT的表达。
另一个引起 BHMT表达变化的因素是环境渗透压。猪在吸收高 NaCl后, 其肝脏、肾脏 BHMT表达降低(Sunden et al, 1997), 体外实验也证实,BHMT在渗透压调节中起重要作用(García-Pérez &Burg, 1991), H4IIE细胞在高渗时, BHMT表达减少,而在低渗时增加, 酪氨酸激酶或环嘌呤核苷酸依赖的激酶会损害 BHMT对渗透压的敏感性(Junnila,2002)。在鱼类中也发现环境渗透压能改变 BHMT的表达, 如香鱼(Plecoglossus altivelis)从淡水转到海水时, 鳃中BHMT蛋白和mRNA表达均有下调(Lu et al, 2010), 本实验结果表明, 将鲈鱼从盐度为25的海水转入盐度为 29的海水后, 肝、肠和肾BHMT基因表达量显著下降; 而转入低盐(12度)后,肝、肠和肾的表达量都有显著上升, 从而提高甜菜碱的分解代谢, 降低细胞内甜菜碱的浓度利于适应低渗环境, 显示BHMT基因在调节鲈鱼渗透压的过程中发挥着重要的作用, 但是鱼类BHMT的调节机制是否与哺乳动物一样有相同的激酶途径参与还有待于进一步研究。
Balinska M, Paszewski A. 1979. Betaine-homocysteine methyltransferase in the fungusAspergillus nidulans[J].Biochem Biophys Res Commun, 91:1095-1100.
Breksa AP, Garrow TA. 1999. Recombinant human liver betaine homocysteine S-methyltran sferase: identification of three cysteine residues critical for zinc binding [J].Biochemistry, 38: 13991-13998.
Breksa AP, Garrow TA. 2002. Random mutagenesis of the zinc-binding motif of betaine- homocysteine methyltransferase reveals that Gly 214 is essential [J].Arch Biochem Biophys, 399: 73-80.
Craig SA. 2004. Betaine in human nutrition[J].Am J Clin Nutr, 80:539-546.Fisher MC, Zeisel SH, Mar MH, Sadler TW. 2002. Perturbations in choline metabolism cause neural tube defects in mouse embryosin vitro[J].FASEB J, 16: 619-621.
García-Pérez A, Burg MB. 1991. Renal medullary organic osmolytes [J].Physiol Rev, 71: 1081-1115.
González B, Pajares MA, Martínez-Ripoll M, Blundell TL, Sanz-Aparicio J.2004. Crystal structure of rat liver betaine homocysteine s-methyltransferase reveals new oligomerization features and conformational changes upon substrate binding [J].Mol Biol, 338: 771-782.
Junnila M. 2000. Betaine as a lipotropic agent and as an alleviator of osmotic stress[D]. Ph.D. thesis, University of Helsinki.
Lu XJ, Chen J, Huang ZA, Shi YH, Wang F. 2010. Proteomic analysis on the alteration of protein expression in gills of ayu (Plecoglossus altivelis) associated with salinity change [J].Comp Biochem Physiol:Part D, 5: 185-189.
Martin JJ, Finkelstein JD. 1981. Enzymatic determination of betaine in rat tissues[J].Anal Biochem, 111: 72-76.
McKeever MP, Weir DG, Molloy A, Scott JM. 1991. Betaine-homocysteine methyltransferase: organ distribution in man, pig and rat and subcellular distribution in the rat[J].Clin Sci, 81: 551-556.
Millian NS, Garrow TA. 1998. Human betaine-homocysteine methyltransferase is a zinc metalloenzyme[J].Arch Biochem Biophys, 356: 93-98.
Neece DJ, Griffiths MA, Garrow TA. 2000. Isolation and characterization of a mouse betaine-homocysteine S-methyltransferase gene and pseudogene[J].Gene, 250: 31-40.
Park EI, Garrow TA. 1999. Interaction between dietary methionine and methyl donor intake on rat liver betaine homocysteine methyltransferase gene expression and organization of the human gene[J].Biol Chem,274: 7816-7824.
Pajares MA, Perez-Sala D. 2006. Betaine homocysteine S-methyltransferase:just a regulator of homocysteine metabolism?[J].Cell Mol life Sci, 63:2792-2803.
Polat A, Beklevik G. 1998. The Importance of Betaine and Some Attractive Substances as Fish Feed Additives [M]//Brufau J, Tacon A. Feed Manufacturing in the Mediterranean Region: Recent Advances in Research and Technology. Spain: CIHEAM, 217-220.
Sandra G, Heil, Karin JA, Lievers, Godfried H, Boers, Petra Verhoef, Martin den Heijer Frans JM, Trijbels, Henk JB.2000. Betaine-homocysteine methyltransferase (BHMT): Genomic sequencing and relevance to hyperhomocys teinemia and vascular disease in humans [J].Mol Genet Metab, 71: 511-519.
Schäfer C, Hoffmann L, Heldt K, Lornejad-Schäfer MR, Brauers G,Gehrmann T, Garrow TA, Häussinger D, Mayatepek E, Schwahn BC,Schliess F. 2007. Osmotic regulation of betaine homocysteine S-methyltransferase expression in H4IIE rat hepatoma cells [J].Am J Physiol Gastrointest Liver Physiol, 292: 1089-1098.
Sunden SL, Renduchintala MS, Park EI, Miklasz SD, Garrow TA. 1997.Betaine-homocysteine methyltransferase expression in porcine and human tissues and chromosomal localization of the human gene[J].Arch Biochem Biophys, 345: 171-174.
Waditee R, Incharoensakdi A. 2001. Purification and kinetic properties of betaine-homocyst eine methyltransferase fromAphanothece halophytica[J].Curr Microbiol, 43: 107-111.
Wettstein M, Weik C, Holneicher C, Hussinger D. 1998. Betaine as an osmolyte in rat liver: metabolism and cell-to-cell interactions[J].J Hepatology, 27: 787-793.
Yamashita T, Hashimoto S, Kaneko S, Nagai S, Toyoda N, Suzuki T, Kobayashi K, Matsushima K. 2000. Comprehesive gene expression profile of a normal human live [J].Biochem Biophys Res Commun, 269: 110-116.
Effects of salinity and betaine on BHMT mRNA expression inLateolabrax japonicus
QIAN Yun-Xia*, SONG Juan-Juan
(Faculty of Life Science and Biotechnology,Ningbo University,Ningbo315211,China)
Betaine homocysteine methyltransferase (BHMT, EC 2.1.1.5) catalyzes the transfer of a methyl group from betaine to homocysteines (Hcy) to form dimethylglycine and Met, respectively. A full-length cDNA of the BHMT inLateolabrax japonicuswas amplified using RT-PCR and SMART RACE methods. The cDNA of the BHMT inL.japonicusis 1 461 bp in size, with 72 bp 5'-UTR, 183 bp 3'-UTR and 1206 bp ORF, encoding a protein of 401 amino acids with a molecular weight of 44.32 kD and pI 7.21. The sequence analysis indicated that the deduced amino acid sequence of BHMT shared high identity (77% – 93%) with nine other species; the highest was 93% withPerca flavescens. Semi-quantitative RT-PCR was used to characterize the expression of BHMT in ten tissues including muscle,heart, eye, brain, gill, liver, intestine, kidney, adipose tissue and spleen. The results showed that BHMT is only expressed in the liver, intestines and kidney. BHMT mRNA in these three tissues declined after the fish were transferred from sea water to a higher salinity environment and induced when transferred to a lower salinity environment. BHMT gene in liver,intestine and kidney can also be induced after intraperitoneal injection of betaine. Our results show that betaine can induce the transcription of BHMT in fish, and BHMT play pivotal roles in adaptation to osmotic change.
Lateolabrax japonicus; BHMT; Clone; Tissues Expression; Salinity
Q785; Q959.499; Q516
A
0254-5853-(2011)03-0277-08
10.3724/SP.J.1141.2011.03277
2010-08-26;接受日期:2010-11-22
国家自然科学基金(30671608); 浙江省自然科学基金( M303345); 宁波市自然科学基金(2006A610088).∗
Corresponding author),Tel: +86-574-87600169, E-mail: qianyunxia@nbu.edu.cn
钱云霞(1965— ), 女, 副教授, 硕士生导师, 主要从事水产动物生物化学与分子生物学研究

