NH4 Cl过饱和度的测定
赵文武,王 波,唐弘汉
(1.大连化工研究设计院,辽宁 大连 116023;2.大连育明高中,辽宁 大连 116023)
科学试验
NH4Cl过饱和度的测定
赵文武1,王 波1,唐弘汉2
(1.大连化工研究设计院,辽宁 大连 116023;2.大连育明高中,辽宁 大连 116023)
实验采用文献方法[1]—Nyvlt多温法,测量了一定温度下的试剂级NH4Cl和农业NH4Cl的过饱和度数据,比较了有无晶种存在、搅拌强度、降温速度、添加剂等因素对过饱和度的影响。并采用称量法,对30℃氯化铵饱和溶液的密度的文献数据进行了修正。
氯化铵;晶种;过饱和度
我国是氯化铵生产大国,联碱法生产的产品之一是氯化铵,其结晶工艺包括冷析结晶和盐析结晶,其过饱和度数据是结晶器设计的基础数据。在工业生产中,由于种种需要,往往在特定生产单元中加入微量的添加剂,这些杂质的存在对氯化铵的介稳区可能有影响,分析和测试杂质对氯化铵结晶过程影响,有利于了解目前生产中存在的实际问题,为实现结晶器制造粒状产品找到一条合理途径。因此,测量工业结晶条件下不同因素对氯化铵过饱和度的影响是十分必要的。
1 实验部分
1.1 主要实验材料及仪器
试剂NH4Cl(>99.7%,优级纯)
农业NH4Cl(99.2%,大化集团产品)
防结块剂(本院产品)
助滤剂(本院产品)
消泡剂(本院产品)
絮凝剂(本院产品)
二等标准温度计
恒温磁力搅拌器
超级恒温水浴
数显低温浴槽
1.2 实验装置(图1)
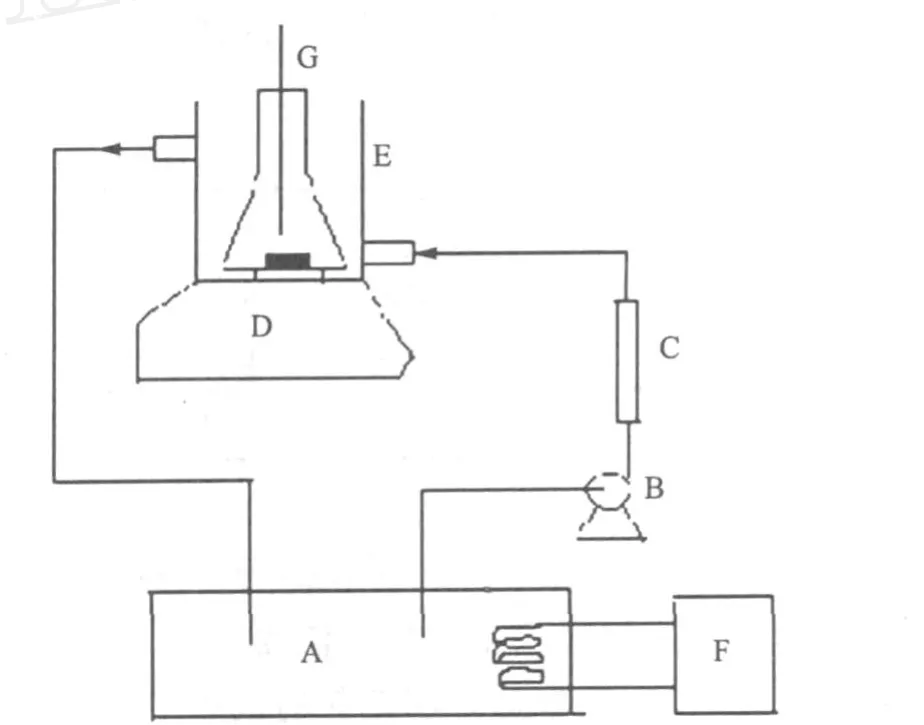
图1 过饱和度测试装置[1]
1.3 实验方法
采用 Nyvlt多温法[2](Polythermal M ethods)测定 NH4Cl的过饱和度:先配制一定温度下NH4Cl的饱和溶液,静置后取清液于50 m l小锥形瓶内,放入过饱和度测试装置,缓慢升温至饱和温度以上5℃左右,稳定30 min后,控制降温,记录温度降到饱和温度时间,和出现第一颗晶核的时间和温度,温度差△T为最大温度过饱和度。
有晶种时的过饱和度的测定,即在温度达到饱和温度时加入两颗晶种(直径2 mm左右),其余步骤同上。
2 实验结果与讨论
选用试剂级NH4Cl和农业NH4Cl进行过饱和度测定,实验结果经过筛选,见表1、表2。
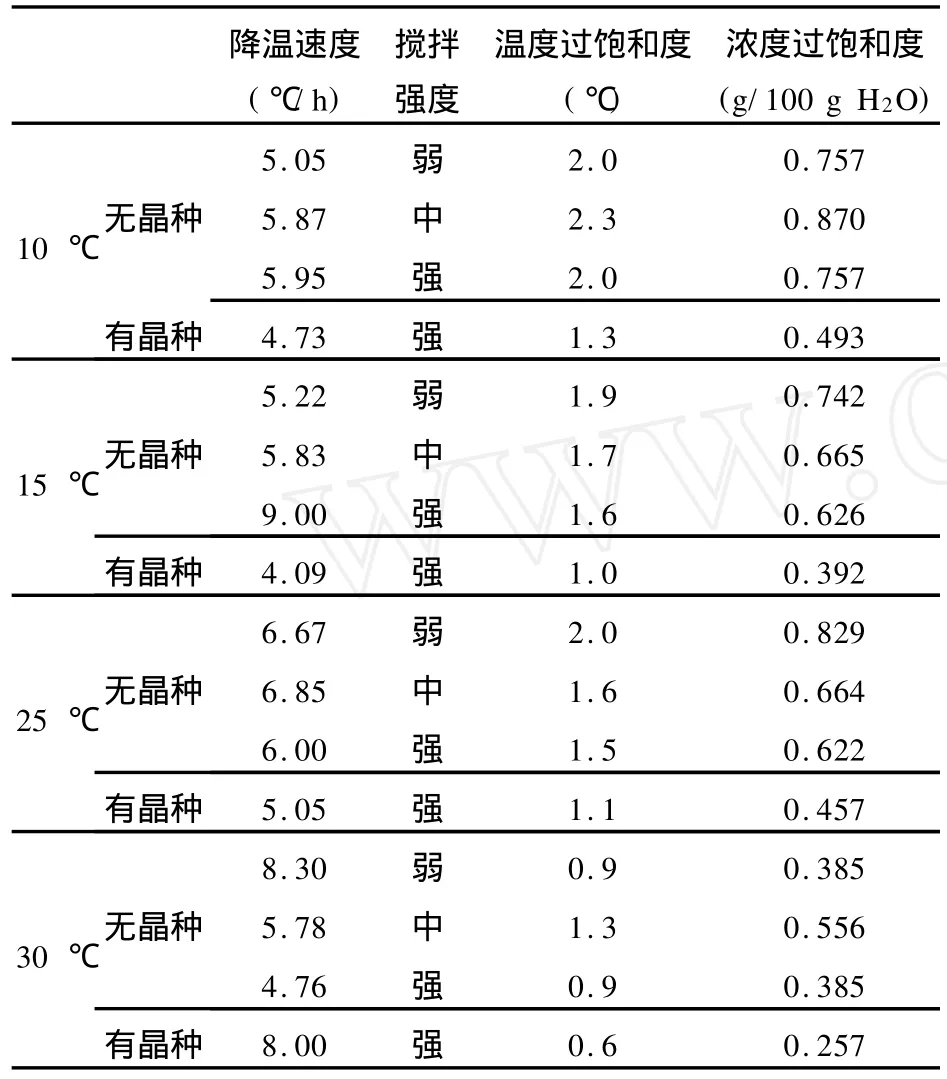
表1 NH4 Cl(试剂)过饱和度数据
2.1 晶种的影响
有晶种存在下,测得的试剂NH4Cl平均过饱和度要明显小于无晶种时的平均过饱和度(见图2),这是因为没有晶种存在的情况下,晶核从溶液中析出,必须有较大的过饱和度,才能保证结晶粒子以足够快的速度成长到临界直径,成为晶核。Nyvlt等人对一次核发生速度进行了一系列的研究后认为,一次核的发生速度是过饱和度的函数:J=knΔCmmax(式中 J——成核速度,ΔCmax——最大过饱和度,kn和m——系数)。过饱和度小的时候,一次核成长得慢,而过饱和度逐渐增大时,一次核成长速度以指数关系急剧增加。
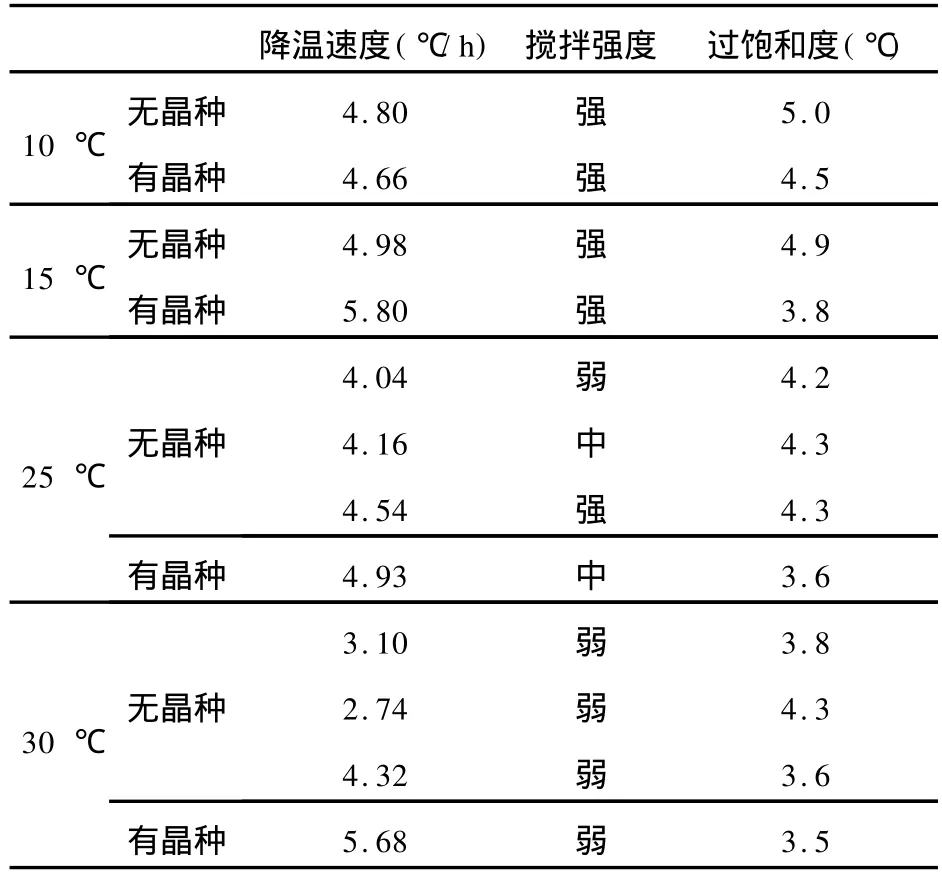
表2 NH4 Cl(农业)过饱和度数据

图2 晶种存在对试剂氯化铵ΔT的影响
在加入晶种的情况下,我们认为是二次成核,其可能的机理是由于流体的剪切、结晶与固体碰撞等因素引起,所以,二次成核的过饱和度要远低于一次成核的过饱和度。
2.2 降温速度的影响
由于本次阶段性试验的降温速度选取在4~10℃/h,没有明显的拉开,所以测得的过饱和度没有太大的变化。
2.3 搅拌强度的影响
搅拌强度对极限过饱和度的影响程度,随实验条件的不同而不同,实验中测得的过饱和度随搅拌强度的增大有减小的趋势。
2.4 微量添加剂的影响
当溶液中有添加物(杂质)时,由于结晶对不同杂质的吸附或掺杂作用而影响结晶晶形和成长速度[2],也影响了溶液的过饱和度。
我们选用纯碱生产中常用的几种添加剂,来测试其在25℃时,对试剂级NH4Cl过饱和度的影响,结果见表3。
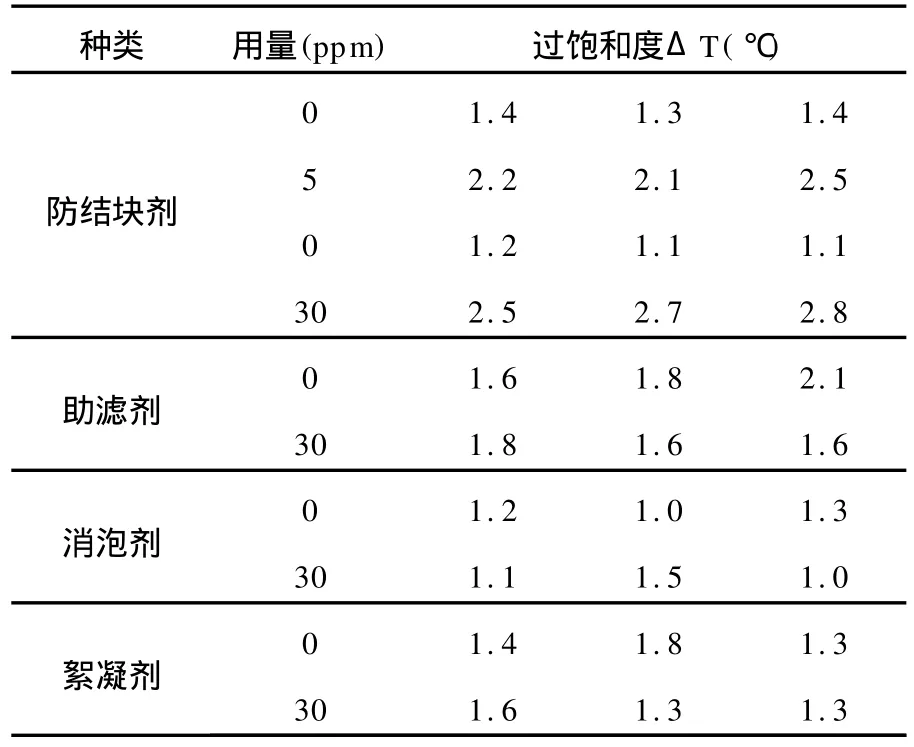
表3 几种添加剂对ΔT影响的实验数据
可以看出,相同实验条件下,试剂级NH4Cl的过饱和度在1~1.8℃范围内波动;添加防结块剂后,过饱和度明显增大到2.0℃以上,且30 ppm用量比5 ppm用量影响稍微大一些;其余3种添加剂30 ppm用量,对NH4Cl的过饱和度影响不明显。
需要注意的是,在添加了防结块剂后虽然过饱和度增大了,但是在介稳区内,并不有利于结晶的成长,相反使结晶成长的速度变慢。根据 J=knΔCmmax方程,ΔC虽然变大了,结晶成长系数kn却因为添加剂的存在而显著变小。实验中可以观测到,试剂级NH4Cl的溶液降温成核呈极为细小的颗粒状,而在微量防结块剂存在下的成核呈大片状,我们认为防结块剂的疏水基团覆盖了立方体晶胚的两侧,导致NH4Cl在一个面上生长,成为片状。
大化集团大连化工股份有限公司生产的农业NH4Cl的过饱和度偏大,就是由于生产流程中,循环母液可能混入了某种添加剂引起,应当引起注意,避免添加剂的存在而增大能耗,影响产量和颗粒的粒度。
2.5 NH4 Cl 30℃的饱和溶液密度的修正
NH4Cl 30℃的饱和溶液密度,现有文献数据为1.069 kg/L,经称量法多次准确测量,数值可修正为1.078 5 kg/L。
2.6 ΔC与ΔT的换算方法
采用溶解度曲线方程y=0.001 2 x2+0.356 7 x +29.544的二阶导数方程 y′=0.002 4 x+0.356 7进行计算,即ΔC=(dc/dT)ΔT=y′ΔT
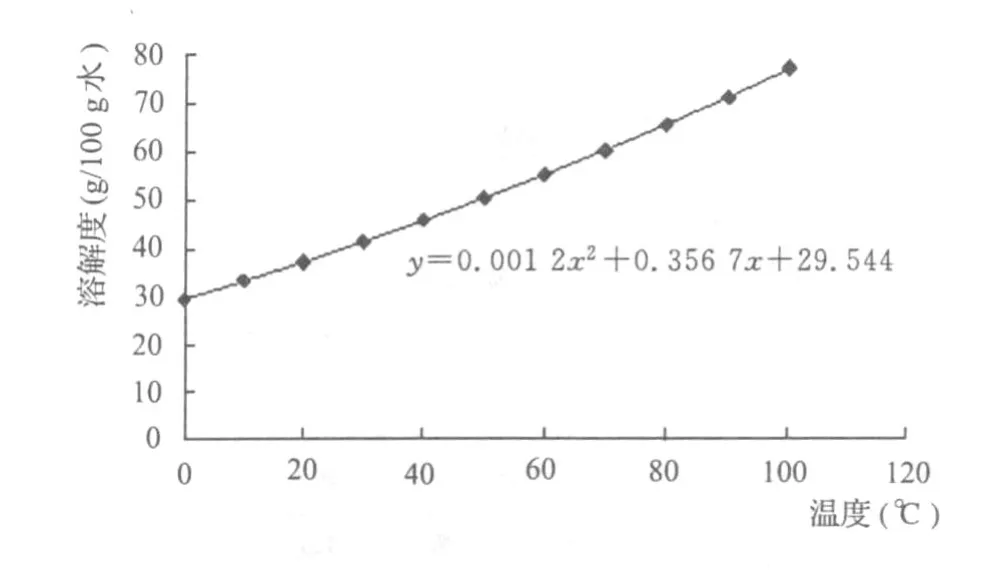
图3 NH4 Cl溶解度曲线
3 结 论
1)实验中使用的装置可以快速准确地测定NH4Cl溶液的过饱和度,经测定,试剂NH4Cl的过饱和度在1.0~1.8℃范围内波动,农业NH4Cl的过饱和度在3.5~5.0℃范围内波动。
2)对比试剂级NH4Cl和农业NH4Cl的过饱和度测定结果和成核现象,可以认为微量杂质对溶液的过饱和度和晶体的晶形及粒度影响非常明显。实验条件下,5 ppm的防结块剂就可使NH4Cl的过饱和度增大1.0~1.5℃,30 ppm的防结块剂可使NH4Cl的过饱和度增大1.2~1.8℃,且成核为白色稀松片状。
[1] M ullin JW.Crystallization,4th_ed[M].London,2001
[2] Nyvlt J,Sohnel O,Matuchova M.The kinetics of industrial crystallization[M].Holland:Elsevier,1985
[3] J.Njrvlt,J.U lrich Admixtures in Crystallization [M].1995
[4] 罗蜀生.工业结晶和结晶装置的设计[J].纯碱工业, 1986,(5)致谢:本试验得到李国强高工的指导和帮助,在此表示衷心的感谢!
TQ 113.7;O 645.5
A
1005-8370(2011)03-08-03
2011-04-22

