CCK-8 对LPS 诱导树突状细胞成熟的影响*
李巧霞, 韩冬艳, 丛 斌△, 单保恩, 张敬各
(1 河北医科大学基础医学院,河北省法医学实验室,河北 石家庄050017;2河北医科大学第四医院科研中心,河北 石家庄050011)
树突状细胞(dendritic cells,DCs)是机体内功能最强大的抗原提呈细胞(antigen-presenting cells,APCs),在启动和调节机体免疫应答过程中发挥极其重要的作用。正常情况下,机体内大多数DCs 以非成熟状态分布于外周组织和器官中,它们具有强大的抗原摄取能力,表达低水平主要组织相容性复合物II(major histocompability complex II,MHC II)分子和协同刺激分子,诱导T 细胞的能力较弱。一旦摄取抗原或接受某些因素刺激,DCs 逐渐发育成熟,细胞表面MHC 分子和协同刺激分子表达增高,通过向T 细胞提呈抗原、提供协同刺激信号和建立细胞因子微环境来激活初始T 细胞并诱导其向具有不同功能的亚群分化[1]。因此,DCs 的成熟状态直接影响到T细胞介导的适应性免疫应答的性状。
八肽胆囊收缩素(cholecystokinin octapeptide,CCK-8)是一种典型的脑肠肽,通过细胞表面的CCK 受体(CCK-receptor,CCKR)在中枢和外周神经系统发挥多种调节功能。我们先前的系列研究表明CCK-8 能 够 抑 制 脂 多 糖(lipopolysaccharide,LPS)诱导的巨噬细胞分泌促炎细胞因子和趋化因子,促进抗炎细胞因子白细胞介素10(interleukin-10,IL-10)的分泌;并能抑制活化的巨噬细胞表面分化群80(cluster of differentiation 80,CD80)和分化群86(cluster of differentiation 86,CD86)的表达,降低其抗原提呈时的协同刺激功能[2]。此外,CCK-8能够调节LPS 诱导的B 细胞表面协同刺激分子表达和细胞因子分泌[3]。我们的最新研究表明,DCs 表面也表达CCKR,但CCK-8 对DCs 是否具有调节作用目前尚无报道。因此,本研究拟观察CCK-8 对LPS 诱导DCs 成熟过程中细胞表型和功能改变的影响,以期进一步揭示CCK-8 的免疫调节作用。
材 料 和 方 法
1 主要试剂
CCK-8、LPS 和FITC dextran 购自Sigma;重组鼠粒- 巨噬细胞集落刺激因子(recombinant mouse GM-CSF)购 自RD;mouse CD11c (N418)MicroBeads、mouse CD4(L3T4)MicroBeads 和MS 分选柱购自Miltenyi Biotec;FITC anti-mouse CD80、PE anti-mouse CD86 和PE anti-mouse MHC class II 购自BioLegend;小鼠白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumour necrosis factor α,TNF-α)ELISA kit 购自北京晶美生物公司;其它试剂为国产分析纯。
2 动物
健康无热原C57BL/6 和BALB/c 小鼠,8 ~10 周龄,由河北医科大学实验动物中心提供,恒温(23 ±2)℃,湿度45% ~65%,每天光照12 h。常规高压灭菌饮食。实验动物质量合格证为704186。
3 小鼠骨髓来源DCs 的培养和纯化
DCs 的培养参考Inaba 等[4]的方法,略作修改。无菌取C57BL/6 小鼠股骨和胫骨骨髓,制备单细胞悬液,裂解红细胞,PBS 洗涤2 次后,用含15 μg/L GM-CSF 的RPMI-1640 完全培养液重悬细胞,接种于6 孔板,密度为(1 ~2)× 109cells/L、3 ~4 mL/well。第3 d,轻轻吸弃未贴壁细胞全量换液。第5 d,吸弃半量培养液,并补充该量。第6、7 d,收集悬浮和半贴壁细胞,加入mouse CD11c(N418)Micro Beads,采用Mini MACS 免疫磁珠分离系统分离纯化DCs。
4 流式细胞分析检测DCs 表型
收集纯化DCs,调整细胞浓度为1 ×109cells/L,接种于24 孔板1 mL/well,分别进行以下分组处理:对照组(补加与实验组等体积的细胞培养液);LPS组(加入LPS 终浓度为1 mg/L);LPS + CCK-8 组(加入LPS 终浓度为1 mg/L,再加入不同浓度的CCK-8 终浓度分别为10-6、10-8、10-10mol/L)。37℃、5%CO2孵育24 h,收集细胞,用PBS 洗1 次,分别加入FITC-抗CD80、PE-抗CD86 或PE-抗MHC II 抗体,4 ℃、避光孵育30 min,生理盐水洗2次,流式细胞仪检测。每次实验用同型抗体作为对照。用平均荧光强度(mean channel fluorescence,MCF)表示CD80、CD86 和MHC II 蛋白表达量。
5 流式细胞分析检测DCs 吞噬功能
纯化DCs 按上述不同因素处理孵育24 h,收集细胞加入1 g/L FITC-dextran(40 kD)于37 ℃继续孵育1 h,用PBS 洗2 次后,用流式细胞仪检测FITC阳性细胞率。
6 ELISA 法检测DCs 细胞因子表达
纯化DCs 按上述不同因素处理24 h 后,收集培养上清,采用ELISA 试剂盒检测小鼠IL-1β、IL-6和TNF-α 的含量。操作流程如下:采用倍比稀释法获得IL-1β、IL-6 和TNF-α 标准品。检测板中每孔加入标准品或待测培养上清100 μL,37 ℃孵育90 min;PBS 洗板4 次;每孔加100 μL 生物素化抗体工作液,37 ℃孵育60 min;PBS 洗板4 次;每孔加入酶结合物工作液100 μL,37 ℃孵育30 min;PBS 洗板4 次;每孔加入100 μL 显色液,37℃避光孵育10-15 min;每孔加入100 μL 终止液混匀后,立即在450 nm 波长处检测A 值。用标准品绘制标准曲线计算IL-1β、IL-6 和TNF-α 的含量。
7 MTT 法检测T 细胞增殖反应
无菌取BALB/c 小鼠脾脏,制备单细胞悬液,裂解红细胞后加入CD4(L3T4)MicroBeads,采用Mini MACS 免疫磁珠分离系统分离纯化CD4+T 细胞,调整细胞浓度为1 ×109cells/L,以2 ×105cells/well CD4+T 细胞与上述不同因素处理的DCs 2 × 104cells/well(即CD4+T 细胞与DCs 比例为10∶1)共同接种于96 孔板中,每组设5 个复孔,37 ℃、5%CO2培养72 h,每孔加入MTT 20 μL(5 g/L),继续培养4 h,弃上清,加入DMSO 150 μL/well,37 ℃振荡10 min,采用酶联免疫检测仪测定570 nm 波长光吸收A值。
8 统计学处理
采用SPSS 11.5 分析软件进行统计学分析。数据以均数±标准差(±s)表示。各组间均数比较行单因素方差分析(ANOVA),方差齐时用最小显著差法(least significant difference,LSD),方差不齐时用Dunnett T3 法作两两比较。
结 果
1 CCK-8 抑制LPS 诱导DCs 表面CD80、CD86和MHC II 表达
纯化DCs 未加任何因素处理时细胞表面CD80、CD86 和MHC II 表达水平较低,LPS 刺激24 h 后,三者表达明显升高(P <0.01);不同浓度CCK-8 与LPS 同时作用DCs 后,细胞表面CD80、CD86 和MHC II 表达明显低于LPS 组(P <0.05,P <0.01),并呈现剂量依赖关系,提示CCK-8 可抑制LPS 诱导的DCs 表型成熟,见图1。
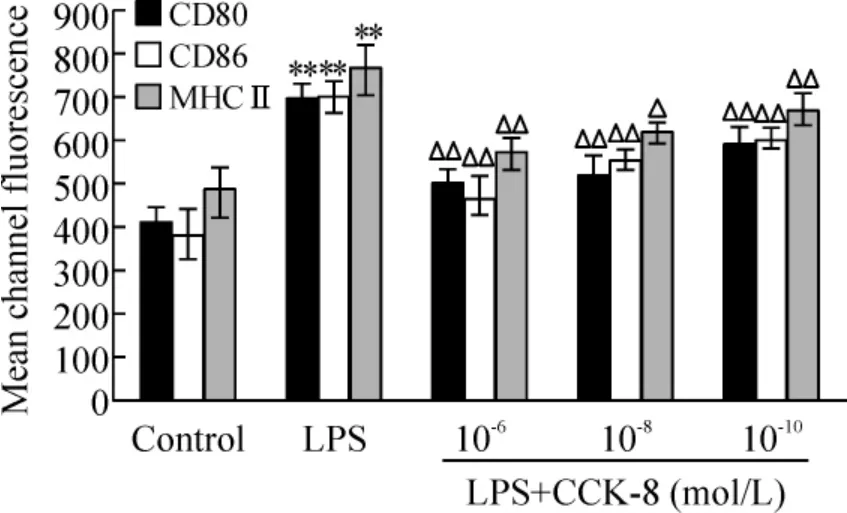
Figure 1. CCK-8 inhibited the expression of CD80,CD86 and MHC II on DCs induced by LPS. ±s. n =3. **P <0.01 vs control group;△P <0.05,△△P <0.01 vs LPS group.图1 CCK-8 抑制LPS 诱导DCs 表面CD80、CD86 和MHC II 表达
2 CCK-8 对LPS 诱导DCs 吞噬功能的影响
分离纯化的DCs 未加任何因素处理时处于未成熟状态,具有较强的吞噬FITC-dextran 的能力,LPS刺激24h 后,DCs 的吞噬功能减弱(P <0.01),不同浓度CCK-8 与LPS 同时作用后,DCs 的吞噬能力较LPS 组明显增强(P <0.01),并呈剂量依赖关系,提示CCK-8 可以抑制LPS 诱导DCs 成熟,提高DCs的抗原摄取能力,见图2。
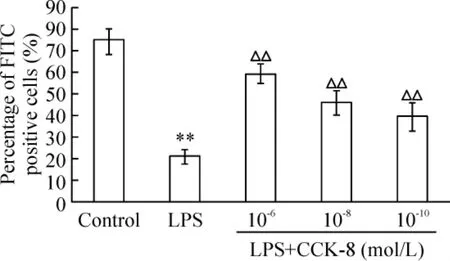
Figure 2. Effect of CCK-8 on FITC-dextran uptake by DCs stimulated by LPS. ±s. n =3. **P <0.01 vs control group;△△P <0.01 vs LPS group.图2 CCK-8 对LPS 诱导DCs 吞噬功能的影响
3 CCK-8 抑制LPS 诱导DCs 分泌细胞因子
纯化未成熟DCs 自发产生TNF-α、IL-6 和IL-1β 的量非常低,低于试剂盒检测的下限。LPS 孵育24 h 后,DCs 培养上清中TNF-α、IL-6 和IL-1β 的含量明显增多(P <0.01);不同浓度CCK-8与LPS 同时作用则显著降低了上述细胞因子的水平(P <0.01),并呈剂量依赖关系,提示CCK-8 可显著抑制LPS 诱导DCs 成熟,抑制其分泌细胞因子TNF-α、IL-6 和IL-1β,见图3。
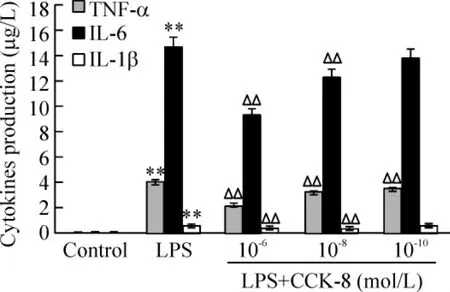
Figure 3. Effect of CCK-8 on cytokine production of DCs induced by LPS. ± s. n = 3. **P <0.01 vs control group;△△P <0.01 vs LPS group.图3 CCK-8 对LPS 诱导DCs 分泌细胞因子的影响
4 CCK-8 处理DCs 对同种异体T 细胞增殖反应的影响
DCs 刺激同种异体小鼠脾T 淋巴细胞增殖反应的程度用A 值表示。未成熟DCs 刺激同种异体T 淋巴细胞增殖反应的能力较弱,经LPS 诱导成熟的DCs 刺激同种异体T 淋巴细胞增殖反应的能力显著增强(P <0.01),CCK-8 与LPS 同时作用DCs 后,与LPS 组相比,DCs 刺激同种异体T 淋巴细胞增殖反应的能力明显减弱,并呈剂量依赖效应(P <0.05,P <0.01),提示CCK-8 可显著抑制LPS 诱导DCs成熟,抑制其对T 淋巴细胞的协同刺激效应和抗原提呈能力,见图4。
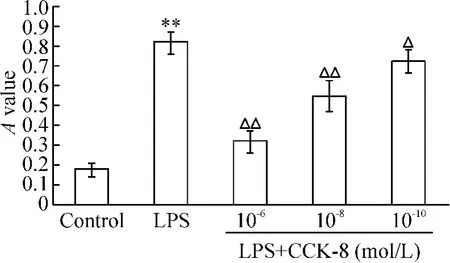
Figure 4. Effect of CCK-8 treatment DCs on proliferation of allogenic T-lymphocytes. ± s. n =5. **P <0.01 vs control group;△P <0.05 ,△△P <0.01 vs LPS group.图4 CCK-8 处理DCs 对同种异体T 淋巴细胞增殖的影响
讨 论
DCs 广泛分布于外周非淋巴组织(如皮肤、胃肠道和呼吸道),参与机体抵抗外界病原体入侵的第一道防线,时刻监视着机体环境中的各种外来因子,是针对包括细菌成分在内的各种病原体引起免疫应答的主要调节者,在启动和调节机体免疫应答过程中发挥极其重要的作用[5,6]。临床上,以DCs 为基础的疫苗在癌症患者中已被用于诱导抗肿瘤免疫反应[7],而在器官移植和自身免疫性疾病中已被用于诱导免疫耐受[8]。因此,决定DCs 诱导免疫反应还是诱导免疫耐受的因素已经成为研究焦点。正常情况下,机体内DCs 以非成熟状态分布于外周组织和器官中,未成熟DCs 具有强大的摄取抗原的能力,它们表达低水平的MHC II 分子和协同刺激分子。已有研究证明这些未成熟的稳定状态的DCs 能够通过诱导调节性T 细胞的产生或去除免疫效应T 细胞的活化来维持免疫耐受[9]。而成熟状态的DCs 丧失了其抗原摄取能力,表达高水平的MHC II 分子和协同刺激分子,通过向T 细胞提呈抗原启动适应性免疫反应[10]。在T 细胞极化的起始阶段,DCs 通过向T细胞提呈抗原、提供协同刺激信号和建立细胞因子微环境来影响T 细胞的增殖和效应功能。因此,DCs依其成熟状态而调控免疫应答,了解调控DCs 成熟与功能状态的因素是防止不必要免疫应答的重要环节。
DCs 的成熟或激活主要通过两条途径[11]:(1)模式识别途径:通过DCs 表面的模式识别受体(pattern recognition receptor,PRR)来识别病原体相关分子模式(pathogen associated molecular pattern,PAMP)而激活;(2)非模式识别途径:通过对机体内环境中自身分子和变化产生反应而激活。DCs 上的PRR 包括:Toll 样受体(Toll-like receptor,TLR)、C 型凝集素受体(C-type lectin receptor,CLR)、双链RNA 依赖的蛋白激酶(dsRNA-dependent protein kinase,PKR)等。LPS 是革兰氏阴性菌的细胞壁成分。已有研究证明,LPS 主要通过识别DCs 表面的TLR4 而激活DCs[12],是体外实验用于激活DCs 的主要途径。
本文研究结果表明,1 mg/L LPS 孵育DCs 24 h后,可诱导细胞表面MHC II、CD80、CD86 表达显著增加,并且把LPS 诱导的DCs 作为APC 与同种异体CD4+T 细胞共培养,可显著提高CD4+T 细胞的增殖能力。表明LPS 可促进DCs 的表型和功能成熟,增强DCs 的协同刺激功能和抗原提呈能力,这些结果与文献[13]报道一致:提示机体在细菌感染等因素作用下,树突细胞的协同刺激活性及抗原呈递能力增强,因此可能成为一些自身免疫性疾病如类风湿关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)的诱发因素。当在LPS 刺激DCs 的同时加入CCK-8 共同作用,CCK-8 可以剂量依赖性地下调LPS 诱导树突细胞表面MHC II 和CD80、CD86 的表达,这与CCK-8 对巨噬细胞的调节作用相似[14];且CCK-8 和LPS 共同孵育的DCs 作为APC 刺激同种异体CD4+T 细胞的增殖能力明显下降,提示CCK-8 对LPS 诱导DCs成熟过程中的细胞表型和抗原提呈功能有抑制作用。此外,经LPS 刺激后,DCs 大量分泌细胞因子IL-1β、IL-6 和TNF-α,这些细胞因子可以使DCs进一步活化,二者形成正反馈;并且,这些细胞因子可以诱导单核/巨噬细胞、T 细胞等的募集,从而导致局部炎症反应的发生和加重。CCK-8 与LPS 同时作用DCs 后,可显著抑制IL-1β、IL-6 和TNF-α的产生,这将有利于减缓炎症反应的发生和发展。目前有研究表明,血管活性肠肽和垂体苷腺酸环化酶激活肽通过下调LPS 活化的树突细胞协同刺激活性和抗原呈递能力,从而缓解了胶原诱导性关节炎的发生发展[15]。结合本文实验结果,提示CCK-8可能通过对LPS 诱导DCs 成熟过程中细胞表型和功能的影响进而在抗感染和相关炎症性疾病中发挥作用。
[1] Delgado M,Reduta A,Sharma V,et al. VIP/PACAP oppositely affects immature and mature dendrtic cell expression of CD80/CD86 and the stimulatory activity for CD4+T cells[J]. J Leukoc Biol,2004,75(6):1122-1130.
[2] 张风华,李淑瑾,丛 斌,等.CCK-8 对LPS 作用下巨噬细胞B7.1 和B7.2 表达及其协同刺激功能的影响[J].中国药理学通报,2007,23(10):1271-1275.
[3] Zhang JG,Cong B,Li QX,et al. Cholecystokinin octapeptide regulates lipopolysaccharide-activated B cells costimulatory molecule expression and cytokines production in vitro[J]. Immunopharmacol Immunotoxicol,2011,33(1):157-163.
[4] Inaba K,Inaba M,Romani N,et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colonystimulating factor[J]. J Exp Med,1992,176(6):1693-1702.
[5] Rescigno M,Borrow P. The host-pathogen interaction:new themes from dendritic cell biology[J]. Cell,2001,106(3):267-270.
[6] Lanzavecchia A,Sallusto F. Regulation of T cell immunity by dendritic cells[J]. Cells,2001,106(3):263-266.
[7] Cerundolo V,Hermans IF,Salio M. Dendritic cells:a journey from laboratory to clinic[J]. Nat Immunol,2004,5(1):7-10.
[8] Morel PA,Feili-Hariri M,Coates PT,et al. Dendritic cells,T cell tolerance and therapy of adverse immune reactions[J]. Clin Exp Immunol,2003,133(1):1-10.
[9] Hawiger D,Inaba K,Dorsett Y,et al. Dendritic cells induce peripheral T cell unresponsiveness under steady state conditions in vivo[J]. J Exp Med,2001,194(6):769-779.
[10] Banchereau J,Steinman RM. Dendritic cells and the control of immunity[J]. Nature,1998,392(6673):245-252.
[11] 徐 姗,姚咏明,盛志勇. 树突状细胞免疫调节作用及其信号转导机制[J]. 生理科学进展,2006,37(4):313-318.
[12] Xie J,Qian J,Wang S,et al. Novel and detrimental effects of lipopolysaccharide on in vitro generation of immature dendritic cells:involvement of mitogen-activated protein kinase p38[J]. J Immunol,2003,171(9):4792-4800.
[13] De Smedt T,Pajak B,Muraille E,et al. Regulation of dendritic cell numbers and maturation by lipopolysaccharide in vivo[J]. J Exp Med,1996,184(4):1413-1424.
[14] 张风华,李淑瑾,丛 斌,等. CCK-8 上调小鼠腹腔巨噬细胞B7.1 和B7.2 表达并增强其协同刺激活性[J]. 中国病理生理杂志,2007,23(4):776-779.
[15] Chorny A,Gonzalez-Rey E,Fernandez-Martin A,et al. Vasoactive intestinal peptide induces regulatory dendritic cells with therapeutic effects on autoimmune disorders[J]. Proc Natl Acad Sci USA,2005,102(38):13562-13567.

