三种土壤中土霉素浸提方法的比较研究
余 强,鲍艳宇,李艳梅,周启星,2*,刘雨霞 (.南开大学环境科学与工程学院,教育部环境污染过程与基准重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 30007;2.中国科学院沈阳应用生态研究所,中国科学院陆地生态过程重点实验室,辽宁 沈阳 006)
三种土壤中土霉素浸提方法的比较研究
余 强1,鲍艳宇1,李艳梅1,周启星1,2*,刘雨霞1(1.南开大学环境科学与工程学院,教育部环境污染过程与基准重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071;2.中国科学院沈阳应用生态研究所,中国科学院陆地生态过程重点实验室,辽宁 沈阳 110016)
以棕壤、褐土和红壤为研究对象,比较了不同浸提方法,不同浸提剂对土壤中土霉素的浸提效率.结果表明,在所用的3种方法中,采用振荡浸提方法,以及 Na2EDTA-McIlvaine缓冲液对土霉素具有稳定、高效的浸提回收率.土霉素形态初步分析连续浸提步骤为:以 H2O、0.1mol/L CaCl2、和Na2EDTA-McIlvaine缓冲液为浸提剂依次浸提可分别得到水溶态、可交换态、吸附态和固定态土霉素.3种土壤中土霉素形态呈现吸附态>可交换态>水溶态的规律.
土霉素;浸提方法;土壤;化学形态
作为广谱类抗生素中重要的一员,土霉素被广泛应用于畜禽养殖业中,往往会通过畜禽粪便、污水排放等方式进入到土壤环境中[1-4].在我国水产养殖场沉积物中检出了土霉素浓度高达285mg/kg的[5],可见土霉素在土壤中的污染比较严重.
土壤中的有机污染物以不同的形态存在,如水溶态、结合态和固定态,其中水溶态的有效性最高,其次是吸附态,而固定态较低.由于固定态有机污染物能够长期存在于土壤中[6],在适当的外界条件下可以被重新释放进入土壤溶液而被生物利用,也可以直接以土壤颗粒吸附态通过扩散作用进入生物膜而被生物体利用,其生物有效性具有长效性.因此研究土壤中土霉素的不同形态对预测土霉素的潜在危害性以及对生态环境的危害程度具有预示作用.目前有关土霉素的研究主要集中在其环境行为方面[7-11],因此,开展土霉素形态分析将为深入探讨其生物有效性奠定基础.对于土壤中土霉素的浸提一直受到研究者们的关注[11-14],其关键在于浸提剂的选择,本研究以棕壤、褐土和红壤为对象,参考目前常用的浸提剂,并利用不同的浸提方法对土霉素的浸提以及形态分析进行了研究.
1 材料与方法
1.1 供试土壤
本试验土样有棕壤、褐土和红壤,分别采自辽宁省沈阳市天柱山(41°49′58″ N, 123°35′8″E)、天津开发区森林公园(39°4′45″ N, 117°41′5″ E)和广西自治区桂林市郊区(25°18′11″N, 110°21′15″ E).采用对角线布点采样法取表层(0~20cm)土,混合均匀后采用四分法分取约 2kg土壤带回实验室.采样过程均使用木质工具,样品用塑料袋盛装.土样经自然风干、压碎、除去异物后,用木棒碾碎,过 1mm(18目)尼龙筛,将过筛后样品充分混匀,保存于聚四氟乙烯袋中备用.3种供试土壤理化性质列于表1.
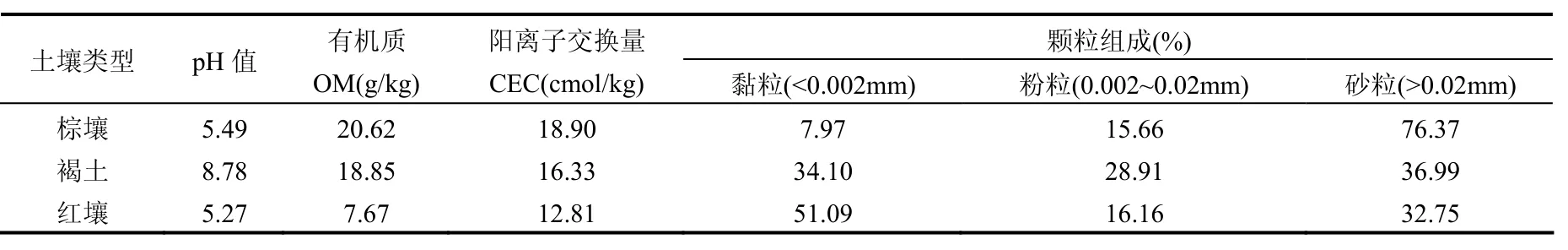
表1 供试土壤基本理化性质(0~20cm)Table 1 Basic physical and chemical properties of the three tested soils(0~20cm)
1.2 药品与试剂
土霉素标准品由中国药品生物检定所提供.土霉素(C22H24N2O9)为分析纯(98%),购自美国sigma公司;乙腈为HPLC级试剂,购自天津康科德科技有限公司,使用前过 0.45µm有机相滤膜后超声脱气;试验用水为纯净水(杭州娃哈哈集团有限公司生产);草酸为优级纯,其他化学试剂均为分析纯.
1.3 浸提液配制
试验用浸提液包括:水、0.01mol/L CaCl2溶液、0.1mol/L CaCl2溶液、柠檬酸缓冲液(pH=4.7±0.05)、0.1mol/L Na2EDTA-McIlvaine (pH=4.0±0.05)、0.5mol/L NaCl/0.25mol/L草酸/95%乙醇(体积比1:1:2)混合液.
柠檬酸缓冲液(pH 4.7)的配制:称取一定量的柠檬酸钠和柠檬酸,分别配制成0.1mol/L的溶液,按照体积比1:1混合,得到柠檬酸缓冲液.
0.1 mol/L Na2EDTA-McIlvaine(pH 4.0±0.05)的配制: 称取一定量的Na2HPO4、Na2EDTA和柠檬酸,分别配制成0.2, 0.4, 0.2mol/L的溶液,柠檬酸溶液与Na2HPO4溶液按照体积比8:5混合,配制成McIlvaine缓冲液.1L McIlvaine缓冲液与Na2EDTA溶液体积比1:1混合,得到0.1mol/L的Na2EDTA-McIlvaine提取液.
1.4 土壤土霉素浸提
往0.5g土壤中添加0.5mL 50mg/L土霉素水溶液,静置24h (据预试验结果得知,24h后3种土壤中土霉素吸附达到平衡),使土壤中土霉素污染含量为 50mg/kg.加入 25mL浸提剂按照以下方法分别进行土壤浸提:
振荡浸提:将装有已添加土霉素土壤的棕色小瓶放置在THZ-82A型(国华企业)恒温振荡机中振荡 20min,振荡机温度和振荡幅度分别为25℃和200r/min.
超声浸提:将装有已添加土霉素土壤的棕色小瓶放置在 KQ-250DE型(昆山舒美)超声器中,超声 20min,超声温度和功率分别为 25℃和100W.
微波浸提:将装有已添加土霉素土壤的聚四氟乙烯微波消解罐放置在 WX-4000(上海屹尧)微波仪中35℃下持续辐射20min,微波辐射功率为100W,从室温20℃升至35℃需要约8min.
浸提完的样品经过 3000r/min离心 15min,取上清液,经0.45µm水系滤膜过滤.取5mL滤液通过固相萃取小柱(Waters Oasis HLB, 10ml甲醇预处理,再通 15mL的超纯水),流速控制在大约3mL/min,然后用 10mL甲醇洗脱样品,最后用氮气浓缩尽干, 2mL甲醇定容,然后用高效液相色谱仪测定,得到土壤中不同形态的土霉素.每个样品浸提处理重复3次,批次实验重复3次.
1.5 测定条件
检测仪器:Waters高效液相色谱仪(HPLC) (Waters 1525 Binary HPLC Pump,Waters 717 plus Auto sampler,Waters 2487 UV Detector),色谱柱为 Waters Xterra MS C18 (5µm×0.46mm× 250mm).进样量为 20µL,柱温 30℃,流速为1mL/min,流动相为乙腈/0.01mol/L草酸(体积比20:80),检测波长 355nm,保留时间为 4.964 min,检测限0.01mg/L,定量限0.05mg/L.
1.6 数据分析
利用SPSS 18.0进行数据统计分析,包括平均值、标准差、回归分析以及方差分析(SNK),统计性显著性假设为 P<0.05.数据图形采用origin 8.0制作.所有化学分子式均由 Chem_ Office 2006绘制.
2 结果与讨论
2.1 分析方法验证
试验采用外标方法绘制标准曲线.称取适量的 OTC标准品溶解在甲醇溶液当中,浓度为 1 mg/mL.配制好的储备液-20℃阴暗处保存,2个月内使用.样品测定前稀释储备液(10,20,50,200, 500,2000,5000,10000ng/mL)绘制标准曲线.向空白样品中加标的方法来计算回收率.参考环境样品中的浓度,回收率的浓度设置为 0.5,1.0, 5.0mg/kg.提取和分析的方法同样品测定步骤,所有需要测定的样品,都在仪器上重复测定3次.分别对标准溶液和加标的空白样品重复测定(n=6)来衡量仪器的精密度和准确度.检测限(LOD)采用信号信噪比为(S/N)=3.定量限(LOQ)采用(S/N)=10.仪器的LOD和LOQ通过直接测定标准溶液获得,分析方法的LOD和LOQ通过空白加标的方法获得.
2.2 土霉素不同浸提方法比较
2.2.1 振荡浸提法 由图1a可见,在土壤中的振荡浸提中,各种浸提剂回收率从大到小的顺序为:0.1mol/L Na2EDTA-McIlvaine缓冲液(EDTA)>柠檬酸缓冲液(CB)>0.1mol/L CaCl2(CaCl2_2)> 0.01mol/L CaCl2(CaCl2_1)>H2O(括号中的均为浸提剂对应的简写标记).而0.5mol/L NaCl:0.25mol/ L草酸: 95%乙醇(体积比1:1:2)混合液(NOEL)在不同土壤中的浸提回收率大小顺序不同.

图1 不同土壤中不同浸提方法下各种浸提剂的土霉素浸提效率Fig.1 Recoveries of oxytetracycline extracted with different extractants and extraction processes in the three tested soil
SPSS 18.0的方差分析结果表明 0.1mol/L CaCl2、柠檬酸缓冲液、Na2EDTA-McIlvaine缓冲液以及0.5mol/L NaCl:0.25mol/L草酸: 95%乙醇混合液浸提效果存有显著差异 (P<0.05).而0.01mol/L CaCl2和H2O二者之间却没有显著差异 (P<0.05).
文献[15-19]报道指出:土霉素上的羟基可与Ca2+、Mg2+等 2价离子进行络合反应,也可与H2O、HCl等这样的分子进行氢键作用.以0.01mol/L CaCl2水溶液为例,它可以和土霉素产生两方面的作用:水和土霉素羟基的氢键作用; Ca2+与土霉素进行的络合反应.而方差分析结果显示,水与0.01mol/L CaCl2的浸提效果并没有显著性差异(P<0.05).因此,可以推断 0.01mol/L CaCl2水溶液浸提土壤中土霉素的机制主要是以水和土霉素氢键作用为主.另外,在参照 OECD Guideline 106批平衡方法[20]进行的土霉素吸附解吸实验中,运用0.01mol/L CaCl2作为土壤pH值的缓冲液并不会对土霉素在土-水界面的环境化学行为产生额外的显著性影响 (P<0.05).同时,数据显示:随着 CaCl2水溶液中 Ca2+浓度的升高,Ca2+与土霉素进行的络合作用逐渐成为二者之间的主要作用机制,而这种络合作用相比氢键作用要强许多,这也是为什么随着CaCl2水溶液中 Ca2+浓度的升高,浸提态土霉素回收率提高的原因.
从化学结构 (图 2)来看,柠檬酸、柠檬酸钠含有易与土霉素酮基、苯环和羟基作用的羟基和酮基基团.这些基团易与土霉素螯合形成大分子的螯合物,不难发现 Na2EDTA有比柠檬酸更多的易被土霉素螯合的基团.方差分析结果表明,柠檬酸缓冲液和0.1mol/L Na2EDTA-McIlvaine缓冲液浸提土壤中土霉素存在显著差异(P<0.05).而且浸提回收效率数据结果显示: 0.1mol/L Na2EDTA-McIlvaine缓冲液相比于柠檬酸缓冲液浸提回收率高出10%左右.
Sassman等[11]曾尝试利用多种由不同浓度和种类的有机助溶剂(乙醇、甲醇、乙酸乙酯、二氧杂环乙烷等)、络合剂(甲酸、柠檬酸、草酸、EDTA以及磷酸等)和盐类(NaCl、CaCl2、NH4Cl)组成的混合物来浸提土壤中的土霉素.其中,由0.5mol/L NaCl:0.25mol/L草酸: 95%乙醇(体积比为 1:1:2)取得了稳定而高效的土霉素浸提回收率.络合剂与土霉素的络合作用(提供酸性环境,利于土霉素稳定的被浸提)、助溶剂对土霉素和土壤有机质的溶解作用以及盐类络合阳离子作用(土壤离子交换,加快土霉素被浸提进程)共同构成了草酸混合液复杂的浸提机制.而从不同浸提方法中各浸提剂的浸提回收率数据来看,草酸乙醇混合液并没有得到稳定的浸提回收效果.致使这种不稳定现象肯定与其复杂的浸提机制有关.这种关联的具体细节尚待进一步的研究.

图2 柠檬酸、柠檬酸钠和Na2EDTA化学结构式Fig.2 Chemical structural formula of citric acid,sodium citrate and Na2EDTA
2.2.2 超声和微波辅助浸提 如图 1b所示,超声浸提中不同浸提剂浸提回收率的大小顺序与振荡浸提完全相同.而在棕壤和红壤的微波浸提中0.5mol/L NaCl:0.25mol/L草酸: 95%乙醇(体积比 1:1:2)混合液(NOEL)的浸提回收率大小顺序与前2种浸提方法不同.3种浸提方法中,除了草酸乙醇混合液以外的其他浸提剂对土霉素浸提回收率大小顺序相同.因此,不同方法对草酸混合液浸提回收率影响较大.这种差异的出现与草酸混合液自身的浸提机制息息相关.从图1看来,微波辐射更有助于草酸混合液充分浸提土壤中的土霉素.
2.2.3 3种浸提方法比较 针对浸提方法进行单因素方差分析,其均值多重比较(SNK多重比较法)结果表明(图 3),在被选用的大多数浸提剂中振荡浸提和超声浸提并不存在显著差异(p>0.05)或差异小.而微波浸提与另外两种浸提方法均存在显著差异(P<0.05).
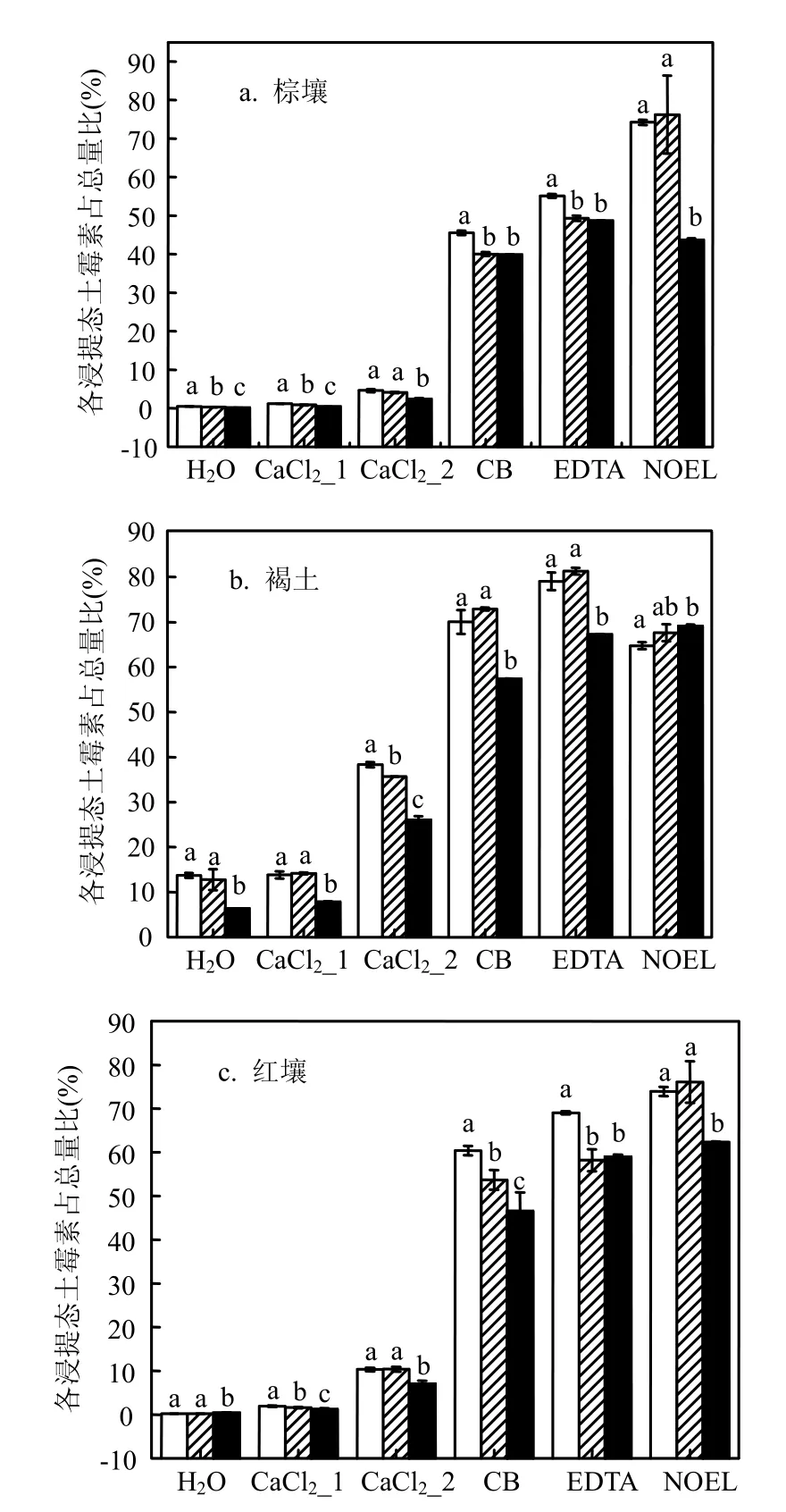
图3 同一浸提剂不同浸提方法土霉素浸提回收率比较Fig.3 Compare of recoveries of oxytetracycline extracted by the same extractant with different extraction processes
振荡和超声浸提主要浸提机制在于通过不同方式使得浸提剂与土壤充分混合,将土壤中土霉素充分浸提出来.而微波的这种混合机制似乎相比前两种要差许多.由于土壤中土霉素的浸提并不需要像提取植物、动物组织的土霉素那样浸提首先得破坏组织结构利于土霉素的析出.因此在生物组织浸提中超声、微波浸提优势会愈加显现出来,而对于土壤介质这种优势并不明显.微波同时也可以借助高温达到较好的浸提效率,这一点在土壤的重金属微波消解中有广泛应用.由于土霉素在高温(>50℃)极易降解,因此也限制了微波的浸提条件.
因此,选择以 0.1mol/L Na2EDTA-McIlvaine缓冲液为浸提剂,超声和振荡为浸提方法,可以达到褐土中稳定高效的土霉素浸提回收率.而对于棕壤和红壤土中的土霉素浸提来说,大多数浸提剂的振荡浸提效果优于超声浸提,并且二者有显著差异(p<0.05);另外振荡浸提法以其对实验设备低要求,简便易行更利于被实践利用.
2.3 土壤环境中土霉素的化学形态分析
有机污染物的不同形态一定程度上指示着其在土壤环境中迁移归趋和各种环境行为[21-22].例如,水溶态土霉素,极易随着水流而迁移,因此也极易达到生物可触及的范围;可交换态土霉素,可被正离子置换下来的部分,易由根系复杂的交换机制而被生物所吸收;吸附态土霉素,则相比前两者可被稳定的吸附于土壤颗粒、有机质等上,但是环境条件诸如pH值、Eh、水分、土壤溶液中污染物浓度、介质性质(如矿物质组成、有机质含量、CEC等)[11,23]的变化都能导致土霉素解吸作用的发生.而固定态土霉素,常常由于土壤老化、降解作用长期存留于土壤中[6],在适当的外界条件下可以被重新释放进入土壤溶液被生物所利用.
根据2.1的结果,以H2O、0.1mol/L CaCl2和Na2EDTA-McIlvaine缓冲液为浸提剂振荡浸提土壤中的土霉素,其浸提率之间存在显著差异性,据此可将土壤中的土霉素分为水溶态、不同程度的结合态(即可交换态和吸附态).由于利用0.01mol/L CaCl2和H2O浸提的土霉素量差异性不大,因此选用 0.1mol/L CaCl2浸提量来表示可交换态土霉素含量.利用差减方法计算不同形态的土霉素,即水溶态、可交换态、吸附态,而添加的土霉素量减去最大提取量即为固定态的土霉素含量.

图4 三种土壤中各浸提态土霉素分布Fig.4 Distribution of Extracted OTC fractions in the three tested soils
振荡浸提结果表明,红壤、棕壤和褐土的水溶态、可交换态、吸附态和固定态的土霉素所占比重分别为 0,0.13,9.24%、6.79,2.60,21.46%、51.40,35.24,49.94%和 41.81,62.03,19.36%.据此,在红壤、棕壤和褐土中土霉素形态百分比大小分别为:吸附态>固定态>可交换态>水溶态、固定态>吸附态>可交换态>水溶态和吸附态>可交换态>固定态 >水溶态.从 3种典型土壤中形态分布数据可以看出吸附态>可交换态>水溶态在三种土壤中均成立.而不同土壤中固定态土霉素含量比差异很大.这应该是与土壤物理化学性质息息相关.吸附态是土壤环境中土霉素的主要存在形态.由于有机污染物的形态直接影响着其生物有效性,因此,高含量的吸附态土霉素成为了影响褐土环境中土霉素生物有效性的重要因素.Young等[24]提出的有机污染物在土壤中吸附分布活性模型中认为,土壤中的吸附活性点位分布在3个域:具有表明活性的矿物质、松散的非刚性有机质和致密的刚性有机质.其中,土壤矿物质域发生的表面吸附是典型的线性可逆过程,瞬间达到平衡;随后有机污染物在土壤的非刚性有机质中发生分配;达到分配扩散后,再向刚性有机质缓慢扩散,分配在其中的有机物则不易脱附.根据这个理论,高含量的吸附态土霉素会随着时间的迁移,逐渐向刚性有机质缓慢扩散,不利于被迅速脱附下来.这是一个慢吸附和慢脱附过程甚至是一个不可逆的吸附过程.因此,高含量的吸附态土霉素有向固定态转化从而长期存留于土壤的巨大生态风险.
3 结论
3.1 三种浸提方法中,以振荡和超声浸提对土壤中土霉素具有很好且稳定的浸提效果,而微波浸提效果较差.各种浸提剂中(柠檬酸缓冲液,Na2EDTA-McIlvaine缓冲液, NaCl、草酸和乙醇混合液),以Na2EDTA-McIlvaine缓冲液对土壤中土霉素的浸提率最高和最稳定.
3.2 不同浸提剂(H2O、0.1M CaCl2、和Na2EDTA-McIlvaine缓冲液)对土壤中土霉素浸提回收率存在很大的差异性,这与它们的提机制不同有关.据此,三种土壤中土霉素形态占总量比例大小顺序:吸附态>可交换态>水溶态.不同土壤中固定态土霉素含量比差异很大.
[1] Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use , sales , exposure pathways , occurrence , fate and effects of veterinary antibiotics (VAs) in the environment [J]. Chemosphere, 2006,65(5):725-759.
[2] Jjemba P K. The potential impact of veterinary and human therapeutic agents in manure and biosolids on plants grown on arable land: a review [J]. Agric. Ecosys. Environ., 2002,93:267-278.
[3] Halling-Sørensen B. Algal toxicity of antibacterial agents used in intensive farming [J]. Chemosphere, 2000,40:731-739.
[4] 徐维海,张 干,邹世春,等.典型抗生素类药物在城市污水处理厂中的含量水平及其行为特征 [J]. 环境科学, 2007,28(8): 1779-1783.
[5] 周启星,罗 义,王美娥.抗生素的环境残留、生态毒性及抗性基因污染 [J]. 生态毒理学报, 2007,2(3):243-251.
[6] Bondi G, Catriona M, Kirk T S, et al. Bioavailability of nonextractable (bound) pesticide residues to earthworms [J]. Environ. Sci. Technol., 2001,35(3):501-507.
[7] Ingerslev F, Torang L, Loke M L, et al. Primary biodegradation of veterinary antibiotics in aerobic and anaerobic surface water simulation systems [J]. Chemosphere, 2001,44(4):865-872.
[8] Tolls J. Sorption of Veterinary Pharmaceuticals in Soils: A Review [J]. Environ. Sci. Technol., 2001,35(17):3397-3406.
[9] Anderson C R, Rupp H S, Wu W H. Complexities in tetracycline analysis—chemistry, matrix extraction, cleanup, and liquid chromatography : A Review [J]. Journal of Chromatography A, 2005,1075:23-32.
[10] 鲍艳宇,周启星,万 莹,等.土壤有机质对土霉素在土壤中吸附-解吸的影响 [J]. 中国环境科学, 2009,29(6):651-655.
[11] Sassman S A, Lee L S. Sorption of three tetracyclines by several soils: assessing the role of pH and cation exchange [J]. Environ. Sci. Technol., 2005,39:7452-7459.
[12] Jacobsen A M, Halling-Sorensen B, Ingerslev F, et al. Simultaneous extraction of tetracycline, macrolide and sulfonamide antibiotics from agricultural soils using pressurised liquid extraction, followed by solid-phase extraction and liquid chromatography–tandem mass spectrometry [J]. Journal of Chromatography A, 2004,1038:157-170.
[13] Blackwell P A, Lutzhoft H C H, Ma H P, et al. Ultrasonic extraction of veterinary antibiotics from soils and pig slurry with SPE clean-up and LC-UV and fluorescence detection [J]. Talanta, 2004,64(4):1058-1064.
[14] Blackwell P A, Lutzhoft H C H, Ma H P, et al. Fast and robust simultaneous determination of three veterinary antibiotics in groundwater and surface water using a tandem solid-phase extraction with high-performance liquid chromatography-UV detection [J]. Journal of Chromatography A, 2004,1045:111-117.
[15] Tongaree S, Flanagan D R, Poust R I. The interaction between oxytetracycline and divalent metal ions in aqueous and mixed solvent systems [J]. Pharm. Dev. Technol.,1999, 4 (4):581-591.
[16] Wessels J M, Ford W E, Szymczak W, et al. The Complexation of Tetracycline and Anhydrotetracycline with Mg2+and Ca2+: A Spectroscopic Study [J]. J. Phys. Chem., 1998,102:9323-9331.
[17] Wan Y, Bao Y Y, Zhou Q X. Simultaneous adsorption and desorption of cadmium and tetracycline on cinnamon soil [J]. Chemosphere, 2010,80:807-812.
[18] Gu C, Karthekiyan K G. Interaction of tetracycline with aluminum and iron hydrous oxides [J]. Environ. Sci. Technol., 2005,39:2660-2667.
[19] Tongaree S, Flanagan D R, Poust R I. The interaction between oxytetracycline and divalent metal ions in aqueous and mixed solvent systems [J]. Pharm. Dev. Technol., 1999,4(4):581-591.
[20] OECD.OECD guidelines for testing of chemicals,test guideline 106:adsorption/desorption using a batch equilibrium method [M]. Revised Draft Document. Paris:OECD., 2000:1-45.
[21] Reid B J, Jones K C, Sempl E K T. Bioavailability of persistent organic pollutant s in soils and sediments perspective on mechanisms , consequences and assessment [J]. Environmental Pollution, 2000,108:103-112.
[22] 周启星.土壤环境污染化学与化学修复研究最新进展 [J]. 环境化学, 2006,25(3):257-265.
[23] Eggleton J, Thomas K V. A review of factors affecting the release and bioavailability of contaminants during sediment disturbance events [J]. Environment International, 2004,30(7):973-980.
[24] Young T M, Weber W J J. A distributed reactivity model for sorption by soils and sediments. 3. Effects of diagenetic processes on sorption energetics [J]. Environ. Sci. Technol., 1995,29(1): 92-97.
Compare of different oxytetracycline extraction methods in the three soils.
YU Qiang1, BAO Yan-yu1, LI Yan-mei1, ZHOU Qi-xing1,2*, LIU Yu-xia1(1.Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071,China;2.Key Laboratory of Terrestrial Ecological Process, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016,China). China Environmental Science, 2011,31(6):951~957
Recoveries of oxytetracycline extracted were discussed with different extractants and extraction processes in the brown, cinnamon, and red soil. Stable and efficient extracted recovery could be achieved by using Na2EDTA-McIlvaine as a extractant in the shake flask extraction. In addition, a sequential extraction procedure was developed to study the chemical speciation of oxytetracycline in the soils. The soils were extracted by H2O, 0.1mol/L CaCl2, and Na2EDTA-McIlvaine in order. As a result, water-soluble, exchangeable, and adsorbed fractions were obtained. Moreover, it could conclude that the orders of amount of those fractions are as follows: adsorbed> exchangeable >water-soluble fractions in the three tested soils.
oxytetracycline;extraction method;soil;chemical speciation
X53
A
1000-6923(2011)06-0951-07
2010-10-03
国家自然科学基金资助项目(40901259)
* 责任作者, 教授, zhouqx523@yahoo.com
余 强(1987-),男,江西九江人,南开大学环境科学与工程学院硕士研究生,主要研究方向为有机污染物化学形态分析.发表论文4篇.

