Nucleostemin和PUMA在骨肉瘤细胞的表达及意义
严 超 王 皓 江红辉 田可可 刘胜洪 谭云宾 王建超*
Nucleostemin和PUMA在骨肉瘤细胞的表达及意义
严 超1王 皓2江红辉1田可可3刘胜洪3谭云宾1王建超1*
(1华中科技大学附属同济医院骨科,武汉430030;2宜昌市中心医院,湖北443000;3华中科技大学同济医学院组织胚胎学教研室,武汉430030)
目的 研究Nucleostemin(NS)和p53上调凋亡调控因子(P53 up-regulated modulator of apoptosis,PUMA)在骨肉瘤中的表达。探讨其表达与骨肉瘤的病理分型,临床外科分期的关系。方法 收集30例骨肉瘤患者手术标本,采用免疫组织化学SABC法检测这组标本中NS和PUMA的表达,应用图像分析系统测量其阳性表达的平均光密度值。结果 1.NS蛋白定位于细胞核,NS在骨肉瘤组表达高于骨软骨瘤组(P<0.05),在骨肉瘤组随 Ennking分期的递增而增加(P<0.05),NS的表达与骨肉瘤的病理分型无关(P>0.05)。2.PUMA定位于细胞质,在骨肉瘤组表达明显低于骨软骨瘤组(P<0.05),其表达与骨肉瘤Ennking分期和病理分型无关(P>0.05)。结论 NS和PUMA在骨肉瘤发生和发展过程中起着重要的作用。
Nucleostemin; Puma; 骨肉瘤; 免疫组织化学
骨肉瘤为起源于成骨组织的一种原发性恶性肿瘤,由肿瘤性成骨细胞、骨样组织所组成。骨肉瘤好发于长管状骨的干骺端,最常见于膝关节周围,约占50%-70%。各个年龄组均可发病,男性多于女性,男女发病率之比为1.4:1,恶性程度高,临床预后较差,常发生广泛的转移,尤其是肺部的转移而导致病人呼吸衰竭致死亡[1]。骨肉瘤的发生、发展与其他恶性肿瘤一样,是细胞增殖和细胞凋亡调控机制之间的平衡被破坏,促使细胞恶性转化的结果。细胞的增殖和凋亡的平衡受到一系列细胞周期正负调控因子的调控,这些因子相互作用的平衡保证了细胞增殖和凋亡的正常进行。一旦这种调节平衡被破坏,就可能导致肿瘤的发生和发展。
NS蛋白广泛表达于肿瘤细胞,目前已经证实在食管癌,胃癌,肝癌,膀胱癌等恶性肿瘤均有表达[2]。PUMA蛋白是Bcl-2家族BH3-only亚家族的一个成员,主要表达于细胞胞质,在p53依赖性和p53非依赖性细胞凋亡中都起着非常重要的作用。经研究证实,应用RNA干扰技术使细胞puma基因表达沉默后,p53依赖的凋亡受到抑制,而p53的其他功能没有受到影响[3];在人黑色素瘤细胞系转染外源性的 PUMA,不论其p53表达状态如何,均可导致细胞凋亡[4]。本文采用免疫组化 SABC法研究两种蛋白在骨肉瘤中的表达,对NS和 Puma各自在骨肉瘤组织中的表达与骨肉瘤临床分期和组织学分型的关系及两者表达的相关性进行了初步探讨。
材料和方法
1.材料
随机抽取华中科技大学同济医院病理科2001-2008年存档的病理确诊为骨肉瘤病例30例,所有病例术前均未接受放化疗。患者中男性18例,女性12例,年龄11-57岁。肿瘤直径最大者12㎝,最小者3㎝,其中直径<5㎝者12例,≥5㎝者18例。病理分型:骨母细胞型10例,纤维母细胞型14例,软骨母细胞型3例,其他型共3例。Ennking外科分期:Ⅰ期6例,Ⅱa期 7例,Ⅱb9例,Ⅲ期 8例。肿瘤部位:股骨12例,胫骨9例,肱骨7例,腓骨1例,肩胛骨1例。骨软骨瘤10例作为对照组。
2.免疫组织化学染色
免疫组化采用SABC法,两种因子的实验步骤相同,一抗分别为NS、PUMA,两个因子共用二抗、SABC试剂盒和DAB显色剂。石蜡切片脱蜡前60℃烤箱中烤 30min,脱蜡至水后 ①3%H2O210min。②5%BSA封闭,37℃温箱30min。③兔多克隆Anti-nucleostemin(1:100,Santa Cruz公司,兔单克隆PUMA(IHC工作液,北京康维世纪生物科技有限公司)室温24h。④生物素标记羊抗兔 Ig G(1:300,武汉博士德生物技术有限公司),37℃孵育lh。⑤SABC(1:300,武汉博士德生物技术有限公司)复合物37℃孵育1h。⑥滴加DAB液显色。试验中③-⑤步骤后均0.01mol/LPBS液(PH7.4)振洗3×5min。切片经梯度酒精脱水,二甲苯透明,树胶封片,显微镜下观察结果。阴性对照实验:步骤③时,切片用0.01mol/L PBS液代替一抗,其余步骤相同。
3.结果判定
NS的表达以细胞核出现棕黄色颗粒为阳性,PUMA的表达以胞质出现棕黄色颗粒为阳性表达。应用 HMIAS-2000型全自动医学彩色图像分析系统进行分析,胞核内有棕黄色反应物,染色明显高于背景者为阳性细胞,每例随机选取5个视野(20×物镜),分别测定每个视野下阳性细胞平均光密度值,以5个视野的均值作为该例的平均光密度值进行统计学分析。
4.统计学处理
所有数据统一输入计算机,采用SPASS13.0统计软件包进行处理。各组计量结果用Mean±S表示,两组比较用t检验,不同 Ennking分级组和不同病理分型组比较用多独立样本单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1.NS的表达和分布情况
NS在骨肉瘤表达于肿瘤细胞细胞核,在骨软骨瘤细胞中少见或未见表达。见图1a﹑1b。在骨软骨瘤的表达低于骨肉瘤,表达差异有统计学意义(P<0.05),见表 1。
2.PUMA的表达和分布情况
PUMA在骨肉瘤和骨软骨瘤细胞均表达于肿瘤细胞细胞质,见图2a﹑2b。在骨软骨瘤细胞中表达高于骨肉瘤细胞中的表达,表达差异有统计学意义(P<0.05),见表1。
3.NS和 PUMA表达与骨肉瘤病理分型和Ennking分期的关系
NS的表达与骨肉瘤的病理分型无关(P>0.05),其表达随着 Ennking分期的递增而增加(P<0.05)。PUMA表达与骨肉瘤Ennking分期和病理分型无关(P>0.05)。见表2.

表1 NS和PUMA在骨肉瘤和骨软骨瘤中的表达Table 1 The expressions of NS and PUMA in osteosarcoma and osteochondroma cells
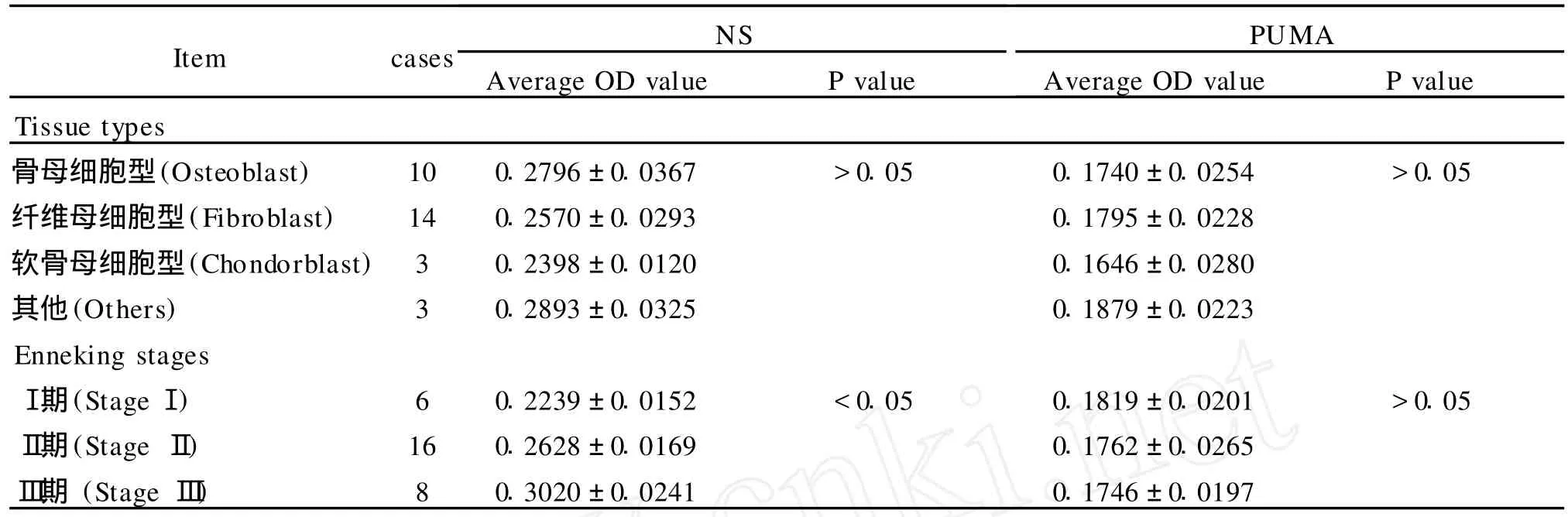
表2 NS和PUMA在骨肉瘤不同的病理分型和临床分期的表达Table 2 The expressions of NSand PUMA in different pathological classifications and clinical stages of osteosarcoma
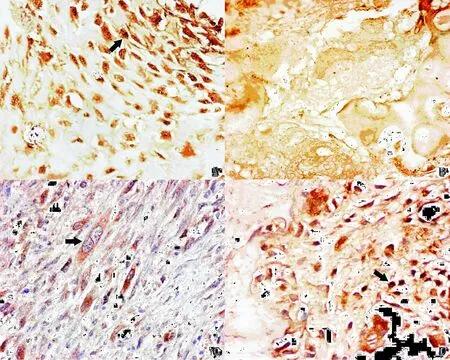
图1 NS和PUMA在骨肉瘤和骨软骨瘤细胞内免疫组化表达(SABC法×400)。A示NS在骨肉瘤细胞高核表达,以核仁明显。B示在骨软骨瘤未见明显NS表达。C示PUMA在骨肉瘤细胞表达较弱。D示PUMA在骨软骨瘤表达较强。Fig.1 Expressions of NSand PUMA in osteosarcoma and osteochondroma cells(SABC×400).A:Strong nuclear expression of NSin Osteosarcoma cells,especially in nucleous.B:The expression of NSin osteochondroma cells.C:The expression of PUMA in Osteosarcoma cells.D:The expression of PUMA in osteochondroma cells.
讨 论
NS蛋白在骨髓干细胞、胚胎干细胞、神经干细胞以及肿瘤细胞都有广泛表达,是维持干细胞和肿瘤细胞持续增殖所必需的一种核蛋白,在细胞分化的后期表达量显著降低,目前尚未发现在终末分化的细胞中有表达。NS蛋白主要表达于细胞核仁,由一个核仁定位的N-末端基本结构域,一个线圈状螺旋卷曲区,GTP结合域和一个酸性C-末端区构成。通过穿梭机制往返于核仁和核浆之间,NS的穿梭主要取决于其与 GTP以及其他核蛋白的相互作用状态。研究表明NS蛋白包括两个 GTP结合域,结合 GTP后NS在核仁聚集并通过与 RSL 1D1结合可在核仁较长时间滞留,与 GTP和 RSL1D1分离后,NS向核浆弥散。NS通过穿梭机制到达核浆后通过其与p53蛋白产物相互作用的途径调节干细胞增殖和分化[5]。干细胞和恶性肿瘤细胞分裂增殖﹑自我更新的调控信号途径可能是相同的,NS蛋白表达的过高或过低都可以阻断干细胞分化成熟,NS在肿瘤细胞可能也发挥类似的作用。刘思金等[2]研究发现,在乳腺癌、卵巢癌、食管癌等十几种肿瘤组织标本及人胚胎肾细胞(Human embryo kidney,HEK-293)、宫颈癌细胞(Hela细胞)、人成骨肉瘤细胞(OS-732)、肝癌细胞(Hep G2)等多种肿瘤细胞中都存在NS的高表达。Tsai[6]等应用siRNA抑制骨肉瘤细胞的NS基因表达,发现骨肉瘤细胞增殖活性显著下降,甚至大量死亡。核磷蛋白(Nucleophosmin,NPM)是一种在恶性肿瘤细胞含量丰富的多功能核蛋白。研究发现核磷蛋白在骨肉瘤细胞具有致癌能力[7]。试验证明在骨肉瘤细胞核NS可以与NPM相互结合并形成NS-P53-NPM的三聚体[8]。由此推测NS通过穿梭机制到达核浆有可能最终通过形成NS-P53-NPM的三聚体的形式发挥其在骨肉瘤发生发展过程的作用。
PUMA蛋白是bcl-2家族BH3-only亚家族成员,长度为193个氨基酸,含有C端疏水的膜定位序列和BH3结构域,分别是 PUMA发挥线粒体定位功能和促凋亡功能的结构基础。在依赖p53凋亡和非依赖p53凋亡过程中 PUMA蛋白是必需的。puma基因启动子序列中含有 P53结合位点,细胞在遭受基因毒性刺激时(包括DNA破坏,致癌基因激活,缺氧,药物等)P53表达上调,促进了puma的转录和蛋白产物的表达。在细胞遭受非基因毒性刺激时(细胞因子的敲除,缺血再灌注损伤等)也可导致PUMA激活,启动非依赖p53凋亡途径。在p53依赖性和p53非依赖性细胞凋亡中PUMA表达所诱发的凋亡级联反应是相同的。PUMA发挥其促凋亡作用主要通过三条途径[9-11]:①在胞质中 PUMA蛋白通过BH3结构域与bcl-2和 bcl-X(L)结合,从而解除bcl-2和bcl-xL对Bax/Bak的抑制作用,直接使其细胞保护功能丧失。②通过与p53/Bcl-xL中的Bcl-xL结合,释放p53,进而活化Bax;③PUMA可以导致BAX蛋白构象的变化,从细胞质转位至线粒体外膜并发生寡聚化。三种途径最终导致细胞色素C的释放和线粒体膜通透性的改变,破坏线粒体跨膜电位的稳定并激活caspase9和caspase3导致细胞的凋亡。PUMA在多种组织中都有表达,在肿瘤中表达较低,但很少发生突变和缺失。PUMA不但能诱导正常细胞凋亡,也能诱导肿瘤细胞的凋亡。YU[12]通过构建PUMA载体导入肿瘤细胞发现其能导致肿瘤细胞的快速凋亡。在肿瘤细胞,酪氨酸激酶调控的紊乱导致肿瘤的发生和转移。酪氨酸激酶抑制因子的缺失和突变是酪氨酸激酶调控紊乱的主要原因。研究表明在表达野生型P53的骨肉瘤细胞中加入酪氨酸激酶的抑制剂2,5-MeC48h后PUMA表达上调[13],从而导致细胞的凋亡,表明酪氨酸激酶与 PUMA之间存在某种相关性。
骨肉瘤好发于青少年,恶性程度高。以前的治疗主要是采取高位截肢,5年生存率约为10-20%。随着化疗疗效的提高,目前主要采用术前术后化疗联合外科手术治疗的方法,使5年生存率得到显著的提高。目前具体的外科手术治疗的方案的制订需要依据 Ennking分期。但是限于目前检查水平的局限性,术前准确的评估骨肿瘤 Ennking分期存在一定的难度。在本研究中发现NS蛋白的表达随着骨肉瘤Ennking分期的增加而增高,提示NS蛋白表达水平可以作为判断骨肉瘤肿瘤分期的一个重要的参考标准,结合其他各项影像学和分子生物学检查为骨肉瘤的治疗制订更加合理和正确治疗方案。术前术后化疗目前临床上最常用的化疗药物主要是阿霉素、顺铂、大剂量的甲胺喋呤、异环磷酰胺、长春新碱等。目前制约骨肉瘤化疗疗效的原因主要有两个方面:①高剂量和强度的化疗导致的毒副作用。②肿瘤细胞原发或继发性的耐药。这些与癌细胞对放、化疗的耐受与细胞凋亡机制无法正常发挥作用密切相关。PUMA在化疗药物诱导肿瘤的凋亡过程中发挥重要的作用 。2006年,Wang等用携带PUMA的重组腺病毒载体(Ad-PUMA)转染肿瘤细胞发现不论p53的状态如何,其都能快速和强烈的抑制细胞的生长,增加肿瘤细胞对化疗药物的敏感性[14]。本研究发现在骨肉瘤中PUMA的表达明显低于骨软骨瘤,表明在骨肉瘤细胞其表达受到抑制,PUMA可能是骨肉瘤基因治疗的一个潜在治疗靶点。但是Ad-PUMA在骨肉瘤细胞治疗中的作用还需要进一步的研究。
[1]Canale ST,Beaty JH.Campbell’s Operative Orthopaedics.11th ed,2008:901-902
[2]Liu SJ,Cai ZW,Liu YJ,et a1.Roleof Nucleostemin in the growth regulation of gastric cancer,liver cancer and other cancers.World J Gastroenterol,2004,10(9):1246-1249
[3]Hemann MT,Zilfou JT,Zhen Zhao,et al.Suppression of tumorigenesis by the p53 target PUMA.Proc Natl Acad Sci USA.2004,101(25):9333-9338
[4]Karst AM,Dai DL,Martinka M,et a1.PUMA expression is significantly reduced in human cutaneous melanomas.Oncogene,2005,24(6):1111-1116
[5]Meng LJ,Hiroaki Y,Tsai YL.Multiple controls regulate nucleostemin partitioning between nucleolus and nucleoplasm.Cell Science,2006,119:5124-5136
[6]Tsai RY,Mc Kay RD.A nucleolar mechanism controlling cell proliferation in stem cells and cancer cells.Genes Dev,2002,16(23):2991-3003
[7]Niforou KM,Anagnostopoulos AK,Vougas K,et al.The proteome profile of the human osteosarcoma U2OS cell line.Cancer Genomics Protemics.2008,5(1):63-78
[8]Ma H,Pederson T.Nucleophosmin is a binding partner of Nucleostemin in human osteosarcoma cells.Molecular Biology of the Cell.2008,19:2870-2875
[9]Letai A,Bassik MC,Walensky LD,et a1.Distinct BH3 domains either sensitize or activate mitochondrial apoptosis,serving as prototype cancer therapeutics.Cancer Cell,2002,2(3):183-192
[10]Chipuk JE,Bouchier HL,Kuwana T,et a1.PUMA couples the nuclear and cytoplasmic proapoptotic function of p53.Science,2005,309:1732-1735
[11]Wang XD.The expanding roleof mitochondria in apoptosis.Genes Dev,2001,15(3):2922-2933
[12]Jian Y,Lin ZH,Paul M H,et al.PUMA Induces the Rapid Apoptosis of Colorectal Cancer Cells.Molecular Cell,2001,7:673-682
[13]Naoyuki K,Mayako A,Kazuo U,et al.Tyrosine kinase inhibitor,methyl 2,5-dihydromethylcinnimate,induces PML nuclear body formation and apoptosis in tumor cells.Exprimental Cell Research.2007:2753-2765
[14]Wang H,Qian H,Yu J,et a1.Administration of PUMA adenovirus increases the sensitivity of esophageal cancer cells to anticancer drugs. Cancer Biol Ther,2006,5(4):380-385
The Signif icance of Nucleostemin and PUMA expression in osteosarcoma
Yan Chao1,Wang Hao2,Jiang Honghui1,Tian Keke3,Liu Shenghong3,Tan Yunbing1,Wang Jianchao1*
(1Department of Orthopedics,Tongj i Hospital,Huazhong University of Science and Technology,Wuhan 430030;2Yichang Central Hospital,Yichang 443000;3Department of Histology and Embr yology,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To study the expression of nucleostemin(NS)and p53 up-regulated modulator of apoptosis(PUMA)protein in osteosarcoma,and explore the relationship with pathological classification and clinical stages of osteosarcoma.Methods 30 specimens of osteosarcoma with different pathological classification and clinical stages were used for detecting the differential expression of NSand PUMA by using immunohistochemistry and image analysis.Results 1.NS was located in the nucleus,and NS expression in osteosarcoma was much higher than that of osteochondroma(P<0.05).The change of NSexpression was associated with clinical stages(P<0.05),but not with pathological classification of osteochondroma(P>0.05).2.PUMA was located in the cytoplasm,and PUMA expression in osteosarcoma was much lower than that of osteochondroma(P<0.05).The change of PUMA expression was not associated with clinical stages and pathological classification of osteochondroma(P>0.05).Conclusion The expression change of NSand PUMA may be related with the progression and proliferation of osteosarcoma cells.
Nucleostemin; PUMA; Osteosarcoma; Immunohistochemistry
R738.1
A
10.3870/zgzzhx.2011.03.012
2010-02-10
2011-04-01
严超,男(1981年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

