蛋白激酶C对胰岛素抵抗骨骼肌细胞的影响
侯士方 孟 馨 相泓冰 王涤非
蛋白激酶C对胰岛素抵抗骨骼肌细胞的影响
侯士方 孟 馨 相泓冰 王涤非*
(中国医科大学附属第一医院内分泌科辽宁沈阳110001)
目的 探讨蛋白激酶C(Protein Kinase C,PKC)在棕榈酸(Palmitic Acid,PA)诱导的骨骼肌细胞胰岛素抵抗(Isulin Resistance,IR)中的作用。方法 免疫荧光鉴定原代大鼠骨骼肌细胞,氧化酶-过氧化物酶偶联法(GOD-POD法)检测培养液中葡萄糖浓度。设立对照组、棕榈酸组(PA组)、罗格列酮组(Rosiglitazone,Ros组),每组一分为二,分别加 PKC抑制剂白屈莱红碱(Chelerythrine Chloride,CC)与正常培养液作用1h,Western Blot检测PKB及P-Ser473 PKB表达水平。结果90%以上的细胞α-sarcometric actin免疫荧光染色呈阳性反应,表明培养的细胞为骨骼肌细胞;0.6mmol/L的PA作用24h可诱导骨骼肌细胞产生胰岛素抵抗;PA组与对照组相比P-Ser473 PKB水平显著降低,与本组未加CC相比显著升高。同时,罗格列酮组及本组加CC中P-Ser473PKB水平均高于PA组。结论 在PA诱导的骨骼肌细胞IR方面PKC起重要作用,罗格列酮与PKC抑制剂CC均能改善PA引起的IR。
胰岛素抵抗; 蛋白激酶C; 蛋白激酶B; 棕榈酸; 骨骼肌细胞
胰岛素抵抗是葡萄糖耐量受损和2型糖尿病的主要特征,而胰岛素受体信号转导缺陷是胰岛素抵抗发生的主要原因,骨骼肌是胰岛素刺激的葡萄糖摄取的主要靶组织,也是胰岛素抵抗发生的主要部位[1],因此研究骨骼肌胰岛素抵抗的发生机制,将有助于进一步理解2型糖尿病发病机理及病理生理机制。本研究从胰岛素信号转导途径出发,探讨棕榈酸引起骨骼肌细胞IR的分子机制及PKC在棕榈酸诱导骨骼肌细胞 IR中的作用,为临床寻找有效的预防和治疗2型糖尿病靶点奠定理论基础和实验依据。
材料和方法
1.实验动物和试剂 SD大鼠(沈阳博尔美公司),DMEM培养基(HyClone公司),优级胎牛血清(天津灏洋),胰蛋白酶(沈阳宝泰克),棕榈酸(中国医药),罗格列酮(Cayman Chemical),白屈莱红碱(Chelerythrine Chloride,CC)(Sigmal公司),诺和灵(诺和诺德公司提供),葡萄糖检测试剂盒(上海荣升),α-sarcometric actin单克隆抗体和罗丹明(TRITC)标记的二抗(北京中衫),PKB多克隆抗体及碱性磷酸酶(AL P)标记的羊抗兔二抗(bioworld公司),P-Ser473PKB多克隆抗体(SAB公司)
2.骨骼肌细胞培养及纯化 取新生3-5d的SD大鼠,断头处死,浸泡在 75℅乙醇中消毒15min,无菌滤纸擦干。超净台内去皮、剪下四肢、去爪。尽量去除脂肪、肌腱等结缔组织,PBS洗3次。将肌肉组织剪成1 mm3左右的碎块,PBS洗3次。Ⅰ型胶原酶和胰蛋白酶联合消化30min,依次滤过 100、200、400 目的筛网[2、3]。用 10%胎牛血清的DMEM悬浮细胞,将细胞悬液接种于L-多聚赖氨酸铺底的培养瓶中,37℃、5℅CO2培养箱培养,1h后将上清液重新接种,重复接种2次,每2-3d换液,5-7d后传代即可获得原代培养的骨骼肌细胞。
3.骨骼肌细胞的免疫荧光鉴定 将无菌盖玻片放入6孔板中进行细胞爬片,当细胞增殖至70%密度后,用含3℅胎牛血清的DMEM进行分化培养,48h后细胞分化为成熟的肌管,免疫荧光方法鉴定骨骼肌细胞。
4.GOD-POD法测定葡萄糖浓度 细胞以1×104/ml接种于48孔板,分化培养为成熟的肌管后,每6孔一组,分别加入正常培养液(对照组)、0.6 mmol/L PA 的培养液(PA 组),于 6h、12h、24h加入胰岛素刺激15min,GOD-POD法(按说明书进行)测定每孔培养液中葡萄糖浓度。
5.Western blot检测PKB及P-Ser473 PKB的表达水平 根据每组加与不加 CC,分为对照(+)、对照(-);PA(+)、PA 组(-);Ros(+)、Ros(-)六组,各组一分为二,分别用正常培养基和胰岛素(1×10-7mol/L)作用15min后收集细胞。PBS洗2次,加入蛋白裂解液,冰上裂解30min,考马斯亮蓝法(比色法)测定蛋白浓度。每组上样蛋白150μg,10%SDS-PA GE凝胶电泳,湿法电转移至 PVDF膜上(电转3h);5%脱脂奶粉封闭,4℃过夜。弃去封闭液,用0.1%Tween-20 TBST洗膜,10 min×3次。将膜置于塑料袋内,分别加入0.1%Tween-20的 TBST稀释的 抗 PKB(1:600)、抗 P-Ser473 PKB(1:600)及β-actin(1:1500)一抗,室温孵育2h。TBST洗膜,10min×3次;然后用辣根过氧化酶标记羊抗兔二抗(1:15000),室温孵育1.5h,TBST洗膜,10min×3次,ECL发光。采用 Graph Pad Prism 5软件进行Western blot灰度值分析。
6.统计学处理 用SPSS 13.0软件进行统计学分析,数据以 ¯x±s表示,组间比较使用配对t检验,P<0.05差异有统计学意义,P<0.01,差异有极显著统计学意义。
结 果
1.骨骼肌细胞形态观察
倒置显微镜下观察原代骨骼肌卫星细胞,开始为单核的长梭形细胞(图1.A),逐渐融合为多核的长条形肌管,按一定方向呈有序排列,核位于中央,类似骨骼肌的纵切面(图1.B)。

图1 A.肌细胞培养5天 (×20)图1 B.肌细胞培养8天 (×20)Fig.1 A.Skeletal muscle cell raises for 5 days(×20)Fig.1 B.Skeletal muscle cell raises for 8 days(×20)
2.免疫荧光鉴定骨骼肌细胞
将分化成熟的成肌细胞,行免疫荧光染色,90%的细胞α-sarcometric actin克隆抗体染色呈阳性反应,胞浆染成红色,表明培养的细胞为骨骼肌细胞[4](图2)。
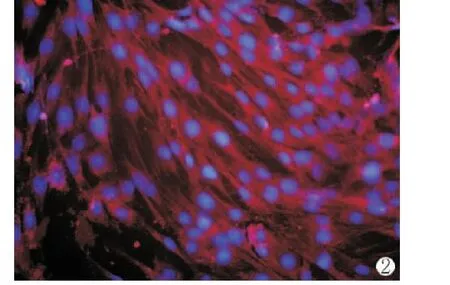
图2 骨骼肌细胞α-sarcometric actin的荧光染色(×40)Fig.2 α-sarcometric actin antibody staining of skeletal muscle cell(×40)
3.GOD-POD法测定上清液中葡萄糖浓度结果
棕榈酸作用6h、12h后,PA组培养液中葡萄糖浓度与对照组相比差异无统计学意义(P>0.05),24h后,PA组培养液中葡萄糖浓度较正常组显著升高,差异有极显著统计学意义(P<0.01),对胰岛素刺激的糖转运产生抑制[4](见表1)。

表 1 (¯x±s,n=6,mmol/L)
4.Western blot检测PKB及P-Ser473 PKB表达
在基础状态下及胰岛素刺激15min后,对照(-)、PA(-)、对照(+)、PA(+)、Ros(-)、Ros(+)之间PKB(Akt)蛋白水平差异无统计学意义(P>0.05)(图3、4)。基础状态及胰岛素刺激15min后,PSer473 PKB表达水平在 PA(-)组显著低于对照(-),差异有显著统计学意义(P<0.01);而 Ros(-)组和Ros(+)组显著高于 PA(-),差异有显著统计学意义(P<0.01);当用 PKC抑制剂CC作用1h,PA(+)组与PA(-)组相比,P-Ser473PKB表达显著增加,差异有统计学意义(P<0.05);而 Ros(+)组,对照(+)组与本组未加抑制剂相比P-Ser473 PKB表达水平,差异无统计学意义(P>0.05)(图5、6)。
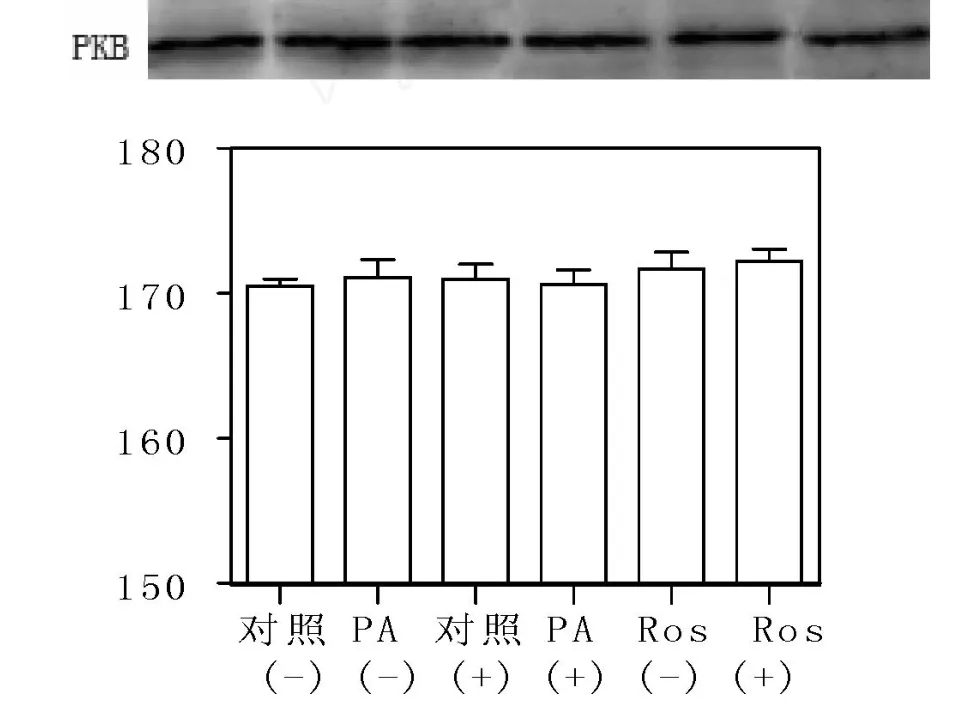
图3 基础状态下PKB的蛋白表达Fig.3 Western blot analysisfor PKB in the absenceof insulin

图4 胰岛素刺激15分钟PKB的蛋白表达Fig.4 Western blot analysis PKB treated with insulin for 15 minutes

图5 基础状态下P-Ser437PKB蛋白表达Fig.5 Western blot analysis for P-Ser437PKB in the absence of insulin
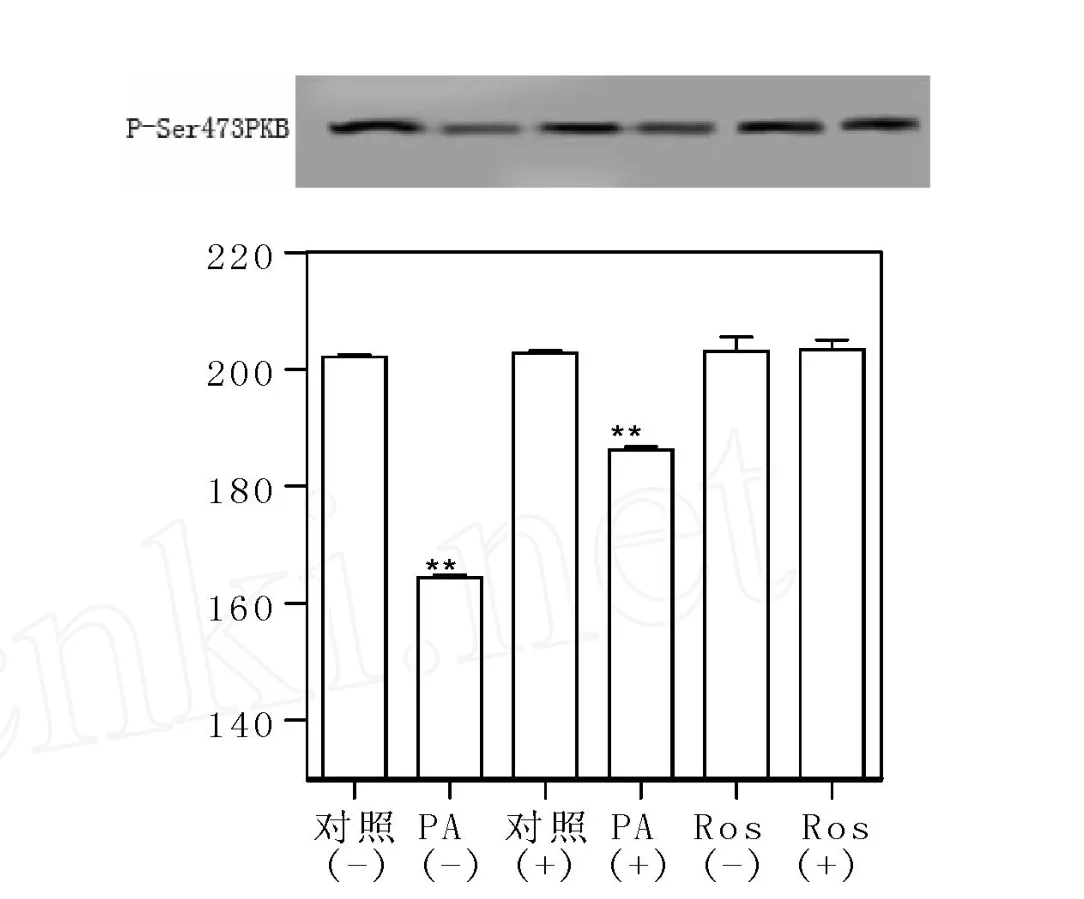
图6 胰岛素刺激15分钟P-Ser437PKB蛋白表达Fig.6 Western blot analysis for P-Ser437PKB treated with insulin for 15 minutes.
讨 论
目前,IR的发病机制尚不完全清楚,骨骼肌是机体利用葡萄糖的主要器官之一,80℅的葡萄糖在骨骼肌内代谢,也是 IR发生的主要部位。胰岛素主要通过IRS-1/PI3K/PKB(Akt)途径促进葡萄糖转运。PKB是PI3K信号通路下游受体蛋白激酶的主要靶点,由PI3 K激活后其结构发生变化导致其两个调节位点 Thr308和Ser-473磷酸化。在多数情况下,Ser-473位点磷酸化水平可以代表PKB的磷酸化程度[5-6],磷酸化的 PKB能刺激葡萄糖摄取和 Glut-4转位,调节葡萄糖摄取、糖原合成、糖酵解等胰岛素代谢反应[7]。本实验中PA组P-Ser473 PKB的水平低于对照组,表明 PA诱导骨骼肌细胞产生IR与 PKB活性降低有关[4]。而 PA组加用CC与本组未加CC相比,P-Ser473 PKB的水平是升高的,表明 PKC抑制剂可增加 IR中 P-Ser473 PKB的表达,PKC可能通过抑制PKB的活性而影响胰岛素信号的下传。同时,PA组P-Ser473 PKB的水平显著低于罗格列酮组(加CC和不加CC),提示胰岛素增敏剂罗格列酮可增加胰岛素抵抗肌组织中PKB的磷酸化水平,而 PKC抑制剂CC与罗格列酮存在相似性的作用,二者均可以改善骨骼肌胰岛素抵抗。此外,各组的PKB蛋白总体水平并没有发生变化,说明在胰岛素抵抗状态下,PKB的总蛋白水平并不减少,只是活性降低,而罗格列酮和CC并不增加PKB总蛋白的表达水平,只是使其活性增加。
蛋白激酶C(Protein Kinase C,PKC)是1977年由Nishizuka在鼠脑的胞质成分中发现的一种依赖磷脂和钙的蛋白激酶,由多种亚型构成,目前发现其包括α、β、δ、ε、γ、η、μ、φ、θ等 12 种亚 型[8]。研究显示,C2C12细胞中 PKCδ激活可使 IRS-1的Ser357发生磷酸化,从而降低胰岛素介导的 IRS-1的酪氨酸磷酸化,进一步使 PKB的激活减少,即PKCδ激活对胰岛素信号起负性调节作用[9、10]。Kim等报道 PKC-θ失活可明显减少 IRS-1降解并增加胰岛素诱导的IRS-1酪氨酸磷酸化和与p85相关的IRS-1和PI3K的磷酸化[11]。Cipok发现选择性的抑制PKC-α可改变 IRS-1水平最终使通路中PKB增加[12]。
综上所述,在 PA诱导的骨骼肌细胞 IR方面PKC起重要作用,它能抑制 PKB活性并减少葡萄糖利用,PKC抑制剂CC与罗格列酮一样具有改善PA引起的IR的作用。PKC抑制剂CC增加PKB的磷酸化可能是通过减少了PKC的过度激活,而减少其对PKB的抑制,从而对胰岛素信号转导起正调节。当然,我们的后续研究会研究PKC的各亚型的功能,从而了解PKC在IR中的全面作用,为T2DM的治疗提供新的靶点。
[1]Schmitz-Peiffer C.Protein Kinase C and Lipid-Induced Insulin Resistance in Skeletal Muscle.Ann N Y Acad Sci,2002,967:146-57
[2]王红勇,何作云,等.骨骼肌卫星细胞的纯化、培养、鉴定及生物学特性的研究.重庆医学,2006,35(8):692-694
[3]张晨晖,朱道立.大鼠骨骼肌卫星细胞培养的研究.安徽农业科学,2008,36(12):5004-5006.
[4]侯士方,孟馨,相泓冰等.胰岛素抵抗骨骼肌细胞中 PSer473PKB及糖原合成酶-3表达.山西医药杂志,2011,40(1):9-12
[5]Brazil DP,Hemmings BA.Ten yearsof protein kinase B signalling:a hard Akt to follow.Trends Biochem Sci,2001,26(11):657-664
[6]Brand C,Cipok M,Attali V,et at.Protein kinase C delta participates in insulin-induced activation of PKB via PDK1.J Biochemical and Biophysical Research Communications,2006,349(3):954-962
[7]Tremblay F,Lavigne C,J acques H,et al.Dietary cod protein restores insulin-induced activation of phosphatidylinositol 3-kinase/Akt and Glu T-4 translocation to the T-tubules in skeletal muscle of high-fat-fed obese rats.Diabetes,2003,52(1):29-37
[8]梁佩芳,顾勇,杨道茂,等.从天然产物中寻找蛋白激酶C抑制剂的研究进展.中国药物化学杂志,2007,17(4):245-262
[9]Waraich RS,Weigert C,Kalbacher H.Phosphorylation of Ser357 of Rat Insulin Receptor Substrate-1 Mediates Adverse Effects of Protein Kinase C-δon Insulin Action in Skeletal Muscle Cells.J Biol Chem Vol,2008,283(17)11226-11233
[10]Greene MW,Morrice N,Garofalo RS,et a1.Modulation of human insulin receptor substrate-1 tyrosine phosphorylation by protein kinase Cdelta.J.Biochem,2004,378:105-116
[11]Kim JK,Fillmore JJ,Sunshine MJ,et al.PKC-theta knockout mice are p rotected f rom fat-induced insulin resistance.J Clin Invest,2004,114(6):823-827
[12]Cipok M,Aga-Mizrachi S,Bak A.Protein kinase Cαregulates insulin receptor signaling in skeletal muscle.J Biochemical and Biophysical Research Communications,2006,345(2):817-824
Influence of protein kinase C on insulin resistance in skeletal muscle cells
Hou Shifang,Meng Xin,Xiang Hongbing,Wang Difei*
(Dept of Endorinology,The 1st Af tiliated Hospital,China Medical University,Liaoning 110001,China)
Objective To study the role of protein kinase Cin the mechanism of insulin resistance(IR)induced by palmitic acid in skeletal muscle cells.Methods The primary rat skeletal muscle cells were identified by immunofluorescence,and the glucose concentration was measured by GOD-POD method.Control group,palmitic acid group and rosiglitazone group were each divided into two subgroup s,which
either,the PKCinhibitor chelerythrine chloride or common culture solution for one hour.Levelsof protein kinase B and its phosphorylated form(P-Ser473 PKB)were determined by Western blot.Results Immunofluorescent staining showed that more than 90%of the cells were positively stained forα-sarcometric actin,which proved that the obtained cells were skeletal muscle cells.After 24 hours of treatment with 0.6mmol/L PA,the skeletal muscle cells could be induced for IR.The level of P-Ser473 PKB in the PA group decreased significantly compared to that of the control group and elevated significantly compared to that of the PA group without CC.Meanwhile,the level of P-Ser473 PKB in rosiglitazone and rosiglitazone with CC groups were significantly elevated compared to that of the PA group.Conclusion PKC plays an important role in insulin resistance induced by PA in skeletal muscle cells.Both rosiglitazone and chelerythrine chloride can significantly improve IR induced by PA.
Insulin resistance; Protein kinase C; Protein kinase B; Palmitic acid; Skeletal muscle cells
R322.57
A
10.3870/zgzzhx.2011.03.006
2010-11-06
2011-04-03
辽宁省高等学校科研计划项目(2010225002);辽宁省教育厅科技基金(L2010626);辽宁省自然基金(20092113);辽宁省科技厅专项科研基金(2008934)
侯士方,女(1983年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

