猪肝产过氧化氢酶后之废渣酶法生产复合氨基酸工艺研究
吴保承,汤鲁宏,张 栋,杨春霞,刘 磊,方 鑫
1江南大学,无锡214122;2江苏省生物活性制品加工工程技术研究中心,无锡214028
猪肝产过氧化氢酶后之废渣酶法生产复合氨基酸工艺研究
吴保承1,2*,汤鲁宏1,张 栋2,杨春霞2,刘 磊1,方 鑫1
1江南大学,无锡214122;2江苏省生物活性制品加工工程技术研究中心,无锡214028
本文对以猪肝为原料生产过氧化氢酶过程中产生的废渣、废水进行了深入处理,采用胃蛋白酶进行酶解后提取出一种富含氨基酸和多种营养成分的物质——复合氨基酸粉,并实现了废渣废水零排放的清洁生产工艺。并对胃蛋白酶酶解废渣、废水的条件进行了优化,得到最佳酶解条件为:酶解温度35℃,pH 2,酶解时间12 h。
过氧化氢酶;复合氨基酸;胃蛋白酶;酶解
过氧化氢酶的生产主要有动物组织(主要是肝脏)提取法和发酵法[1,2],由于国内发酵法生产过氧化氢酶的条件尚不成熟[3,4],所以目前国内企业生产过氧化氢酶多以猪、牛、羊、鸡、鸭、鹅、鱼类等各种动物的肝脏为原料,经过自溶处理使其中所含的过氧化氢酶溶出,然后经过滤或离心分离去除残渣,再将所得滤液(或上清液)经过超滤浓缩得到产品[5-7]。该工艺产品单一,原料没有得到充分的利用,且在生产过程中会产生大量的废渣和废水,对环境造成严重的污染[8-10]。
能够在分离提取过氧化氢酶的同时,联产其它高附加值产品,提高原料的利用率,同时消除过氧化氢酶加工生产过程中的环境污染问题,实现生产过程的废渣废水零排放,使该产品的加工生产以对环境友好的工艺进行,国内外尚未见任何报道。
从猪血中提取生物活性物质已经进入学者们的研究视线,但从猪肝残渣中提取生物活性物质的课题还未有人研究[11]。本文作者经过对以猪肝为原料生产过氧化氢酶过程中产生的废渣、废水研究分析发现:废渣和经过浓缩的废水中含有大量的蛋白质、维生素和矿物质等营养成分,经过适当的酶解加工处理,可以几乎全部液化,得到以可溶性肝水解活性复合氨基酸为主,并富含维生素、矿物质及其他各种具有保肝作用的功能保健因子的酶水解液体混合物,具有高的药用及医疗保健价值,可以作为新型天然药物原料、功能保健食品原料用于药品、保健品、食品等领域。
1 材料与方法
1.1 材料
猪肝(市售);化学试剂皆为分析纯;各种蛋白酶由广西南宁庞博生物工程有限公司提供。
1.2 主要仪器设备
中空纤维超滤膜、卷式反渗透膜,由赛普(无锡)膜科技发展有限公司提供;GQ145型高速离心机(上海知正离心机有限公司);HH-2数显恒温水浴锅(金坛市精达仪器制造厂)
1.3 工艺流程
新旧工艺流程对比
1.3.1 旧工艺

1.4 水解效率计算方法
反渗透浓缩液与滤渣合并,将pH值调节至蛋白酶的最适pH下,在蛋白酶的最适温度下水解一定时间后将pH值调节至6.8,离心(4°C,8000 rpm,30 min),得到黄色的澄清透明的酶水解液和湿的固体残渣。
水解效率=固体残渣质量/(固体残渣质量+水解液质量)×100%
2 结果与讨论
2.1 水解用酶的选择
选取胃蛋白酶,胰蛋白酶,中性蛋白酶,碱性蛋白酶,木瓜蛋白酶,分别在其最适温度和pH下酶解废渣和反渗透浓缩液的混合物,随着时间的推移,酶解效率见下图1:

图1 各种蛋白酶的酶解效率Fig.1 hydrolyzing results of different enzymes
由上图1可知,胃蛋白酶的酶解效果最好,其次是胰蛋白酶、中性蛋白酶和碱性蛋白酶,木瓜蛋白酶的酶解效果最差。所以选取胃蛋白酶对滤渣和反渗透浓缩液的混合物进行水解。
2.2 单因素实验
2.2.1 温度对酶解效率的影响
取一定量的废渣和反渗透浓缩液的混合物,加入适量胃蛋白酶,调pH至2,分别在20、25、30、35、40、45℃下酶解12 h后计算酶解效率,结果如下图2:

图2 温度对酶解效率的影响Fig.2 The effect of temperature on the enzymatic hydrolyzing efficiencies
由上图2可知,温度对酶解效率有较大的影响,随着温度的升高,酶解效率不断提高,在35℃左右时酶解效率达到最大,温度继续升高,酶解效率呈明显的下降趋势,这是由于过高的温度影响了胃蛋白酶的活性,从而使酶解效率降低。所以选择酶解温度为35℃较为恰当。
2.2.2 pH对酶解效率的影响
取一定量的废渣和反渗透浓缩液的混合物,加入适量胃蛋白酶,分别调pH至1、1.5、2、2.5、3、3.5,在35℃下酶解12 h后计算酶解效率,结果如下图3:

图3 pH对酶解效率的影响Fig.3 The effect of pH on the enzymatic hydrolyzing efficiencies
由上图3可知,pH对酶解效率有较大的影响,随着pH的升高,酶解效率呈现先升后降的走势,在pH 1.5~2.0之间,酶解效率达到最大,之后随着pH的提高,酶解效率迅速降低,这是因为pH的提高对胃蛋白酶的酶活有较大的抑制作用,导致酶解效率降低。所以选择pH 1.5~2.0较为合适。
2.2.3 时间对酶解效率的影响
取一定量的废渣和反渗透浓缩液的混合物,加入适量胃蛋白酶,调pH至2,在35℃下分别酶解4、6、8、10、12、14 h后计算酶解效率,结果如下图4:

图4 时间对酶解效率的影响Fig.4 The effect of temperature on the enzymatic hydrolyzing efficiencies
由上图4可知,酶解效率随着时间的推移不断提高,在12 h后处于稳定状态,所以选择酶解时间12 h以上即可。
2.3 正交实验
以温度,pH,时间三因素对酶解效率的影响作3因素3水平正交实验,结果见下表1和2:

表1 正交分析因素水平表Table 1 The table of cross analysis factors
由正交结果可知,对过氧化氢酶提取过程中产生的废渣、废水的酶解效率的影响因素依次为A(温度)>C(时间)>B(pH),即酶解温度对酶解效率的影响最大。选取A2B2C3作为酶水解条件时酶解效率最高,即酶解温度35℃,pH 2,酶解时间14 h。又从单因素实验可知,酶解时间达到12 h后,酶解效率基本保持稳定,从操作和生产成本角度考虑,选用酶解时间为12 h即可。最终确定对过氧化氢酶提取过程中产生的废渣、废水的最佳酶解条件是:酶解温度35℃,pH 2,酶解时间12 h,在此条件下,酶解效率可以高达98%。

表2 正交试验结果Table 2 The result of cross analysis
3 酶解产物成分分析
通过对废渣、废水经酶水解反应产生的肝泥水解物进行成分分析,采用原子吸收法,分析其中的矿物质,结果见表3;另用高效液相色谱分析其中的氨基酸组成,结果见表4。
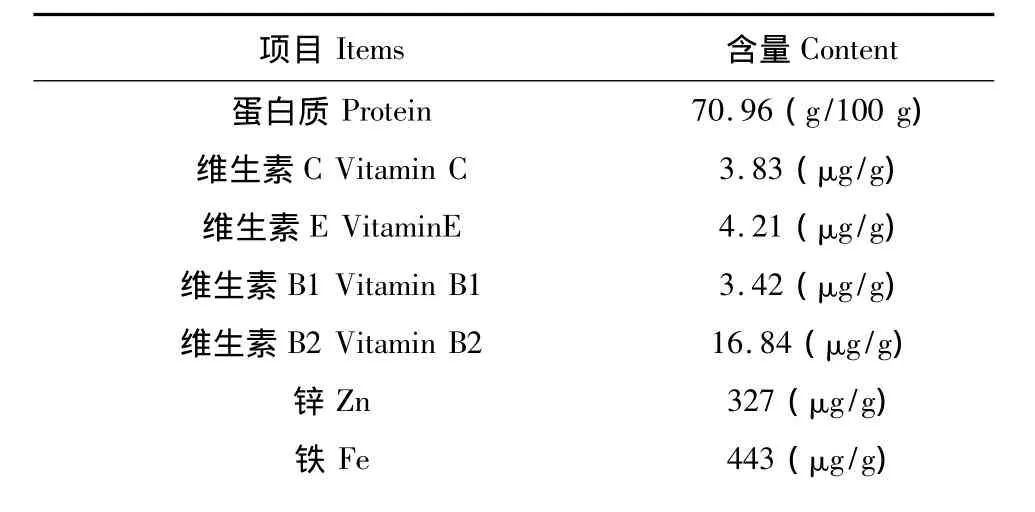
表3 肝泥水解物蛋白质及维生素和矿物质组成Table 3 The vitamins and mineral composition of liver saludge enzymatic hydrolyate

锰Mn 21.9(μg/g)铜Cu 14.6(μg/g)钾K 6.18(mg/g)钠Na 121(mg/g)镁Mg 592(μg/g)钙Ca 848(μg/g)铬Cr 5.48(μg/g)镍Ni 2.89(μg/g)钴Co 未检出undetected砷As 0.37(μg/g)重金属(以铅计)heavy metals(as pb) ≤10(μg/g)

表4 肝泥水解物的氨基酸组成Table 4 The animo acid composition of liver saludge enzymatic hydrolyate
由表3,表4可以看出:肝泥水解物即复合氨基酸的营养成分相当丰富,水解后的肝泥,经过进一步加工处理,便可以达到即充分利用原料,又实现废水废渣零排放的目的。
4 初步结论
根据胃蛋白酶,胰蛋白酶,中性蛋白酶,碱性蛋白酶,木瓜蛋白酶等各种蛋白酶对过氧化氢酶提取过程中产生的废渣、废水的酶解能力,选取胃蛋白酶进行酶解工艺条件优化,得到最佳酶解条件为:酶解温度35℃,pH 2,酶解时间12 h,在此条件下,酶解效率可以高达98%。
改进后的新生产工艺相对于原有工艺来说提高了原料的利用率,消除过氧化氢酶加工生产过程中的环境污染问题,实现加工生产过程的废渣废水零排放。
1 Liu B(刘冰),Liang CJ(梁婵娟).Recent advances of catalase in organism.Chin Agric Sci Bull(中国农学通报),2005,21:223-232.
2 Cao XY(曹翔宇),Hua ZZ(华兆哲),Yan GL(燕国梁),et al.Fermentation optimization and textile pretreatment application of catalase produced by Thermoascus aurantiacus.Ind Microbiology(工业微生物),2006,36:7-12.
3 Huang YH(黄永洪),Hua H(花慧),Shen GQ(沈国强),et al.Study on extraction of catalase from pig liver.Lett Biotech (生物技术通讯),2005,16:40-42.
4 Tian HL(田荟琳),Zhang KS(张坤生).Study on extraction of hydrogen peroxides from pig blood and its prosperities.Food Sci(食品科学),2006,27:311-314.
5 Shen GQ(沈国强),Zhang D(张栋),Yang CX(杨春霞),et al.Study on extraction of catalase from cattle liver.Chem Bioeng(化学与生物工程),2008,25:37-39.
6 Liu CL(刘昌玲),Wang GQ(王国庆).The separation,crystallization and properties of bacterial catalase.Progress In Biochem Biophys(生物化学与生物物理进展),1990,17: 380-383.
7 Zhang EX(张尔贤),Wu DQ(吴丹奇),et al.The Purification of catalase from pig blood and some of its properties.Pharm Biotechnol(药物生物技术),1994,2:5-8.
8 Xu JB(徐镜波),Lang PZ(郎佩珍).The determination of hydrogen peroxide inhibition activity and activity.Environ Chem(环境化学),1994,13:279-282.
9 DismukesGC.Manganeseenzymeswith binuclearactivesitcs.Chem Rev,1996,96:2909-2926.
10 Meier AE,Whittaker MM,Whittaker JW.EPR polarization studies on mncatalase from lactobacillus plantarum.Biochemistry,1996,35:348-360.
11 Yu YK(余奕珂),Hu JE(胡建恩),Bai XF(白雪芳),et al.Progress on research of bioactive peptides derived from pig's blood.Fine Special Chem(精细与专用化学品),2004,12:10-14.
Process for Simultaneously Production of Catalase and Compound Amino Acid from Animal Liver
WU Bao-cheng1,2*,TANG Lu-hong1,ZHANG Dong2,YANG Chun-xia2,LIU Lei1,FANG Xin11Jiangnan University,Wuxi 214122,China;2Jiangsu Engineering Research Center for Bioactive Products Processing Technology,Wuxi 214028,China
The waste sludge and waste water generated as the by-products during the extraction of catalase from porcine liver autolyzate were investigated for the possibility to be utilized.After hydrolysis by pepsin,compound amino acid,the hydrolyzate of waste sludge and waste water rich of amino acid as well as other nutritional components were obtained and an environmental benign process with the characteristics of effluent free was established.The pepsin hydrolyzing condition were optimized:35℃,pH=2,for 12 h.
Catalase;compound amino acid;pepsin;enzymatic hydrolysis
1001-6880(2011)04-0747-04
2010-01-13 接受日期:2010-04-21
*通讯作者 Tel:86-510-85346500:;E-mail:bcwu923@163.com
Q814.9;TQ936.1+6
A

