非聚氯乙烯软包装输液残存概率法灭菌工艺研究
张强,严文超,韩丽萍(广州军区广州总医院药剂科,广州市510010)
非聚氯乙烯软包装输液残存概率法灭菌工艺研究
张强*,严文超,韩丽萍#(广州军区广州总医院药剂科,广州市510010)
目的:对我院生产非聚氯乙烯软包装输液时采用的残存概率法灭菌工艺进行验证。方法:主要通过对不同产品进行热穿透试验,以确定在设计的灭菌参数下,装载室中的“最冷点”产品内部标准灭菌时间(F0)值>9min;通过生物指示剂试验,确定产品中固定数量嗜热脂肪芽孢杆菌孢子完全杀灭(生物指示剂为阴性);考察输液袋灭菌适应性及灭菌前、后产品pH,主成分含量和5-羟甲基糠醛量的变化等。结果:采用115℃、30min,8min≤F0<12min的湿热灭菌工艺,热穿透试验中灭菌结束时F0值平均为11.3min;生物指示剂试验中生物指示剂均为阴性;输液袋灭菌适应性良好,产品灭菌后质量符合相关要求。结论:该灭菌工艺可靠。
非聚氯乙烯软包装;灭菌工艺;验证
非聚氯乙烯(PVC)软包装是一种新型输液包装,主要包括3层和5层共挤输液用袋,由于其具有可回复性好、气密性好、药物相容性好、温度适应性强、不含增塑剂[1]等优点,已经成为一种重要的输液包装材料。输液生产工艺中灭菌是关键工序,灭菌过程中灭菌柜各点温度、压力等的均匀程度直接关系到产品的安全、有效、稳定和均一性。我院生产非PVC软包装输液时,采用115℃、30min,标准灭菌时间8min≤F0<12min的残存概率法湿热灭菌工艺[2]。为确认此灭菌工艺可靠,现通过灭菌器空载、满载热分布试验,热穿透试验和生物指示剂试验,输液袋的灭菌适应性试验进行检验;同时,考察灭菌前产品的微生物污染水平,灭菌前、后的pH,主成分含量、5-羟甲基糠醛量的变化和灭菌后无菌、细菌内毒素情况,以对此工艺灭菌效果进行研究。
1 仪器与材料
XG1.KE-5.0C快速冷却灭菌器(山东新华医疗器械股份有限公司,2个Pt100(铂热电阻)温度传感器分别设置在灭菌柜底部2个排水口处);QT-3200型16路巡检仪、Pt100温度探头(济南仁和机器有限公司)。
嗜热脂肪芽孢杆菌孢子(上海鸿雍生物科技有限公司,批号:100501,芽孢含量:每支105cfu,D(一定温度下将微生物杀灭90%或使之下降1个对数单位所需的时间)值:1.7min)。
5层共挤输液用袋(本院制剂中心,采用全自动制袋灌装机,百级环境下制袋并灌装药液。输液用袋5层结构为改性乙烯-丙烯聚合物/聚乙烯/聚乙烯/乙烯甲基丙烯酸酯聚合物/多酯共聚物)。
灭菌注射用水(批号:10072811,规格:每袋500mL;批号:10061511、10061522、10061533,规格:每袋250mL)、10%葡萄糖注射液(批号:10071311、10071322、10071333,规格:每袋500mL)、0.9%氯化钠注射液(批号:10070311、10070322、10070333、10121434,规格:每袋 500mL;批号:10121334,规格:每袋250mL;批号:10120123,规格:每袋100mL)、葡萄糖氯化钠注射液(批号:10080611、10080622、10080633,规格:每袋500mL)、乳酸钠林格注射液(批号:10081311、10081312、10081323,规格:每袋500mL)均为本院制剂中心制备。
2 方法与结果
2.1 灭菌
灭菌压力:156~162Pa;灭菌温度:115℃;灭菌时间:30min;冷却水压力:0.2~0.3MPa;F0(系灭菌过程赋予被灭菌物品121℃下的灭菌时间)值:>9min;蒸汽压力:0.55~0.70MPa;压缩空气压力:0.4~0.6MPa。灭菌程序为:置换→升温→灭菌(30min)→排压(22min)→冷却→排水,共6个阶段。满载情况下灭菌器内共有4个灭菌车,每个灭菌车14层,500mL规格产品可整齐摆放2016袋,250mL规格产品可整齐摆放2688袋,100mL规格产品可整齐摆放3136袋。
2.2 验证试验
为保证灭菌效果,必须对灭菌方法的可靠性进行验证,对于热压灭菌,要求对灭菌柜进行空载和满载热分布试验、热穿透试验和生物指示剂试验[3]。
2.2.1 空载热分布试验。此试验目的是检查空载条件下灭菌柜内热分布情况,确定腔室内可能存在的冷点。①测试方法:将16支温度探头均匀分布在灭菌柜内,按灭菌器操作程序运行,运行过程中记录仪每30s记录1次各点温度,连续运行3次,以检查其重现性。②标准要求:灭菌柜内各点灭菌阶段最低及最高温度与平均温度之差应≤±1.0℃。③测试结果:从3次空载热分布数据统计结果看出,柜内各点温度均匀,灭菌阶段最低及最高温度与平均温度之差≤±1.0℃。
2.2.2 满载热分布试验。此试验目的是检查满载条件下灭菌柜内热分布情况,确定其中可能存在的冷点。①测试方法:将500mL 5层共挤输液用袋灌装注射用水,按灭菌柜的装载能力在115℃下灭菌30min,并将16支温度探头均匀分布在灭菌柜内,连续运行3次,确定装载室中的“最冷点”。②标准要求:灭菌柜内各点灭菌阶段最低及最高温度与平均温度之差应≤±1.0℃。③测试结果:从3次结果来看,灭菌阶段柜内各点温度分布比较均匀,且灭菌柜内最低及最高温度与平均温度的差值≤±0.8℃,灭菌柜底部2个排水口为相对意义上的冷点。
2.2.3 热穿透试验。不同药液的黏度和密度不同,因此热穿透性不同,需要分别进行试验以确定在设计的灭菌参数下装载室(灭菌柜)中的“最冷点”产品内部8min≤F0<12min。①测试方法:对500mL规格的10%葡萄糖注射液、0.9%氯化钠注射液、葡萄糖氯化钠注射液、乳酸钠林格注射液4个品种分别满载灭菌,灭菌时将2支温度探头分布在灭菌器底部2个排水口处,其余14支温度探头均匀分布在灭菌器腔室内,温度探头均需插入装有药液的输液袋内,灭菌过程中记录仪每30s记录1次各点温度,连续运行3次,检查各点F0值。②测试结果:灭菌阶段最低F0值与平均F0值的差值<0.8;灭菌结束时F0值均小于12min,平均为11.3min。
2.2.4 生物指示剂试验[4]。①测试方法:满载灭菌时,将16支生物指示剂分别放入待灭菌产品中密封,然后将装有生物指示剂的待灭菌产品置于“2.2.3”项中温度探头的分布点。灭菌后的生物指示剂与2支未经灭菌的生物指示剂(阳性对照),同在58℃条件下培养48h,观察其颜色变化,确定灭菌效果(产品中固定数量嗜热脂肪芽孢杆菌孢子完全杀灭),连续运行3次,以检查其重现性。②测试结果:3次检验中生物指示剂均为阴性,阳性对照均呈阳性反应。
2.3 灭菌前微生物污染水平监控
灭菌前产品的微生物控制应当作为输液生产中最重要的质量保证措施和正常生产的先决条件,确立于产品验证阶段。我国《药品生产质量管理规范》(GMP)2010年版没有对灭菌前产品的微生物污染程度作出具体规定,生产中应进行监测,积累数据,以灭菌后产品污染率低于百万分之一以及细菌内毒素、无菌检查符合2010年版《中国药典》相关规定为最低目标,确定适当的控制标准。
2.3.1 带菌量试验。取某天灌装最后的产品作为灭菌前样品,再分别按照2010年版《中国药典》一部附录ⅪJ[4]微生物限度薄膜过滤法全量检查;试验3次,取样量及试验结果见表1。
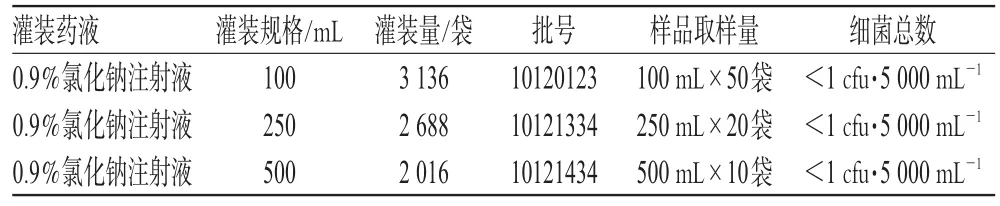
表1 灭菌前微生物污染水平Tab 1 The level of microbial contamination before sterilization
2.3.2 耐热性检查[5]。取样批次、取样量同表1,用0.45μm滤膜过滤药液样品。将此滤膜转移入装有无菌的0.9%氯化钠注射液的试管中,在沸水浴上煮沸30min,然后于0~35℃下在硫乙醇酸盐肉汤中培养,结果均未发现细菌生长。
以上带菌量试验和耐热性检查结果表明,药液的制备、过滤、灌封工艺适用性良好,灌装过程的环境洁净度控制良好,可保证不对药液产生污染。由此,制定我院非PVC软包装输液生产中的相关标准,即灭菌前微生物污染水平为小于1cfu·5000mL-1。
2.4 5层共挤输液用袋灭菌适应性
对3个批次、每批100袋灌装注射用水的样袋按以上灭菌方法灭菌,按照5层共挤输液用膜(Ⅰ)、袋标准[6]对样袋进行检测,其温度适应性、抗跌性、透明度、不溶性微粒4个项目全部符合标准要求。
2.5 灭菌前、后pH及主成分含量、5-羟甲基糠醛量的变化
随机抽调2010年度生产的0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液、乳酸钠林格注射液各20批次,计算灭菌前、后pH值及主成分含量、5-羟甲基糠醛量均值,进行无菌和细菌内毒素检查,各指标结果见表2(表中“A”指吸光度,代表5-羟甲基糠醛的量)。
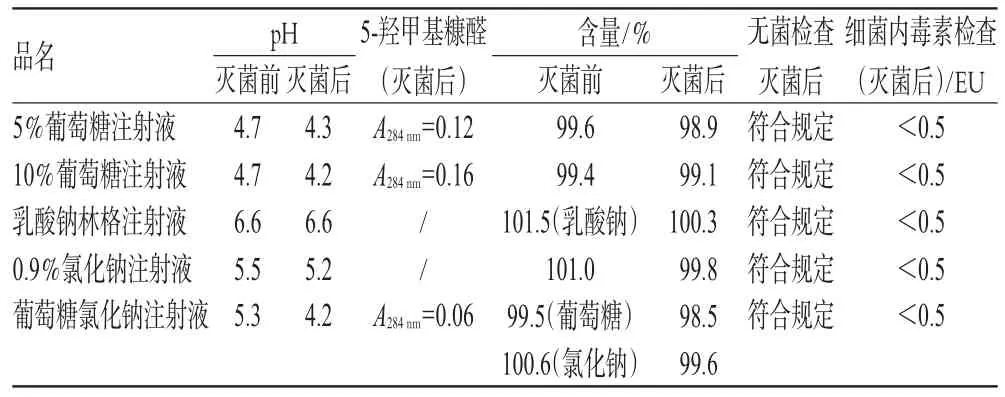
表2 灭菌前、后样品各指标检查结果比较(n=20)Tab 2 Comparison of results of indicator tests before and after sterilization(n=20)
由表2数据可见,各样品灭菌前、后pH差值在0~1.1,含量差值在0.3%~1.2%,葡萄糖注射液灭菌后5-羟甲基糠醛测定值远低于限度值(0.32),质量符合相关要求。
3 讨论
(1)残存概率法灭菌工艺,是通过控制工艺过程的微生物污染和灭菌工艺参数使产品无菌。灭菌前的微生物污染水平与原辅料、包材微生物水平,洁净室的洁净度,操作人员的无菌意识密切相关,只有严格执行GMP要求,加强业务培训,提高人员素质,才能从根本上提高无菌保证水平。
(2)XG1.KE-5.0C快速冷却灭菌器,冷却阶段通过冷水喷淋冷却,从而缩短受热时间来减少输液的杂质。由于冷却水直接接触输液产品,也存在污染的风险,笔者生产中使用纯化水作为灭菌冷却阶段用水,日常监控中其微生物污染水平每1mL小于20个控制菌。
(3)灭菌前微生物污染水平日常监控时,若带菌量超标,应对污染菌进行鉴别,调查污染菌的来源并采取相应纠正措施。当耐热性检查发现药液存在细菌污染时,应测定污染菌的D值,然后根据灭菌的F0值及污染菌的耐热性对产品无菌情况作出适当评价。
[1] 杨一凡,胡 梅,胡 君,等.输液包装的使用调查分析[J].中国药师,2009,12(12):1842.
[2] 中国人民解放军总后勤部卫生部.中国人民解放军医疗机构制剂规范[S].第2版.北京:人民军医出版社,2003:303.
[3] 国家食品药品监督管理局药品安全监管司.药品生产验证指南[M].北京:化学工业出版社,2003:319-320.
[4] 国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录107、190-193.
[5] 李 均.药品GMP验证教程[M].第1版.北京:中国医药科技出版社,2002:286.
[6] 国家食品药品监督管理局.国家药品包装容器(材料)标准(试行)-YBB 00112005五层共挤输液用膜(Ⅰ)、袋[S].2005.
Bioburden Based Sterilization Process of Non-PVC Soft-packing Transfusion
ZHANG Qiang,YAN Wen-chao,HAN Li-ping(Dept.of Pharmacy,Guangzhou General Hospital of Guangzhou Military Command,Guangzhou 510010,China)
OBJECTIVE:To carry out the bioburden based sterilization process validation for non-PVC soft-packing transfusion.METHODS:Heat penetration tests were carried out among different products so as to make sure F0value of products at the coldest point was more than 9min,with certain sterilizing-parameters setting;microbial indicator tests were conducted to prove if the sterilizing techniques can kill all Bacillus stearothermophilus(bioindicator negative);changes of parameters such as pH value,content,5-hydroxymethylfurfural and temperature-adaptability of non-PVC soft package before and after sterilization were also studied.RESULTS:The sterilizing-parameters were as follows:115℃,30min,8min≤F0<12min.In heat penetration tests,F0was equal to 11.3averagely at the end of sterilization.In microbial indicator tests,bioindicators were all negative,and temperature adaptability of product was fine.Furthermore,the quality of product was up to the related standards.CONCLUSION:The method is practical and reliable.
Non-PVC soft package;Sterilization process;Validation
R927.1
A
1001-0408(2011)37-3513-03
*主管药师。研究方向:医院药学。电话:020-36652003。E-mail:zqdm@sohu.com
#通讯作者:主任药师。研究方向:新药开发。电话:020-36654456
2010-12-20
2011-04-07)

