大鼠蛛网膜下腔出血后MMP-9在基底动脉壁中的表达变化
党宝齐 陈 罡 王 中
基质金属蛋白酶(matrix metallop roteinases,MMPs)是一组具有蛋白水解活性的半胱氨酸蛋白酶,有相似的功能特性。MMP-9 是MMPs家族中明胶酶的一种,目前研究表明MMP-9 参与多种神经系统疾病的发生、发展[1~3],近年来,研究认为MMP-9与蛛网膜下腔出血后发生的早期脑损伤(early brain injury,EB I)关 系 密 切[3,4],但 它 与SAH 后血管壁痉挛的关系尚无报道。本实验利用大鼠枕大池一次注血法制得SAH 动物模型,应用常规HE染色及免疫组化等方法观察基底动脉管壁形态及MMP-9 分子在管壁上的表达变化,探讨MMP-9在CVS 的发生中所起的作用。
1 材料与方法
1.1 研究对象
成年健康雄性Sprague-Dawley(SD)大鼠51只,体重250~300 g,由苏州大学医学院实验动物研究中心提供。大鼠随机分为正常组(6只)、对照组(假注血组15只)和SAH 组(30只),其中对照组和SAH 组分 为1、3、5、7、14 d 5 个 亚 组,对 照 组 和SAH 组每个亚组分别为3 只、5 只大鼠。Rabbit Anti-MMP-9购于北京博奥森生物技术有限公司。
1.2 SAH 模型的制作
将SD 大鼠用10%水合氯醛(4 ml/kg)腹腔麻醉成功后,俯卧固定于操作台上,在左右耳根连线可摸到枕外隆凸,往下大约0.5 cm 可感觉一凹陷,在此处沿中线纵行剪开项部皮肤,上至枕外隆凸,长约1.5 cm,向内钝性逐层分离皮下软组织及项部肌群,暴露寰枕筋膜后碘伏棉球覆盖伤口;翻转大鼠,使其仰卧位,解剖大鼠腹侧部尾动脉,不抗凝下抽取动脉血0.35 ml,l ml注射器针头紧贴枕骨大孔下缘穿刺寰枕筋膜,见有清亮脑脊液流出,在1~2 min的时间内按0.3 ml自体不抗凝动脉血注入枕大池,注血后穿刺点压迫3 min,缝合切口;与水平面30°保持头低位30 min以上,使血液向蛛网膜下腔流动;大鼠保温复苏至清醒后自由饮食饮水。假注血组以等容积生理盐水代替自体血注入枕大池,对应实验组相应时间点处死取材。正常组为正常大鼠,未作任何处理。
1.3 大鼠的处死方法及标本留取
各组大鼠在不同时间分批次以10%水合氯醛麻醉后开胸,先剪开右心耳,并结扎降主动脉,然后开放生理盐水200~300 ml以100cmH2O 的压力进行快速灌注,排出全身血液直至右心耳流出液体清亮;再以4%中性多聚甲醛200~300 ml灌注,至大鼠四肢抽搐,变硬;灌注完毕后迅速开颅完整取出脑标本;置于4%多聚甲醛溶液中固定(4℃)24 h 后经液体石蜡包埋待测。
1.4 大鼠基底动脉的取材和HE染色
将标本分离出基底动脉和脑干后,常规石蜡包埋。于基底动脉的3个层面切取标本作HE 染色,基底动脉顶端下1mm,基底动脉中段,基底动脉底端上1mm 处,连续切片,片厚5μm。光镜下观察基底动脉的形态学变化。用显微镜计算机图像分析系统(Image-Proplus专业图像分析软件)计算血管截面的内径及其壁厚。通过基底动脉内径比较,判断血管有无痉挛及痉挛程度。CVS 值参照Liszczak法[5],计算如下:CVS值=(注血前BA 直径一注血后BA 直径)/注血前BA 直径×100%。CVS的评价方法,参照Handa 方法:无CVS 为CVS 值≤10%;轻度CVS为CVS值11%~30%;中度CVS为CVS 值31%~50%;重 度CVS 为CVS 值≥50%。
1.5 基底动脉壁MMP-9的免疫组化检测
石蜡切片脱蜡和水化后,用PBS(0.01 M,pH 7.5±0.1)冲洗3次,每次3 min;pH6.0柠檬酸缓冲液高温高压修复,每张切片加1 滴或50 ul过氧化酶阻断溶液,室温下孵育10 min,以阻断内源性过氧化物酶的活性;PBS 冲洗3 次,每次3 min,除去PBS液,每张切片加1滴或50 ul正常非免疫动物血清,室温下孵育10 min,除去血清,每张切片分别加1滴1∶100稀释的Rabbit Anti-MMP-9,室温下孵育60 min;PBS冲洗3次,每次3~5 min;除去PBS液,每张切片加1滴或50 ul生物素标记的第二抗体,室温下孵育10 min;PBS 冲洗3次,每次3 min;除去PBS 液,每张切片加1滴或50 ul链霉素抗生物素-过氧化物酶溶液,室温下孵育10 min;PBS冲洗3次,每次3 min,除去PBS液,每张切片加2滴或100 ul新鲜配制的DAB 溶液,显微镜下观察3~10min;自来水冲洗,苏木素复染,PBS 冲洗返蓝;判断标准:阳性染色为棕色或棕黄色。高倍镜(10×20)下观察每个血管壁内膜、中膜及外膜的染色情况,以无染色为阴性(-),轻度或局部染色为(+),全层重度或强烈染色为(+++),介于两者之间为(++)。
1.6 统计学处理
数据用均数±标准差(¯x±S)表示,采用SPSS 13.0软件。多组比较用单因素方差分析(one way ANOVA),两两比较在总体方差齐的条件下选用LSD 及Dunnett法进行分析。P<0.05为有统计学意义,P<0.01为统计学差异显著。
2 结 果
2.1 大体观察
正常组及对照组大鼠脑表面及血管周围均未见到积血,对照组也未见手术损伤;SAH 组l d 时可见在脑干腹侧、基底池、颅底脑表面明显积血,血块分布均匀;3 d时与SAH1d相比,蛛网膜下腔的积血吸收明显减少,但脑干腹侧仍可见少量残余积血,切开标本,侧脑室内仍可见少量积血;5 d 时蛛网膜下腔积血基本吸收,脑表面未见积血,可见轻度黄染;7 d 时蛛网膜下腔积血已吸收,脑表面见轻度黄染;14 d 时脑表面基本未见明显异常。
2.2 基底动脉HE 染色
2.2.1 形态学
光镜下正常组和对照组的基底动脉结构正常,呈椭圆形,管腔光滑,管壁较薄,内膜完整,内皮细胞无坏死脱落,排列平整,结构层次清楚,内弹力层平整,血管平滑肌呈扁平状。SAH1 d~7 d组均可见基底动脉结构不同程度改变,即血管壁增厚,管腔狭小,结构紊乱,内皮细胞变形、肿胀,内弹力膜迂曲皱折,厚薄不均,部分中膜变厚,平滑肌细胞排列紊乱,细胞外间质增多,内膜下及外膜可见炎细胞浸润,14 d 组基底动脉结构未见明显改变。
2.2.2 管壁厚度的变化
与相应对照组比较,SAH l、3、5 d 组血管壁有不同程度的增厚(P<0.01),其中3 d 组最为明显,约为对照组的1.7倍;14 d时管壁厚度基本正常(表1及图1)。
2.2.3 血管腔内径的变化
与对照组比较,SAH l、3、5 d组管腔内径明显减小(P<0.01),其中3d组的管腔狭窄最为明显(表1及图2)。通过计算CVS 值,评价各组CVS程度,l、5 d 时CVS 值 分 别 为11.56±2.50,16.25±4.14,表 现 为 轻 度CVS;3 d 时CVS 值 为32.98±2.87,表现为中度CVS;7、14 d时CVS值分别为5.68±1.70,0.99±3.28,表现为无CVS(表1及图2)。
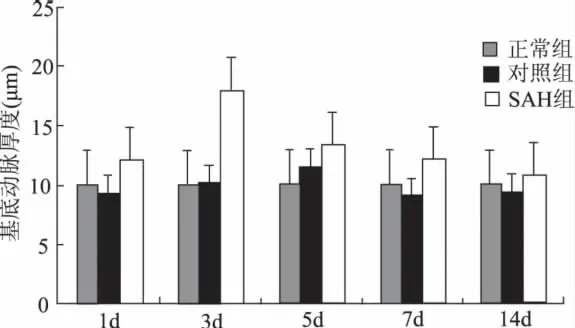
图1 各组大鼠基底动脉厚度的变化
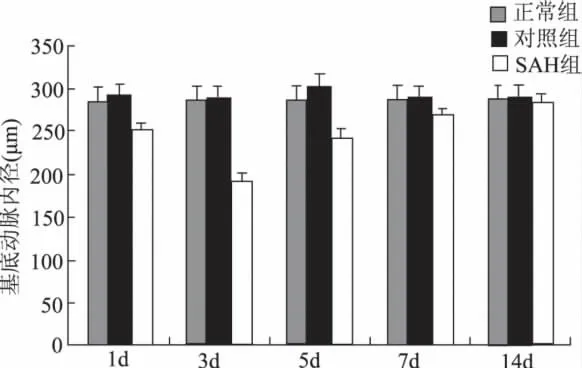
图2 各组大鼠基底动脉内径的变化
表1 各组大鼠基底动脉内径、动脉壁厚度(±s)以及CVS程度的比较
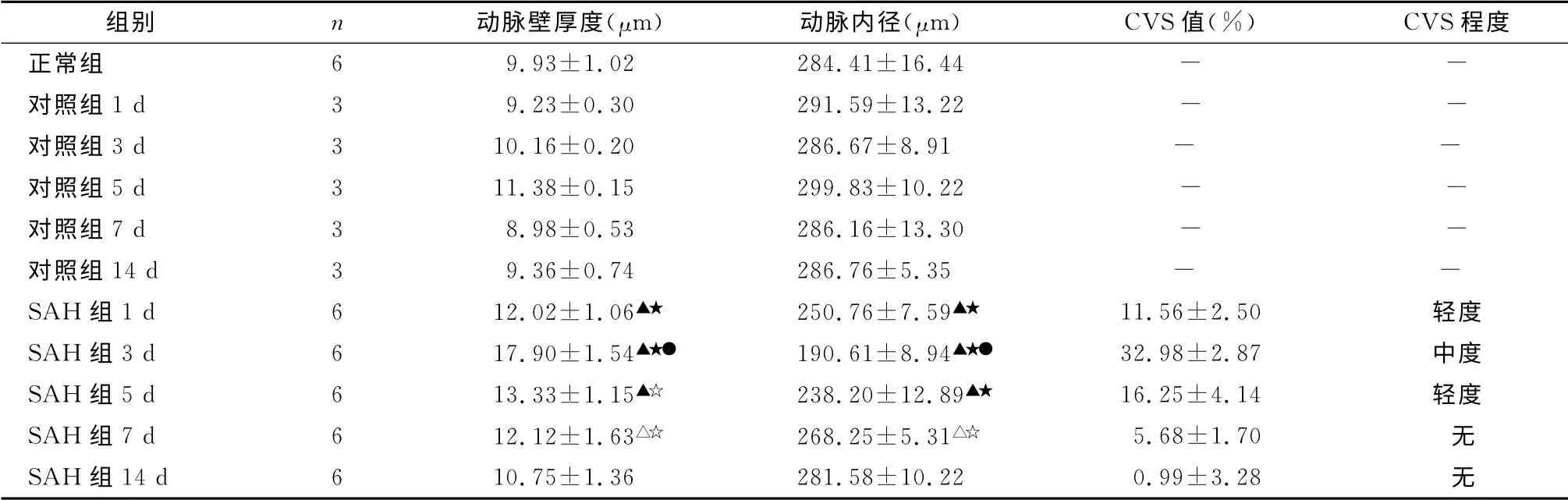
表1 各组大鼠基底动脉内径、动脉壁厚度(±s)以及CVS程度的比较
注:与正常组相比较,▲P<0.01,△P<0.05;与对应时间点对照组比较,★P<0.01,☆P<0.05;与SAH 组1,5,7,14 d比较,●P<0.01
组别 n 动脉壁厚度(μm) 动脉内径(μm) CVS值(%) CVS 程度正常组 6 9.93±1.02 284.41±16.44- -对照组1 d 3 9.23±0.30 291.59±13.22 - -对照组3 d 3 10.16±0.20 286.67±8.91 - -对照组5 d 3 11.38±0.15 299.83±10.22 - -对照组7 d 3 8.98±0.53 286.16±13.30 - -对照组14 d 3 9.36±0.74 286.76±5.35 - -SAH 组1 d 6 12.02±1.06▲★ 250.76±7.59▲★ 11.56±2.50 轻度SAH 组3 d 6 17.90±1.54▲★● 190.61±8.94▲★● 32.98±2.87 中度SAH 组5 d 6 13.33±1.15▲☆ 238.20±12.89▲★ 16.25±4.14 轻度SAH 组7 d 6 12.12±1.63△☆ 268.25±5.31△☆ 5.68±1.70 无SAH 组14 d 6 10.75±1.36 281.58±10.22 0.99±3.28无
2.3 MMP-9在基底动脉上的表达变化
免疫组化结果显示正常组的基底动脉壁的中膜层上仅在局部有极微弱的染色信号,内膜层、外膜层未见染色;在SAH1d 血管壁已有较明显免疫染色信号,主要在中膜及内膜,外膜也可见到散在的染色信号;在SAH3d 则在中膜及内膜下有强烈的免疫染色,外膜可见中度染色;在SAH5d,SAH7d时染色信号开始减弱;SAH14d已基本恢复正常(表2)。
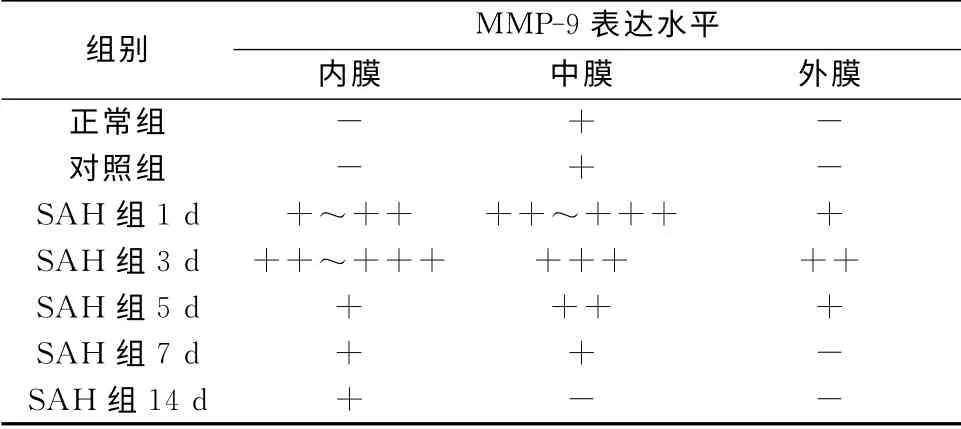
表2 大鼠基底动脉壁MMP-9的表达水平
3 讨 论
自发性SAH 是具有高病死率和高病残率的临床危重症,主要是由颅内动脉瘤破裂引起。据统计,每年每100000中约10人会发生颅内动脉瘤破裂引起SAH[6]。再出血和脑血管痉挛是SAH 后患者死亡和病残的两大主要原因。通过术前镇静,控制血压,积极的开颅手术夹闭和介入栓塞治疗可以较好地控制颅内动脉瘤再破裂出血。脑血管痉挛的发生率约为30%~70%,其中30%左右的患者可引起脑缺血症状,部分患者可致严重的脑梗死。CVS发病机制尚未明确,现考虑主要为两个方面共同作用的结果:脑血管收缩作用的增强和舒张作用的减弱。氧和血红蛋白的氧化产物和内皮素均影响钙离子通道的活性,升高细胞内钙离子的水平,使平滑肌细胞收缩增强,氧和血红蛋白还可以活化PKC 和RHO激酶使平滑肌细胞收缩增强,同时它还可以抑制NO 合成酶,灭活NO,引起NO 水平下降,导致血管舒张作用减弱。同时有研究表明SAH 后血管平滑肌和成肌纤维细胞增殖,同时伴有细胞坏死及血管壁重构,SAH 后内皮的增生和胶原的沉积、纤维化[7],提示SAH 后动脉壁出现增厚和顺应性下降也可能是脑血管舒张作用减弱的原因。动脉瘤性蛛网膜下腔出血后血管壁发生了器质性病理变化,伴随蛛网膜下腔出血的免疫炎性反应、血管壁细胞增殖与凋亡导致的血管壁损害可能是脑血管痉挛的关键病理途径。近年来发现基质金属蛋白酶-9 与脑血管病关系密切,MMP-9 可降解细胞外基质(extracellular matrixc,ECM),参与结缔组织的降解和重建、炎性反应和缺血缺氧损伤等病理过程,在颅内动脉瘤相关病理过程中发挥重要作用。最近Mc-Girt等[8]研究发现SAH 后血清血管性血友病因子(von Willebrand factor,vWF)、MMP-9和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)浓度能有效预测迟发性CVS 的 发 生[8],Solveig等研究发现SAH 后患者血清中MMP-9水平升高,存在血管痉挛的患者血清MMP-9 水平更高[9],提示MMP-9 与CVS的发生发展可能有关系。但有关SAH 后MMP-9水平与SAH 后血管痉挛的关系尚未见报道。
本研究结果显示SAH 后基底动脉壁MMP-9表达上调,3~5 d表达持续在一个较高的水平,随后开始下降,14 d基本恢复正常,与脑血管痉挛发生时相基本一致,提示MMP-9在SAH 后CVS 的发病机制中可能起着非常重要的作用。
目前MMP-9与动脉瘤性SAH 的研究大多集中在SAH 后早期脑损伤方面,MMP-9可能通过降解层粘连蛋白参与早期脑损伤[10],但MMP-9与动脉瘤性SAH 后CVS 的关系报道很少。本研究结果显示基质金属蛋白酶-9可能在SAH 后迟发性脑血管痉挛中发挥作用,MMP-9可能参与了CVS的病理过程。其可能机制为MMP-9通过降解脑血管周围基膜主要成分IV,V 型明胶原、层粘连蛋白、纤维连接蛋白等参与细胞凋亡引起血管壁的病理性器质性变化,使脑血管壁增厚,顺应性下降,从而使血管的舒张性减弱,血管痉挛。但其究竟如何引起脑血管痉挛目前尚不太清楚,需进一步研究。
1 YamaguchiM,Jadhav V,ObenausA,et al.Matrix metalloproteinase inhibition attenuates brain edema in an in vivo model of surgically-induced brain injury.Neurosurgery,2007,61(5):1067-1076.
2 Caird J,Napoli C,Taggart C,et al.Matrixmetallop roteinases 2 and 9 in human atherosclerotic and non-atherosclerotic cerebral aneurysms.Eur J Neurol,2006,13(10):1098-1105.
3 Zongduo Guo,Xiaochuan Sun,Zhaohui He,et al.Role of matrix metalloproteinase-9 in apoptosis of hippocampal neurons in rats during early brain injury after subarachnoid hemorrhage.Neurol Sci,2010,31(2):143-149.
4 Zongduo Guo,Xiaochuan Sun,Zhaohui He,et al.Matrix metalloproteinase-9 potentiates early brain injury after subarachnoid hemorrhage.Neurological Research,2010,32(7):715-720.
5 Liszezak TM,Varsos VG,Back PM,et al.Cerebral arterial contraction after experimental subarachnoid hemorraghe is associated with blood components within the arterial wall.Neurosurg,1983,58(1):18-25.
6 Pfohman M,Criddle LM.Epidemiology of intracranial aneurysm and subarachnoid hemorrhage.J Neurosci Nurs,2001,33(1):39-41.
7 Megyesi JF.Findlay JM.In vivo animal models of Cerebral vasospasm:a review.Acta Neurochirurgica-Supplement,2001,77:99-102.
8 McGirt MJ,Lynch JR,Blessing R,et al.Serum von Willebrand Factor,matrix metalloproteinase-9,and vascular endothelial growth factor levels predict the onset of cerebral vasospasm after aneurysmal subarachnoid hemorhage.Neurosurg,2002,51(5):1128-1135.
9 Horstmann S,Su Y,Koziol J,et al.MMP-2 and MMP-9levels in peripheral blood after subarachnoid hemorrhage.J Neurol Sci,2006,251(1-2):82-86.
10 Zongduo Guo,Xiaochuan Sun,Zhaohui He,et al.Matrix metalloproteinase-9 potentiates early brain injury after subarachnoid hemorrhage.Neurological Research,2010,32(7):715-720.

