噬菌体表面展示文库筛选人干细胞因子模拟肽
苏 林,孔 燕,刘长征,杨克恭,陈松森
1中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京100005
2北京大学临床肿瘤学院 北京肿瘤医院暨北京市肿瘤防治研究所肾癌和黑色素瘤内科,北京100036
人干细胞因子 (human stem cell factor,hSCF)是一种重要的造血细胞因子,主要作用于早期的造血干细胞和原始造血祖细胞,促进其增殖和分化。重组hSCF已用于临床,主要治疗贫血和肿瘤放化疗所致的骨髓抑制[1-2]。然而临床研究显示,部分患者使用重组hSCF会产生类过敏性反应,影响了其临床应用。业已证实,一些细胞因子和其受体的相互作用只需少量氨基酸残基的参与,由关键残基组成的短肽能够模拟蛋白质上的决定簇[3-5],这使得设计小分子细胞因子模拟肽成为可能。与细胞因子相比,模拟肽具有相对分子质量小、免疫原性低、易于合成、不良反应小、可通过口服途径使用等优点,在药物合成领域具有广阔潜在的应用前景。迄今为止,造血细胞生长因子中具有人红细胞生成素 (erythropoietin,EPO)、人血小板生长因子 (thrombopoitin,TPO)及鼠粒细胞集落刺激因子 (granulocyte-colony stimulating factor,G-CSF)生物活性的模拟肽已广泛研究[6-9],但尚未见具有hSCF生物活性模拟肽的报导。本研究以基因工程方法表达的hSCF受体[10-11]为靶蛋白,从噬菌体随机肽库中筛选出具有hSCF生物学活性的模拟肽,以期为深入研究hSCF模拟肽作用机制和临床应用的可行性奠定基础。
材料和方法
材料噬菌体展示文库:ph.D-C7CTM(1.2×1013pfu/ml,复杂度 =1.3×109转化子),ph.D-12TM(1.5×1013pfu/ml,复杂度 =2.7×109转化子),-28 gⅢ测序引物、-96 gⅢ测序引物、单链M13 DNA M13mp18均购自美国NEB公司;辣根过氧化物酶 (horseradish peroxidase,HRP)标记的抗-M13单克隆抗体购自美国Amersham公司。西安华辰生物科技有限公司合成小肽,PAGE纯化。基因重组hSCF(rhSCF)为成都地奥九泓制药厂产品;四甲基偶氮噻唑盐 [3-(4,5-dimethylthiazol-2-yl)2,5-diphenyltetrazolium bromide,MTT]购自美国Invitrogen公司;真核细胞中表达人干细胞因子受体 (c-Kit)配体结合区膜外N端1-3免疫球蛋白样结构域 (c-Kit/Igl-3)为本室研制。
细胞株UT-7细胞 (人类原巨核细胞白血病细胞)在37℃、5%CO2及饱和湿度下,添加0.4U/ml EPO的完全培养基 (RPMI-1640,含100U/ml青霉素、100μg/ml链霉素、10%胎牛血清)中培养。
酶联免疫吸附法筛选噬菌体文库以rc-Kit/Ig1-3为靶蛋白,分别对噬菌体环七肽库和十二肽库进行3轮筛选。第1轮筛选:将rc-Kit/Ig1-3蛋白溶解在包被缓冲液中,终浓度100 μg/ml,包被于96孔板中,4℃过夜;弃去包被液,封闭液 (5%脱脂奶粉)室温封闭1 h;弃去封闭液,加入10 μl原始文库和90 μl TBST(TBS+0.1%Tween-20),混匀后室温孵育1 h;每孔加入100 μl洗脱缓冲液 (0.2 mol/L Glycine-HCl pH 2.2,1 g/L BSA)洗脱; 加15 μl 1 mol/L Tris-HCl(pH9.1)中和洗脱缓冲液。将洗脱液扩增、纯化和测滴度。将纯化好的噬菌体进行下一轮筛选。第2轮筛选:取适量第1轮筛选扩增的洗脱产物,重复上述步骤,包被时将rc-Kit/Ig1-3终浓度降为75 μg/ml,在清洗步骤中将Tween-20的浓度增至0.2%。第3轮筛选:取适量第2轮筛选扩增的洗脱产物,重复上述步骤,包被时将rc-Kit/Ig1-3终浓度降为50 μg/ml,在清洗步骤中将Tween-20的浓度增至0.5%。
噬菌体滴度测定在LB培养基中准备10倍系列稀释的噬菌体。接E.coliER2738单菌落于3 ml LB培养基中,摇床培养至对数中期,分成200 μl等份于微量离心管中,每个噬菌体稀释度1管,每管加入10 μl不同稀释度的噬菌体,快速振荡混匀,室温温育5 min。将感染细胞加入45℃预温的上层琼脂培养管中混匀,立即倾注于37℃预温的LB/IPTG/Xgal琼脂平板上,待平板冷却后,倒置于37℃培养过夜。选择约有102个噬菌斑的平板,并对平板上的噬菌斑进行计数。然后用此数目乘以稀释因子即得到每10 μl噬菌体的空斑形成单位(pfu),即为其滴度。
酶联免疫吸附法检测噬菌体与rc-Kit/Ig1-3的结合力用10 μg/ml的rc-Kit/Ig1-3包被96孔板,每个待鉴定克隆设3个复孔,另设3个BSA包被孔作为对照,4℃包被过夜。加封闭液4℃ 2 h。TBST洗板,对噬菌体进行梯度稀释,将稀释好的噬菌体加入包被有c-Kit/Ig1-3及对照的孔中。室温振荡作用2 h。TBST洗板后,加入1∶5000比例稀释的HRP标记抗-M13抗体,室温振荡作用1 h。加入100 μl HRP底物溶液,室温作用10 min,加入2 mol/L H2SO4终止反应,用酶标仪记录495 nm处的吸光值。在竞争性酶联免疫吸附测定 (enzyme-linked immunosorbent assay,ELISA)中,每个克隆设6个孔,每孔预先包被rc-Kit/Ig1-3,然后加入噬菌体克隆,使其结合,其中3孔加入rc-Kit/Ig1-3溶液,3孔加入BSA溶液作为对照,以HRP标记的M13单克隆抗体检测,最后测定每孔的OD450值。
噬菌体单链DNA提取将ER2738过夜培养物按1∶100稀释接种于LB培养基,分1 ml到培养管中,用灭菌牙签挑一蓝色噬菌斑接种于上述1 ml培养管中,37℃摇床培养5 h,培养物转入微量离心管中,离心30 s。将含噬菌体上清转入一新鲜离心管。加入200 μl PEG/NaCl,颠倒混匀,室温放置10 min。9000 g离心10 min,沉淀物彻底重悬于100 μl碘化物缓冲液中,加入 250 μl乙醇。室温温育 10 min,9000 g离心10 min,用70%的乙醇洗沉淀,抽干,沉淀重悬于30 μl TE中,使用-28 gⅢ或-96 gⅢ引物进行核苷酸序列测定。
合成小肽的生物学活性测定取对数期生长的UT-7细胞,PBS洗涤2次后显微镜下计数,将细胞浓度调整为6×105/ml,按照每孔50 μl将上述细胞悬液添加到96孔板孔中,再加入50 μl用完全培养基梯度稀释的合成肽溶液,选用rhSCF作为阳性对照,完全培养基作为阴性对照。37℃培养40 h,每孔加入 20 μl 5 g/L MTT,37℃ 培养 4 h,加入 100 μl 10%的酸化异丙醇 (9 ml异丙醇+1 ml Triton X-100+86.2 μl盐酸),吹打溶解结晶,测OD570值。
统计学处理采用SPSS 13.0统计软件,数据以均值±标准差表示,活性比较采用t检验,P<0.05为差异有统计学意义。
结 果
ELISA方法筛选噬菌体展示肽库以rc-Kit/Ig1-3为靶蛋白,包被ELISA平板,分别加入噬菌体环七肽库和十二肽库进行筛选,在筛选过程中,通过计算每一轮加入的噬菌体和得到的噬菌体的比,可以显示富集的程度。结果显示,筛选使结合的噬菌体得到了富集 (表1、2)。
噬菌体ELISA方法筛选高结合力单克隆经3轮筛选获得具有与rc-Kit/Ig1-3结合活性的噬菌体克隆共19个,其中从环七肽库筛选到11个 (CE3、CE4、 CE6、 CE12、 CE15、 CE16、 CE17、 CE19、CE21、CE23、CE24),从十二肽库筛选到 8个(LE3、 LE4、 LE5、 LE10、 LE14、 LE15、 LE20、LE23)(图1)。
噬菌体克隆与靶蛋白的结合特异性验证挑选出11个与rc-Kit/Ig1-3结合活性较高的噬菌体单克隆(CE3、 CE12、 CE15、 CE16、 CE21、 CE23、 LE5、LE10、LE14、LE15、LE20)进行竞争性 ELISA实验,结果显示,与BSA相比,c-Kit/Ig1-3能够竞争性抑制噬菌体克隆与c-Kit/Ig1-3的结合 (图2)。

表2 c-Kit/Ig1-3筛选噬菌体十二肽库Table 2 Results of phage dodecapeptide library bio-panning with c-Kit/Ig1-3 as probe
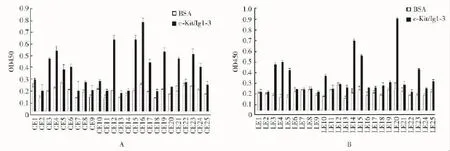
图1 ELISA筛选高亲和力的噬菌体单克隆Fig 1 Phage clones with higher c-Kit/Ig1-3 or BSA-binding activity were detected using ELISA
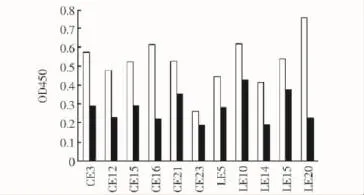
图2 竞争性ELISA检测噬菌体克隆与c-Kit/Ig1-3结合的特异性Fig 2 Specific binding of phage clones to c-Kit/Ig1-3(black bars)or BSA(white bars)detected using competitive ELISA
高结合活性的噬菌体克隆测序结果选取与靶蛋白有较高结合活性的19个噬菌体克隆提取单链DNA,进行序列测定,结果显示环七肽库具有1个共有序列DPSPHTH,十二肽库没有共有序列 (核苷酸用三联字母表示,氨基酸用单字母表示)(表3)。经过比对,这些小肽与hSCF没有同源序列。利用NCBI PROTEIN BLAST分析也未发现与以上小肽完全一致的序列。
合成肽选择与c-Kit/Ig1-3结合活性较高的环七肽 CE3(CS1)、CE16(CS2)和十二肽 LE4(LS1)、LE20(LS2)进行化学合成。合成小肽的质谱分析结果显示,其相对分子质量依次为995.79、878.34、1399.35、1422.56,均与预期一致。4个小肽的序列如下:CS1:CDPSPHTHC;CS2:CPSSLTPAC;LS1:AVSSFERDNFVQ;LS2:THSFIPRLPLLK。
合成肽体外活性测定合成肽用无菌水溶解,分别用完全培养基稀释到540、180、60 μmol/L,然后加入96孔板培养的UT-7细胞中孵育,以SCF(5nmol/L)作为阳性对照,完全培养基作为阴性对照,检测小肽刺激UT-7细胞增殖的活性。结果显示,4种小肽均能促进UT-7细胞增殖,当浓度较高时,CS2和LS2活性明显高于阴性对照 (P<0.05或P<0.01)(图3);但明显低于阳性对照。
讨 论
噬菌体随机肽库是利用噬菌体展示技术[12-13],将随机编码短肽的外源基因克隆到噬菌体载体中,使外源基因与噬菌体表壳蛋白pⅢ或pⅧ以融合的形式展示在噬菌体表面,构建具有高库容量 (目前可达109)的噬菌体展示多肽集合体。利用生物淘选的方法,对噬菌体肽库进行筛选,对筛选出的噬菌体克隆进行单链DNA的序列测定,从DNA序列推测氨基酸序列,然后进行短肽的生物合成。这种技术在蛋白质的基因型和表型之间建立了1个物理连接,实现了蛋白质遗传型和表型之间的互换,简化了蛋白质分子文库筛选与鉴定过程,因此该技术在确定蛋白质分子之间相互作用位点,寻找高亲和力的配体小分子,探索未知蛋白质空间结构表位等方面已有广泛应用。以细胞因子/生长因子受体作为靶分子,利用噬菌体随机肽库筛选配体模拟肽的研究备受人们关注。在造血细胞生长因子中,最为成功的是hEPO、hTPO模拟肽的获得和研究,PEG修饰或与Fc融合的hTPO模拟肽Romiplostin(ANG-531)和hEPO模拟肽Hematide(AF37702)已被美国食品药品监督管理局批准进行临床试验[9,14-15],非肽型小分子hG-CSF受体拮抗物 (SB247464)是从有机化合物中分离出来[16]。张力群等[7]用噬菌体随机肽库展示技术筛选出具有鼠G-CSF活性的模拟肽。但迄今为止,尚未见具有hSCF模拟肽的报道。hSCF又称为肥大细胞生长因子,除能刺激造血干祖细胞的增殖分化外,还能刺激肥大细胞增殖。临床研究显示,应用rhSCF后部分患者产生类过敏反应,影响了临床使用。利用噬菌体展示技术,寻找具有hSCF生物活性的小肽,减少hSCF的不良反应,具有实际意义。本研究在这方面做了探索,采用噬菌体表面展示文库技术,经优化成功地从环七肽库和十二肽库中筛选到4个具有hSCF生物活性的小肽,其中CE16(CS2)和LE20(LS2)活性较高。尽管此实验结果有待于体内实验进一步确证,但其为开发具有hSCF功能的新型小分子肽以代替目前临床应用的有较强不良反应的rhSCF提供了新的线索,并为深入研究hSCF模拟肽的作用机制奠定了基础。

表3 噬菌体克隆测序Table 3 Sequences of phage clones
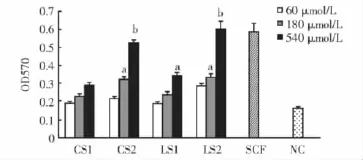
图3 MTT法测定小肽活性Fig 3 The activity of synthesized peptides determined by MTT assay
[1]李元,陈松森,王渭池.基因工程药物 [M].2版.北京:化学工业出版社,2007:147-153.
[2]Wadhwa M,Thorpe R.Haematopoietic growth factors and their therapeutic use [J].Thromb Haemost,2008,99(5):863-873.
[3]Geyson HM,Wagner CD,Bodnar WM,et al.Isotope or mass encoding of combinatorial libraries [J].Chem Biol,1996,3(8):679-688.
[4]Banner DW,D'Arcy A,Janes W,et al.Crystal structure of the soluble human 55 kd TNF receptor-human TNF beta complex:implications for TNF receptor activation [J].Cell,1993,73(3):431-445.
[5]Olsen SK,Ota N,Kishishita S,et al.Crystal structure of the interleukin-15.interleukin-15 receptor alpha complex:insights into trans and cis presentation [J].J Biol Chem,2007,282(51):37191-37204.
[6]Wrighton NC,Farrell FX,Chang R,et al.Small peptides as potent mimetics of the protein hormone erythropoietin [J].Science,1996,273(5274):458-464.
[7]张力群,王清明,范国才,等.具有G-CSF活性的噬菌体展示肽 [J].中国生物化学与分子生物学学报,2004,20(6):768-772.
[8]Cwirla SE,Balasubramanian P,Duffin DJ,et al.Peptide agonist of the thrombopoietin receptor as potent as the natural cytokine [J].Science,1997,276(5319):1696-1699.
[9]Kuter DJ.Thrombopoietin and thrombopoietin mimetics in the treatment of thrombocytopenia [J].Annu Rev Med,2009,60:193-206.
[10]苏林,刘长征,陈松森,等.人干细胞因子受体膜外区1~3免疫球蛋白样结构域的表达、纯化及活性 [J].中国医学科学院学报,2006,28(2):154-158.
[11]熊安琪,陈松森,狄旭,等.人干细胞因子受体c-Kit稳定表达细胞株的构建[J].中国生物化学与分子生物学报,2001,17(4):478-482.
[12]Cesareni G.Peptide display on filamentous phage capsids:A new powerful tool to study protein-ligand interaction [J].FEBS letters,1992,307(1):66-70.
[13]Paschke M.Phage display systems and their applications[J].Appl Microbiol Biotechnol,2006,70(1):2-11.
[14]Perugini M,Varelias A,Sadlon T,et al.Hematopoietic growth factor mimetics:from concept to clinic[J].Cytokine Growth Factor Rev,2009,20(1):87-94.
[15]Albanese P,Caruelle D,Frescaline G,et al.Glycosaminoglycan mimetics-induced mobilization of hematopoietic progenitors and stem cells into mouse peripheral blood:structure/function insights [J].Exp Hematol,2009,37(9):1072-1083.
[16]Tian SS,Rosen J,King AG,et al.A small,nonpeptidyl mimic of granulocyte-colony stimulating factor [J].Science,1998,281(5374):257-259.

