人脐带间充质干细胞的生物学特性和超微结构
朱少芳,何援利,付霞霏
南方医科大学附属珠江医院妇产科,广州510282
随着对间充质干细胞 (mesenchymal stem cell,MSC)的研究逐渐深入,人们发现MSC在脊髓损伤[1]、大面积骨缺损[2]、糖尿病肾病[3]和卵巢早衰[4]等众多领域均可发挥重要的作用。而干细胞的来源,也由当初单纯的骨髓[5]来源,发展到从脂肪[6]、皮肤[7]、脐带血[8]、胚胎[9]等组织中提取。但是,这些来源的MSC各有其优缺点,如:骨髓MSC的提取对患者可造成二次损伤,致瘤性、病毒及细菌污染较高;脐带血中提取的MSC量少,免疫原性高;胚胎来源的干细胞存在明显的伦理争议,培养困难[10];脂肪来源的干细胞在细胞周期动力学变化及异常核型发展方面,有可能导致恶性细胞转化[11]。本研究分离和培养了人脐带 MSC,观察了MSC的生物学特性和超微结构,探讨了其在临床上的应用前景。
材料和方法
试剂和仪器DMEM-F12培养基、胰酶、胎牛血清购自美国HyClone公司,细胞计数试剂盒 (cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司、血管内皮细胞生长因子 (vascular endothelial growth factor,VEGF)、类胰岛素生长因子-1(insulinlike growth factors-1,IGF-1)、肝细胞生长因子 (hepatocyte growth factor,HGF)酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国ADL公司,Annexin-V-FITC细胞凋亡检测试剂盒购自美国pharmingen公司。CO2培养箱购自日本三洋公司,流式细胞仪 (BD-FACSCALIBUR)购自美国BD公司。
脐带MSC的原代培养取足月妊娠剖宫产健康胎儿的脐带,在超净台内以PBS充分冲洗,除去脐静脉及动脉内的残存血并剔除动静脉血管。将脐带剪成长度约1.0 cm小段,经匀浆处理至1~2 mm大小,置于含10%胎牛血清的DMEM培养液中,在5%CO2、37℃饱和湿度培养箱中培养。第1次传代后每3 d按1∶3比例传代,进行扩增培养。
脐带MSC的免疫表型分析取第2代脐带MSC,胰酶消化后制成单细胞悬液,分别加入抗人IgG-FITC、CD19-FITC、CD31-FITC、CD34-FITC、CD 90-FITC、 IgG-PE、 CD29-PE、 CD44-PE、 CD45-PE、CD73-PE、CD105-PE、CD166-PE、HLA-DR-PE等单抗各5 μl,以小鼠 IgG1为阴性对照。4℃孵育30 min,采用流式细胞仪进行免疫表型检测。
脐带MSC增殖能力检测采用96孔板,由于96孔板周围1圈容易蒸发,采用弃用周围1圈的办法,改加培养液。每孔加入100 μl(1200个细胞),每天测5孔,连续测7 d,测前每孔加入10 μl的cck-8溶液,在细胞培养箱内继续孵育1 h。在450 nm测定吸光度。其中以加了相应量培养液但没加入细胞的孔为空白对照组。
脐带MSC的凋亡检测取第2代脐带MSC,采用4℃预冷的PBS洗细胞2次,结合缓冲液重新悬浮细胞,调节浓度至 1×106/ml。取 100 μl细胞悬液于5 ml流式管中,加入5 μl Annexin V/FITC和 10 μl 20 μg/ml的碘化丙锭溶液,混匀后于室温避光孵育15 min。在反应管中加入400 μl PBS,采用流式细胞仪分析细胞凋亡情况。
脐带MSC细胞周期的检测取第2代脐带MSC,胰酶消化为单个细胞,计数每份标本细胞量达1×106,离心后去上清液,加入-20℃预冷的75%乙醇固定,上机前再次离心去上清液,加入RNA酶去除RNA,加入PI染料4℃避光染色30 min.流式细胞仪检测细胞周期各个时相所占百分比。
脐带MSC细胞内部结构观察取第2代细胞进行培养,待细胞铺满培养瓶后,PBS冲洗,细胞刮子将细胞刮落,1000 r/min(r=18 cm)离心10 min,常规透射电镜标本处理后,在Philip CM-10透射电镜下观察细胞内部的超微结构。
脐带MSC VEGF、IGF-1、HGF分泌水平检测以完全培养基 (含10%胎牛血清的DMEM培养液)作为对照,取2代脐带MSC接种于培养瓶中,每瓶5×105个细胞,换用完全培养基 (含10%胎牛血清的DMEM培养液)培养24 h后,收集细胞培养基,离心后采用ElISA法进行检测。
结 果
脐带MSC的形态观察及生长情况原代培养的脐带MSC为贴壁细胞,培养72 h后,细胞均呈梭形,有胞浆突起,为成纤维细胞样,胞浆丰富,核大,呈平行排列或旋涡状生长,漩涡中心细胞多层分布 (图1)。传代后细胞生长迅速,约3~4 d即可铺满全层。培养细胞可稳定传代。
脐带MSC免疫表型分析结果流式细胞仪分析结果显示,培养的MSC可表达CD29、CD44、CD73、CD105、CD166、CD90,不表达 IgG、CD19(B细胞抗原)、CD31(内皮细胞抗原)、CD34(造血干细胞抗原)、CD45(白细胞共同抗原)和HLA-DR(MHC-Ⅱ)(图2)。
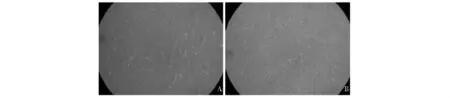
图1 倒置相差显微镜下原代培养的人脐带间充质干细胞不同时段的形态 (×400)Fig 1 The morphologies of primary human umbilical cord mesenchymal stem cells under inverted phase-contrast microscope(×400)
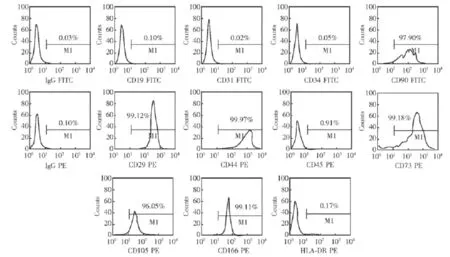
图2 脐带间充质干细胞的免疫表型分析结果Fig 2 Immunophenotyping results of human umbilical cord mesenchymal stem cells
脐带MSC增殖能力检测结果培养1~2 d,细胞生长较慢,为生长潜伏期;培养3~6 d,细胞生长速度增快,为对数生长期;此后细胞进入生长平台期。在对数生长期中,细胞的倍增时间为 (2.560±0.117)d(图3)。
脐带MSC的凋亡检测结果脐带MSC中正常细胞比例为80.26%,早期凋亡细胞占1.39%,坏死和凋亡细胞占12.56%,死亡细胞占5.80%(图4)。
脐带MSC的细胞周期检测结果脐带MSC中,G0/G1期细胞所占比率为67.48%,S期细胞为32.52%,G2/M期细胞为0(图5)。
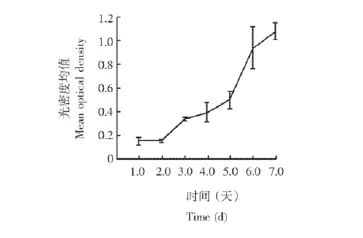
图3 人脐带间充质干细胞的生长曲线Fig 3 The growth curve of cultured human umbilical cord mesenchymal stem cells
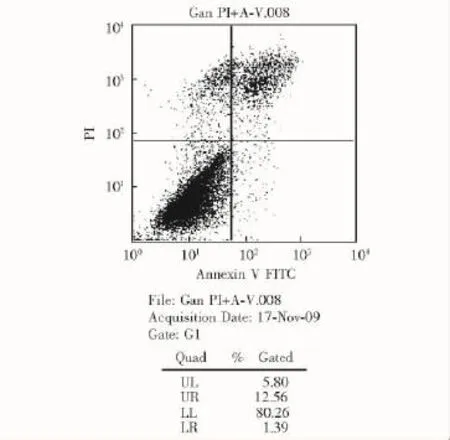
图4 人脐带间充质干细胞的凋亡比率流式图Fig 4 The apoptosis of human umbilical cord mesenchymal stem cells
脐带MSC的内部结构透射电镜下见脐带MSC呈长梭形,细胞膜完整,细胞表面可见散在的类似微绒毛结构,细胞间连接可见点状桥粒与带状桥粒和紧密连接形成连接复合体。细胞多为单核,偶见双核,核浆比例大,核膜清晰,见核内外膜,外膜外表面附有核糖体,核仁1个或多个,由核仁丝缠绕成海绵球体状,少量的异染色质分布在核周边区,常染色质占多数,是间期核处于伸展部位的染色质,部分细胞可见核仁边集现象。胞浆内可见散在的粗面内质网,具有丰富的游离核糖体,部分细胞可见自噬泡 (图6)。
脐带MSC中VEGF、IGF-1和HGF水平检测结果脐带MSC中的HGF、VEGF和IGF-1水平分别为 (54.760±1.455)pg/ml、(9.029±0.047)ng/ml和 (21.744 ±1.514)pg/ml。

图5 人脐带间充质干细胞的细胞周期流式图Fig 5 The cell cycle composition of human umbilical cord mesenchymal stem cells
讨 论
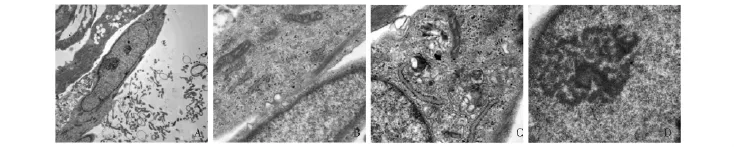
图6 透射电镜下的人脐带间充质干细胞Fig 6 The ultrastructure of human umbilical cord mesenchymal stem cells under transmission electron microscope
目前,MSC在临床治疗中所起的作用越来越受到重视,但对于如何寻找MSC的理想来源仍是困扰人们的一个难题。脐带是胎儿附属物,来源广泛丰富,从脐带华通胶中提取的MSC取材方便,相对纯净,致瘤性和病毒、细菌污染可能性均较骨髓MSC低,不表达或低表达免疫排斥相关标记,免疫原性低,是一类免疫缺陷细胞[12],异体移植无免疫排斥反应或反应较弱,且在临床应用上还避免了胚胎干细胞的伦理争议,有望成为临床治疗中的理想种子细胞。因此,本研究从脐带中提取MSC,深入研究了其生物学特性,以期扩展其在临床治疗中的应用。结果发现,脐带MSC细胞形态与骨髓MSC相似,均呈平行排列或漩涡样生长,绝大部分形态类似成纤维细胞。传代细胞2~3 d可增殖1倍,培养细胞可稳定生长传代,细胞增殖活跃,具有较强的自我更新能力。透射电镜也进一步证实其细胞器丰富,核浆比例大,甚至可见多个核仁,表明细胞代谢活跃,分化程度低,且细胞表面见微绒毛,可增加细胞的吸附能力和吸收能力。ELISA检测则证实脐带 MSC能分泌 VEGF、IGF-1、HGF等细胞因子,从而可促进血管内皮细胞的有丝分裂,增加血管通透性,增进单核细胞的趋化性,增加细胞外基质的分泌及抗细胞凋亡。有助于脊髓损伤[13]、缺血性脑卒中[14]、卵巢早衰[4]、组织工程骨的构建[15-16]及肾小球硬化[17]等临床治疗。
[1]Abrams MB,Dominguez C,Pernold K,et al.Multipotent mesenchymal stromal cells attenuate chronic inflammation and injury-induced sensitivity to mechanical stimuli in experimental spinal cord injury [J].Restor Neurol Neurosci,2009,27(4):307-321.
[2]Xu C,Su P,Wang Y,et al.A novel biomimetic composite scaffold hybridized with mesenchymal stem cells in repair of rat bone defects models [J].J Biomed Mater Res A,2010,95(2):495-503.
[3]Kang EM,Zickler PP,Burns S,et al.Hematopoietic stem cell transplantation prevents diabetes in NOD mice but does not contribute to significant islet cell regeneration once disease is established [J].Exp Hematol,2005,33(6):699-705.
[4]Fu X,He Y,Xie C,et al.Bone marrow mesenchymal stem cell transplantation improves ovarian function and structure in rats with chemotherapy-induced ovarian damage[J].Cytotherapy,2008,10(4):353-363.
[5]Cilloni D,Carlo-Stella C,Falzetti F,et al.Limited engraftment capacity of bone marrow-derived mesenchymal cells following T-cell-depleted hematopoietic stem cell transplantation [J].Blood,2000,96(10):3637-3643.
[6]de Girolamo L,Arrigoni E,Stanco D,et al.Role of autologous rabbit adipose-derived stem cells in the early phases of the repairing process of critical bone defects[J].J Orthop Res,2010,29(1):100-108.
[7]Blanpain C,Lowry WE,Geoghegan A,et al.Self-renewal,multipotency,and the existence of two cell populations within an epithelial stem cell niche [J].Cell,2004,118(5):635-648.
[8]Fasouliotis SJ,Schenker JG.Human umbilical cord blood banking and transplantation:a state of the art[J].Eur J Obstet Gynecol Reprod Biol,2000,90(1):13-25.
[9]Laslett AL,Filipczyk AA,Pera MF.Characterization and culture of human embryonic stem cells[J].Trends Cardiovasc Med,2003,13(7):295-301.
[10]Hoffman LM,Carpenter MK.Characterization and culture of human embryonic stem cells [J].Nat Biotechnol,2005,23(6):699-708.
[11]Røsland GV,Svendsen A,Torsvik A,et al.Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergospontaneousmalignant transformation[J].Cancer Res,2009,69(13):5331-5339.
[12]Fu YS,Cheng YC,Lin MY,et al.Conversion of human umbilical cord mesenchymal stem cells in Wharton's jelly to dopaminergic neurons in vitro:potential therapeutic application for Parkinsonism [J].Stem Cells,2006,24(1):115-124.
[13]Sharma HS.Neuroprotective effects of neurotrophins and melanocortins in spinal cord injury:an experimental study in the rat using pharmacological and morphological approaches[J].Ann N Y Acad Sci,2005,1053:407-421.
[14]Miyazawa T,Matsumoto K,Ohmichi H,et al.Protection of hippocampal neurons from ischemia-induced delayed neuronal death by hepatocyte growth factor:a novel neurotrophic factor[J].J Cereb Blood Flow Metab,1998,18(4):345-348.
[15]Kanczler JM,Oreffo RO.Osteogenesis and angiogenesis:the potential for engineering bone [J].Eur Cell Mater,2008,15:100-114.
[16]Kellner K,Schulz MB,Göpferich A,et al.Insulin in tissue engineering of cartilage:a potential model system for growth factor application [J].J Drug Target,2001,9(6):439-448.
[17]Matsumoto K,Nakamura T.Hepatocyte growth factor:renotropic role and potential therapeutics for renal diseases[J].Kidney Int,2001,59(6):2023-2038.

