食品中的蛋白质交联技术
李君文,赵新淮
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.滕州市粮食局,山东滕州277500)
食品中的蛋白质交联技术
李君文1,2,赵新淮1
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.滕州市粮食局,山东滕州277500)
综述了食品中的美拉德反应衍生的交联、二硫键交联反应、转谷氨酰胺酶交联反应、酪氨酸残基引发的交联反应、脱氢蛋白质交联等五种蛋白质交联技术以及研究进展,通过蛋白质交联可以提高蛋白质的功能性质和营养价值,从而扩大了蛋白质的应用范围。
蛋白质,交联技术,研究进展

图1 食品中蛋白质的交联反应种类
1 美拉德反应衍生的交联
美拉德反应主要是指食品中的还原糖与氨基酸、蛋白质之间的复杂反应。1912年,法国人Louis-Camille Maillard发现了这个反应,1953年Hodge等把这个反应正式命名为Maillard(美拉德)反应。
美拉德反应过程中,蛋白质交联会形成一系列的产物,在食品加工中由美拉德反应引起的交联蛋白研究得已经很清楚,但是这些交联产物的化学结构还不是很清楚。Jinq等[3]研究了酪蛋白和单糖(果糖、葡萄糖和核酸糖)间的美拉德反应,利用SDS-PAGE、MALDI-TOF质谱等测定不同的单糖-酪蛋白美拉德产物的荧光、紫外和酪蛋白分子质量的变化,得出3d后核酸糖-酪蛋白美拉德产物呈现出显著的荧光特性,而15d后葡萄糖、果糖-酪蛋白美拉德产物的紫外特性较为显著,同时质谱结果表明,酪蛋白和单糖间的美拉德反应产生了许多大分子量物质。Rufia′n-Henares等[4]利用糠氨酸对以牛奶为基料的运动营养补品进行质量评价,糠氨酸是赖氨酸美拉德反应的最适底物,常用于运动营养补品中一些成分的评价,结果表明,于干燥的运动营养补品中添加79mg糠氨酸/100g蛋白可以控制以牛奶为基料的产品的质量,过高的添加水平则会导致质量下降,不适宜保藏。Jimenez等[5]研究了β-乳球蛋白、α-乳白蛋白和牛血清白蛋白和葡聚糖间的美拉德反应,结果表明,美拉德反应产生的聚合物在低pH下溶解度有所增加,主要是多糖和蛋白质间的共价交联降低了蛋白质的等电点;在酸性条件下,乳清蛋白中不耐热的牛血清白蛋白和β-乳球蛋白热稳定性均有提高。因此通过控制乳清蛋白与葡聚糖间美拉德反应可以扩大其在食品加工中的应用范围,主要是其酸性条件下具有较好的热稳定性和乳化性能。
在碳水化合物含量较低的食品中,美拉德反应受到限制,而食品加工中剧烈的热处理过程,可使赖氨酸的ε-氨基与精氨酸或是谷氨酰胺残基缩合形成异肽键,使得蛋白质发生交联,然而这类交联还未被广泛的研究。
2 二硫键交联反应
二硫键交联是在食品蛋白质交联中最为普遍和最具有特征性的共价交联,二硫键的形成主要是通过合适的氧化剂氧化食品蛋白质基质中相邻的两个半胱氨酸残基,从而产生了二硫键交联,其交联机理如图2所示。
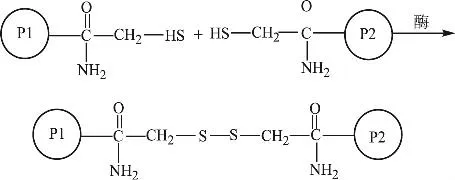
图2 二硫键交联反应机制
在一些食品蛋白质(如乳蛋白、大豆蛋白、鸡蛋蛋白、肉蛋白和蔬菜蛋白)的热致凝胶形成过程中,蛋白质分子间的二硫键交联对其凝胶性有着显著的影响。蛋白质分子共价交联形成的凝胶主要是生成了三维的类固体网络结构,从而赋予了食品更好的质地。Singh等[6]研究了热处理对牛奶的影响,通过形成二硫键,增强变性β-乳球蛋白和κ-酪蛋白之间的相互作用,从而增加牛奶及牛奶制品的稳定性,阻止β-乳球蛋白的沉淀。二硫键交联形成蛋白质网络结构,还可以提高生面团的粘弹性和结构特性,使面包呈现出更好的特性。Martin等[7]研究了葡萄糖氧化酶氧化生面团中的麦谷蛋白,结果表明,在过氧化氢存在的条件下,葡萄糖氧化酶催化麦谷蛋白中的游离巯基形成二硫键,改变了小麦生面团的流变学性质。Bonet等[8]将葡萄糖氧化酶对生面团以及其焙烤产品的影响作了进一步的研究。通过添加葡萄糖氧化酶可以改善小麦面团的流变学性质和面包的质量。利用毛细管电泳和电子扫描电镜分别从分子、超分子水平上观察样品中的谷蛋白,结果显示处理后样品中的谷蛋白(麦醇溶蛋白和麦谷蛋白)有二硫键形成,还有一些非二硫键形成。
3 转谷氨酰胺酶交联反应
转谷氨酰胺酶(Transglutaminase,EC 2.3.2.13,简称TG),是一种催化蛋白质分子内或分子间形成ε-(γ-谷氨酰基)赖氨酸共价键的酶,通过催化反应,可引起各种蛋白质分子内的交联、分子间的交联以及蛋白质与氨基酸之间的连接,形成高分子网络结构。主要是利用肽链上的谷氨酰胺残基的γ-甲酰胺基作为酰基供体,而酰基受体可以是[9](Folk,1980):
a.多肽链中赖氨酸残基的ε-氨基,形成蛋白质分子内和分子间的ε-(γ-谷氨酰基)赖氨酸异肽键(图3a),通过该反应蛋白质分子发生交联,使食品及其它制品产生质构变化,从而赋予产品特有质构特性和黏合性质。
要让文物的历史文化价值得到充分体现,作用得到充分的发挥,首当其冲的工作就是让文物“活起来”。实现这个目标,我们必须有效发掘出文物中隐藏的历史、艺术和科学等人文信息,同时通过科学、通俗、多元化的手段传递给广大的民众。实现这一点并不困难,这需要我们对文物进行由内而外的多层次探究,以及相关的文献和历史事实加以证明,将挖掘到的文物的价值和内涵使其有效地外化和具体化,并利用民众易于接受的方式,以及借助现代科技的手段,把历史的知识和内涵告诉民众,向所有的人阐述文物深层次下的故事。
b.伯胺基,形成蛋白质分子和小分子伯胺之间的连接(图3b),从而可将一些限制性氨基酸引入蛋白质中,以提高其营养价值。
c.当不存在伯胺时,水会成为酰基受体,结果是谷氨酰胺残基脱去氨基生成谷氨酸残基(图3c)。该反应可用于改变蛋白质的等电点及溶解度。
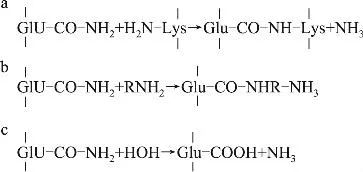
图3 谷氨酰胺转胺酶的催化反应机理
转谷氨酰胺酶早已广泛地应用于催化食品蛋白质交联,改善蛋白质的功能性质。李红[10]利用谷氨酰胺转胺酶生产大豆蛋白食用保鲜膜,研究了添加转谷氨酰胺酶对大豆蛋白成膜特性的影响,结果表明,利用转谷氨酰胺酶生产的大豆蛋白食用保鲜膜,有较好的水蒸气阻隔性能和隔油性,能达到食品保鲜的要求。刘心伟[11]利用微生物转谷氨酰胺酶处理的乳蛋白质,乳蛋白质分子间发生聚合作用,且这些聚合物不易发生聚集,从而提高乳化性。αs1-酪蛋白、γ-酪蛋白等经转谷氨酰胺酶催化后发生交联,可以作为优良的乳化剂应用于乳品生产中。Farnsworth等[12]以转谷氨酰胺酶对山羊乳酪进行改性,结果表明添加了转谷氨酰胺酶的山羊乳酪的黏度有所改善,优于添加总固形物的方法;通过扫描电子显微镜观察处理前后的样品,处理后样品的微观结构更为紧密,说明添加转谷氨酰胺酶可以提高乳酪凝胶的微观结构。Hinz等[13]以转谷氨酰胺酶对全脂乳和脱脂乳进行改性,对乳中脂肪球的稳定性和乳蛋白的乳化性质进行研究。结果表明,酶处理对乳蛋白的乳化性质有很大影响,乳中脂肪球的稳定性得到提高。Huppertz等[14]将转谷氨酰胺酶催化交联酪蛋白胶束,通过共价键连接形成酪蛋白网络得到纳米胶微粒,与热致凝胶相比,所形成的纳米胶微粒的稳定性有所提高。
4 酪氨酸残基引发的交联反应
天然蛋白质或糖蛋白中的酪氨酸残基交联已经被证实,Singh[15]研究了植物细胞壁中的蛋白质交联。研究表明催化酪氨酸残基交联的酶主要有多酚氧化酶、过氧化氢、过氧化物酶等。
4.1 多酚氧化酶
多酚氧化酶是指催化酚类底物氧化的一组酶,属于氧化还原酶类。能作用于羟基处在邻位的二酚和三酚类化合物,生成相应的醌,它也能作用于单酚,将其转变成邻二酚。这种酶根据所作用底物的不同有许多习惯名称,如酪氨酸酶、甲酚酶、多酚氧化酶、儿茶酚酶、邻二酚氧化酶、酚酶等。
在大多数水果中,多酚氧化酶主要以结合状态存在,例如桃、甜樱桃、杏子和苹果。从食品原料分离出的多酚氧化酶是一种每个亚基均含有铜的寡聚体。铜以Cu+-Cu2+离子对形式紧密结合在一起,并在酶的活性部位形成二硫-铜的结合物。图4给出了酪氨酸酶的催化反应机制。
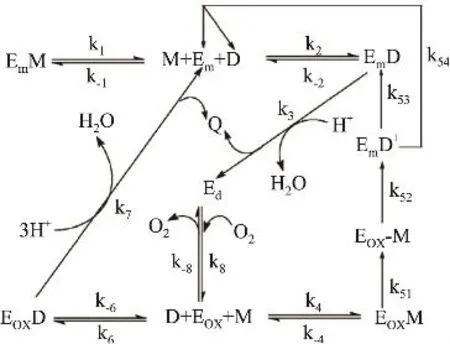
图4 多酚氧化酶催化反应机制
酪氨酸酶催化循环包括三种形式的酶:脱氧-酪氨酸(Ed,Cu+Cu+)、氧合酪氨酸酶(Eox,Cu2+-O2-Cu2+)和金属酪氨酸酶(Em,Cu2+Cu2+)。以催化单酚和二酚为例,Ed结合氧气转化为Eox。Eox催化单酚(如酪氨酸)生成二酚,然后氧化成醌,同时Eox转化成Ed或通过中间产物生成Em;Eox也可以催化二元酚(如多巴)生成相应的醌。Em氧化二酚生成醌,自身转化为Ed,Em可与单酚结合产生化合物EmM,该化合物不能与氧结合。同时醌转化为二羟基吲哚啉(如多巴醌转化为环多巴),催化循环结束。
酪氨酸酶可使食品中的酪氨酸残基和酚类化合物氧化为醌,也能与半胱氨酸、赖氨酸、组氨酸和色氨酸残基反应,从而减少了必需氨基酸含量[16]。Jee等[17]以酪氨酸酶催化含有酪氨酸的多肽,利用基质辅助激光解吸电离时间飞行器质谱分析得知,酪氨酸酶催化的多肽交联反应是直接氧化交联酪氨酸残基上的苯环,从而生成黑色素。Selinheimo等[18]利用漆酶和酪氨酸酶分别催化蛋白质和糖、α-酪蛋白和酚酸之间的交联,通过SDS-PAGE、体积排阻色谱、荧光分析等进行分析,结果表明,这两种酶均可催化蛋白质和糖、蛋白质和酚类物质之间的交联反应,只是这两种酶的催化效率有较大的差别。
4.2 过氧化物酶
过氧化物酶系统名为供体:过氧化氢-氧化还原酶,是指在有供氢体参与下,催化过氧化氢分解的酶(EC 1.11.1)。当以过氧化氢为供氢体时,该酶称为过氧化氢酶(EC 1.11.1.6)。

图5 过氧化物酶催化反应
过氧化氢酶广泛地分布于自然界中,在植物细胞中以可溶和结合两种形式存在,可溶形式存在于细胞浆中,结合形式是与细胞壁或细胞器相结合而存在。在大多数的水果和蔬菜中过氧化物酶以可溶态、离子结合态和共价结合态存在。可直接从植物材料中提取过氧化物酶。此外,也可以先制备丙酮粉,然后再从丙酮粉提取。辣根是过氧化物酶最重要的一个来源。
辣根过氧化物酶(Horesradish peroxidase,HRP,EC 1.11.1.7)是广泛存在于辣根体内的过氧化物酶。HRP是以铁卟啉为辅基的血红素蛋白。在过氧化氢存在时,它能够催化一系列底物发生反应。辣根中的过氧化物酶由众多的同工酶组成,40种以上的辣根过氧化物酶的同工酶在辣根植物中被发现,它们具有类似的相对分子质量(40000~45000)。这种酶是糖蛋白,每一个酶分子中含有一个正铁血红素Ⅲ、一条酶蛋白多肽链和两个Ca2+,酶蛋白含有308个氨基酸残基,3~8个糖类侧基链与丙氨酸残基相连,糖含量可达18%。辣根过氧化物酶分子中含10个突出的螺旋段。辣根过氧化物酶催化反应的机制如图6所示[19]。
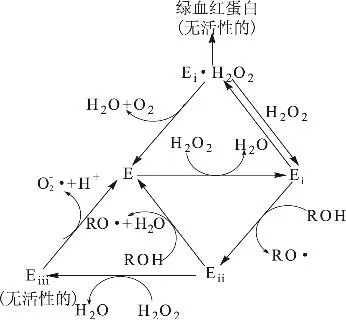
图6 辣根过氧化物酶催化反应机制
在辣根过氧化物酶催化的反应中,过氧化氢首先取代了与过氧化物酶分子(E)中血红素相结合的H2O,形成酶-底物络合物(Ei),Ei和外源氢供体底物作用生成化合物Eii,并形成自由基(RO·)。化合物Eii和第二个氢供体底物分子作用后,过氧化物酶分子E再生,同时生成第二个自由基。这些自由基可以进一步聚合生成新的化合物。
Tenovuo等[20]将乳过氧化物酶分别作用于人体牙周膜胶原、牛跟骨腱胶原、胃蛋白酶、胰岛素和α-淀粉酶,利用紫外和荧光分析可知,胃蛋白酶的交联程度最高,在牙周膜胶原中也有交联产生,而在α-淀粉酶没有交联反应。Steffensen等[21]将灰盖鬼伞过氧化物酶作用于多肽,利用电子自旋共振研究得出灰盖鬼伞过氧化物酶催化反应首先定位于芳香环的碳1位置,通过消去两个氢原子形成二酪氨酸键或是异二酪氨酸键得到酪氨酸自由基中间产物,最后形成酪氨酸多肽的聚合物。此聚合反应表明灰盖鬼伞过氧化物酶可以修饰蛋白质结构去改善蛋白质的功能性质。
4.3 酚类化合物
酚类化合物是一种非常有发展潜力的新型天然蛋白质交联剂。阿魏酸、绿原酸、咖啡酸、单宁酸等酚酸类化合物,能与蛋白质中的赖氨酸、半胱氨酸、酪氨酸等反应而使蛋白质交联。其交联反应机理如图7所示:二元酚酸或者其它的多元酚(1)经分子氧或酶作用氧化成醌。醌发生侧链反应生成二聚体(2),或者与多肽侧链氨基或巯基反应形成酚环上的C-N或C-S共价键,并再次形成酚羟基结构。后者可以再次被氧化并结合第二个多肽,从而形成交联化合物(3)。另外,具有一个侧链的两个醌之间也可以聚合形成交联化合物(4)[22]。

图7 酚酸与多肽氨基侧链的反应
多酚化合物作为蛋白质交联剂,最早应用于制革工业的皮革鞣制,而在食品中的应用,近几年才有报道。欧仕益等[23]在制备大豆分离蛋白可食性膜时,通过添加单宁、阿魏酸和玉米淀粉等交联剂,提高了蛋白膜的机械特性以及膜蛋白的消化率。Strauss等人[22]用纯酚酸和含有酚酸的咖啡、葡萄汁等交联明胶制备凝胶和明胶-果胶复聚微球。研究结果表明,制备的凝胶具有较强的机械特性,含有较少的游离氨基团。DSC结果显示,交联凝胶形成了致密的网络结构,阻止了pH偏离等电点时的肽链伸展;与未交联聚微球相比,交联形成的明胶-果胶聚微球脂溶性较强,200℃时稳定。这些性质使得交联明胶凝胶和交联明胶-果胶聚微球作为新型食品添加剂运用于食品加工中。
5 脱氢蛋白质交联
在食品加工中,碱处理常常被用来去除食品中的有毒成分,或是使蛋白质增溶制备组织化产品,同时碱处理引发的反应会给食品带来一些不需要的性质,而且其食品安全性也有争议。在碱性条件下,热处理可使氨基酸残基发生消旋作用,形成共价交联,如脱氢丙氨酸、赖氨酸丙氨酸和羊毛硫氨酸[24]。脱氢丙氨酸主要是通过催化消除二硫键中的过硫化物;赖氨酸丙氨酸和羊毛硫氨酸是通过半胱氨酸和磷酸化丝氨酸蛋白质残基的β-消除作用发生交联,形成脱氢蛋白质。脱氢蛋白质易与许多亲核基团(如赖氨酸残基上的ε-氨基、半胱氨酸的巯基)发生反应,剧烈的热处理或是碱处理,还可以与咪唑、吲哚、胍基以及其他的氨基酸残基发生反应,形成了分子间或是分子内的交联,而且这种交联结构是比较稳定的。
6 展望
食品中的各交联反应在其适宜的条件下,均能引起蛋白质-蛋白质或蛋白质与其它基质的交联,并能较显著地改善食品的功能性质。然而,由于食品中蛋白质结构的限制,仅一些活性较大的分子参与反应,若要产生数量较多的交联产物,还有更多的工作需要去做,这可能是一个漫长的过程,需要多种技术手段作保证。但是我们仍可预见蛋白质交联的应用前景是非常广阔的。
[1]李书国,陈辉,庄玉婷.大豆蛋白改性修饰技术研究[J].粮食与油脂,2000(1):26-28.
[2]Feeney RE,Whitaker JR.Importance of cross-linking reactions in proteins[J].Advances in Cereal Science and Technology,1988,IX:21-43.
[3]Jinq H,Kitts D D.Chemical characterization of different sugar -casein Maillard reaction products and protective effects on chemical-induced cytotoxicity of Caco-2 cells[J].Food and Chemical Toxicology,2004,42(11):1833-1844.
[4]Rufia′n H.Assessing nutritional quality of milk-based sport supplements as determined by furosine[J].Food Chemistry,2007,101(2):573-578.
[5]Jime′nez-Castan~o G.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J].Food Hydrocolloids,2007,21(3):433-443.
[6]Singh H.Modification of food proteins by covalent crosslinking[J].Trends in Food Science and Technology,1991(2):196-200.
[7]Martin SIFS,Jongen WMF,Van Boekel MAJS.proteinprotein crosslinking in food:methods,consequences,applications[J].Trends in Science and Technology,2002,13(12):364-373.
[8]Bonet A.Glucose oxidase effect on dough rheology and bread quality:A study from macroscopic to molecular level[J].Food Chemistry,2006,99(2):408-415.
[9]Folk J E.Transglutaminases[J].Annu Rev Biochem,1980,49:517-531.
[10]李红.利用谷氨酰胺转胺酶生产大豆蛋白食用保鲜膜的研究[J].食品科学,2001,22(1):73-75.
[11]刘心伟,等.微生物转谷氨酰胺酶在食品工业中的研究进展[J].内蒙古农业大学学报:自然科学版,2005,26(4):54-57.
[12]Farnsworth JP,Li J,Hendricks M.Effects of transglutaminase treatment on functional properties and probiotic culture survivability of goat milk yogurt[J].Small Ruminant Research,2006,65(1-2):113-121.
[13]Hinz K,Huppertz T,Kulozik U et al.Influence of enzymatic cross-linking on milk fat globules and emulsifying properties of milk proteins[J].International Dairy Journal,2007,17(4):289-293.
[14]Huppertz T,De Kruif CG.Structure and stability of nanogel particles prepared by internal cross-linking of casein micelles[J].Radiation Physics and Chemistry,2008,77(9):1108-1111.
[15]Singh H.Modification of food proteins by covalent crosslinking[J].Trends in Food Science and Technology,1991(2):196-200.
[16]Matheis G,Whitaker JRA.Review:enzymatic cross-linking of proteins application to food[J].Journal of Food Biochemistry,1987,11:309-327.
[17]Jee JG,Park SJ,Kim HJ.Tyrosinase-induced cross-linking of tyrosine containing peptides investigated by matrix assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom,2000,14(16):1563-1567.
[18]Selinheimo E,Lampila P,Mattinen ML,et al.Formation of protein-oligosaccharide conjugates by laccase and tyrosinase[J]. Journal ofAgriculturaland Food Chem,2008,56(9):3118-3128.
[19]Khan U,Nicell JA.Horseradish peroxidase-catalyzed oxidation of aqueous natural and synthetic estrogens[J].Journal of Chemical Technology and Biotechnology,2007,82(9):818-830.
[20]Tenovuo J,Paunio K.Peroxidase-catalysed formation of dityrosine,a protein cross-link in human periodontal ligament collagen[J].Archives of Oral Biology,1979,24(8):591-594.
[21]Steffensen CL,Mattinen ML,Andersen HJ,et al.Crosslinking of tyrosine-containing peptides by hydrogen peroxideactivated Coprinus Cinereus peroxidase[J].Eur Food Res Technol,2008,227(1):57-67.
[22]Strauss G,Gibson SM.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids,2004,18(1):81-89.
[23]欧仕益,郭乾初.大豆分离蛋白在成膜后的营养特性变化[J].食品科学,2002,23(4):139-142.
[24]Friedman M.Lysinoalanine in food and in antimicrobial proteins[J].Advances in Experimental Medicine and Biology,1999,45(9):145-159.
Research progress in protein cross-linking in food
LI Jun-wen1,2,ZHAO Xin-huai2
(1.Northeast Agricultural University,Harbin 150030,China;2.Grain Administration of Tengzhou,Tengzhou 277500,China)
The protein crosslinking,including crosslinks derived from the Maillard reaction,disulfide crosslinks,crosslinks formed via transglutaminase catalysis,crosslinks derived from tyrosine and crosslinks derived from dehydroprotein were studied.lmproving proteins functionality properties and nutrition can be accomplished by means of cross-linking,while can expend their food application.
protein;cross-linking;research progress
TS201.2+1
A
1002-0306(2011)01-0380-05
2009-12-15
李君文(1984-),女,硕士研究生,讲师。

