模拟高住低训对小鼠肺组织血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(BFGF)的影响
谷 婧 李世昌
(1.山西大同大学 体育学院,山西 大同 037009;2.华东师范大学 体育与健康学院,上海 200241)
模拟高住低训对小鼠肺组织血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(BFGF)的影响
谷 婧1李世昌2
(1.山西大同大学 体育学院,山西 大同 037009;2.华东师范大学 体育与健康学院,上海 200241)
探讨模拟高住低训对小鼠肺VEGF、bFGF的影响。结论:小鼠肺组织的VEGFmRNA、bFGFmRNA表达水平都呈上升的表现。bFGFmRNA 的增加可能促使VEGFmRNA表达的升高,肺组织毛细血管增生,改善肺组织的低氧状态,提高呼吸系统功能。
低氧;运动;肺组织;VEGF;bFGF
1 前言
血管内皮生长因子(vasuclar endothelial cell growth factor,VEGF)又称血管通透因子(vascular permeability factor,VPF)或血管调理素(Vasculoitropin),研究证明VEGF是唯一对血管形成具有特异性的重要生长因子,VEGF 的生物学效应是通过与其靶器官上特异性受体结合,而引发一系列细胞内信号传递,最终导致细胞分裂、移动来促进血管生成的。bFGF促进血管形成的作用已被证实,在体外培养的内皮细胞中给予bFGF,可以发现VEGF的表达增加,如果阻断了VEGF 的表达,bFGF 就不能诱导内皮细胞形成血管,这说明了bFGF 诱导内皮细胞形成血管是通过VEGF 来实现的。本研究模拟“高住低训”法探讨低氧和运动对小鼠肺组织VEGFmRNA、bFGFmRNA表达的影响,对“高住低训”对呼吸系统功能改善的研究提供实验基础。
2 材料与方法
2.1实验动物与分组
成年昆明雄性小鼠16只,随机分成4组,每组4只:常氧对照组(NC),低氧对照组(HC),常氧训练组(NT),低氧训练组(HT)。动物饲养环境温度23℃±2℃,湿度40%-60%,自然昼夜节律变化光照。
2.2动物模型
模拟低氧设备的制备:采用可以密闭的带盖玻璃容器(自己设计定做),实验时用凡士林密封盖子,内置用来检测容器内O2浓度的低氧报警仪,容器内底部放置钠石灰,吸收小鼠呼吸排出的CO2和水。NC组适应性游泳训练一周后,常规饲养,不运动;HC组每天在自制的低氧舱内居住8h,其余时间常规饲养,不运动;NT组每天不负重游泳1h,每周六次,共4周,常规饲养;HT组每天在低氧舱内居住8h(同HC组),低氧适应之后不负重游泳1h,每周六次,共4周。
2.3取材
4周训练结束后,4组小鼠均在一次性力竭训练后立即麻醉断头处死取样,剖开腹腔取出肺脏。迅速放入生理盐水清洗,用滤纸吸干后用灭菌的锡箔纸包住,放入液氮保存,用于RT-PCR检测。
2.4主要试剂和仪器
Trizol试剂盒,Taq聚合酶,dNTP混合液,RNA酶抑制剂,DTT,M-MLV,TBE,Loading buffer 。台式高速离心机TGL-16B,紫外分光光度计Unico UV-2000,DY-501B 型电泳仪,H6-1微型电泳槽,凝胶成像系统GIS-2008,基因扩增TC-96PTPH(a)。
2.5扩增引物
上海赛百胜公司合成引物。GDAPH上游引物:5′-CAATCTTATACGGGTCACGC-3′,下游引物:5′-AGACTGCAGAGT-CCCAGACC-3′ ,扩增片段长度480bp;VEGFmRNA上游引无5′-TAGGGTTTTTTTCAGTATTC-3′,下游引物5′-TTTTCTTGTTTTGTTTTTAC-3′,扩增片段长度400 bp;bFGFmRNA 产物上游引物:5′-AGCATCACTTCGCTTCCCGC-3′,下游引物:5′-GGTTCGCACACACTCCCTTG-3′,扩增片段长度270bp。
2.6数据获得与统计处理
3 结果
3.1模拟高住低训对小鼠肺组织VEGFmRNA表达的影响
从表1可见,在常氧14.5%氧含量的低氧条件下,低氧和游泳训练对小鼠肺组织VEGFmRNA 表达的影响也不同。与NC组相比较,NT组、HC组小鼠肺组织VEGFmRNA 表达显著上调(P<0.05),HT组则极显著上调(P<0.01);而与常氧训练组相比,HT组小鼠肺组织VEGFmRNA 表达显著增加(P<0.05)。
3.2模拟高住低训对小鼠肺组织b-FGFmRNA表达的影响
从表2可见,经过四周的模拟高住低训实验,各组小鼠肺组织b-FGFmRNA表达量有所不同。与NC组相比,HC、HT组小鼠肺组织b-FGFmRNA表达显著增加(P<0.05),而NT组虽有上升趋势但没有显著差异。
注:*P<0.05,**P<0.01,与NC组相比;#P<0.05,与NT组相比
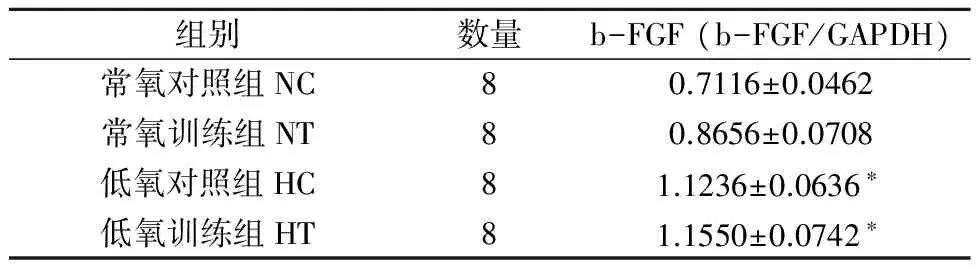
表2 模拟高住低训对小鼠肺组织b-FGFmRNA的影响
注:*P<0.05,与NC组相比
4 讨论
VEGF是一种特异的、强烈的血管内皮细胞促分裂因子和血管生成因子,通过与血管内皮细胞表面的特异性受体结合而明显促进成纤维细胞、血管内皮细胞生长,合成和分泌胶原等细胞外基质,并能强烈促进新血管形成。缺血缺氧是其表达的强烈诱导因素,缺氧可上调血管内皮细胞VEGFmRNA的表达和蛋白分泌,这种上调作用对于提高机体适应低氧环境或(和)大强度运动具重要意义。低氧可促进体外培养的骨髓间充质干细胞VEGFmRNA表达增加[1]。
Gavin等报道急性大强度抗阻训练后2h和4h,血管原生长因子VEGF基因、蛋白水平和血浆含量均有明显上调[2]。Breen等报道低氧和一次急性运动都可增加骨骼肌VEGFmRNA的含量,低氧结合运动可引起骨骼肌VEGFmRNA更高幅度的升高[3],但长期持续低氧暴露却可降低骨骼肌VEGFmRNA的水平,抑制运动所致的VEGF基因表达的增加,引起该现象的原因可能是长期持续低氧导致的适应性反馈抑制血管增生[4]。提示VEGF参与血管生成的反馈调节,即低氧组织VEGF的增加会刺激血管的生成,当低氧组织供氧改善后内皮细胞VEGF分泌量减少。
还有人对低氧(海拔5000m)及低氧加游泳运动 5 周的大鼠进行研究,观察低氧和运动对骨骼肌毛细血管和 VEGF的影响。低氧加运动后,毛细血管显著增生,VEGF 明显增加[5]。低氧加运动使毛细血管显著增生,VEGF 明显增加[6]。
在本实验中,与NC组相比较,NT组、HC组小鼠肺组织VEGFmRNA 表达显著上调(P<0.05),HT组则极显著上调(P<0.01);而与NT组相比,HT组小鼠肺组织VEGFmRNA 表达显著增加(P<0.05)。提示,低氧以及低氧加运动都可促进肺组织VEGFmRNA 表达上调,促进肺组织毛细血管增生。
bFGF 能在血管内皮细胞、平滑肌细胞、外膜成纤维细胞内合成,并能促进血管内皮细胞、平滑肌细胞的增生及迁移[7]。陈文彬等测定肺组织匀浆bFGF的含量,发现缺氧3 周大鼠bFGF 含量明显高于正常对照组(P<0.001)[8]。Mark Olfert 等研究发现,低氧8周后,低氧训练组和低氧对照组的VEGF mRNA、b-FGFmRNA表达水平与安静对照组相比有所增加,并有显著性差异(P<0.05)[9]。Yang 等的研究表明,结合中等强度的训练,训练组的bFGFmRNA 表达水平要比安静组的极其显著的增加(P<0.001)。bFGF的增加对扩张血管起到了间接的作用[10]。研究发现游泳运动8周后,大鼠bFGF 与心肌纤维之间毛细血管密度增加,心肌供血改善有密切关系[11]。
在低氧状态下,碱性成纤维细胞生长因子可促进培养的血管平滑肌细胞VEGF的表达[12]。VEGF基因启动子区含有转录因子SP-1和AP-1的结合位点,bFGF可增加SP-1 的表达,从而促进VEGF的产生。还有证据[13]表明bFGF 通过自分泌方式诱导血管内皮生长因子(VEGF) 产生,上调VEGF 受体在内皮细胞中的表达,从而促进肺血管内皮细胞增殖。
在本实验中,与NC组相比,NT组bFGFmRNA 表达水平有上升趋势,但没有显著差异;而HC和低氧训练组的bFGFmRNA 表达水平与NC组相比,则显著性增加(P<0.05)。这与大多数的文献报告一致,说明不论是训练/低氧还是二者结合都对bFGF有影响,bFGFmRNA表达水平增加。bFGF与VEGF有明显的时间和浓度关系,bFGF不但具有保护神经细胞的作用,而且可以直接和间接地调节VEGF的表达,增加内皮细胞的化学趋向性,从而促进血管的增殖[14]。
低氧可以导致呼吸加深加快,肺通气量增加,VO2max增大。本实验的实验结果显示,低氧和运动使VEGF、bFGF的表达水平升高。有实验证明,在低氧和运动的刺激下,VEGF表达水平上调,心肌毛细血管的密度增加。提示,在本实验中VEGF、bFGF的表达水平升高,可推论肺组织毛细血管密度也有增加的趋势。运动员之所以有较高的O2扩散容量,原因之一是肺泡-毛细血管膜的表面积大。
由于肺泡毛细血管密度的增加,通过气血屏障的O2增多,从而也提高了血氧结合的能力,进一步增加了低氧和训练结合条件下机体氧运输能力和运动能力。
5 结论
经过4周的模拟“高住低训”(氧含量为14.5%,海拔约3000m),本实验中小鼠肺组织的VEGFmRNA、bFGFmRNA表达水平都呈上升的表现。是否可以推断,bFGFmRNA 的增加可能促使VEGFmRNA表达的升高,导致肺组织毛细血管增生,改善肺组织的低氧状态提高呼吸系统功能。
[1] 王庆德,杨述华,杨操,等.低氧对人骨髓间充质干细胞HIF-1α、SDF-1、VEGFmRNA表达的影响[J].山东医药,2008,48(3):21-22.
[2] GAVIN T P,DREW J L,KUBIK C J,et al.Acute resistance exercise increases skeletal muscle angiogenic growth factor expression[J].Acta Physiol (Oxf),2007,191(2):139-146.
[3] Breen E.C,Johnson E.C,Wagner H,et al.Angiogenic growth factor mRNA responses in muscle to a single bout of exercise[J].J Appl Physiol,1996,81:355-361.
[4] Olfert I,Mark EllenC,Breen OM,et al.Chronic hypoxia attenuates resting and exercise-induced VEGF、flt-1 mRNA levels in skeletal muscle[J].J Appl Physiol,2001,90:1532-1538.
[5] Richardson RS,Wagner H,Mudaliar SR,et al.Human VEGF gene expression in skeletal muscle: effect of acute normoxic and hypoxic exercise[J].Am J Physiol,1999,79(6):489-490.
[6] Bailey AP,Shparago M,Gu JW.Exercise increases soluble vascular endothelial growth factor receptor-1(sFlt-1) in circulation of healthy volunteers[J].Med Sci Monit,2006,12(2):45-50.
[7] Slavin J.Fibroblast growth factors: At the heart of angiogenesis[J].Cell Biology International,1995,19 (5)∶431.
[8] 陈文彬,颜浩.bFGF mRNA 在慢性低氧性肺动脉高压大鼠肺组织中的表达及分布[J].华西医科大学学报,1999,30(1):1-4.
[9] Mark Olfert,Ellen C.Breen,et al.Skeletal muscle capillarity and angiogenic mRNA levels after exercise training in normoxia and chronic hypoxia[J].J Appl Physiol,2001,3(1):1176-1184.
[10] Yang HT,Ogilvie RW,Terjung RL.Exercise training enhances basic fibroblast growth factor-induced collateral blood flow[J].Am J Physiol,1998,274(2):H2053-61.
[11] 步斌,雷鸣鸣,韩海军.游泳对大鼠心肌碱性成纤维细胞生长因子( bFGF) 表达的影响[J].体育科学,2010,30(3):68-74.
[12] Ryuto M,Ono M,I zumi H,et al.Induction of vascular endothelial growth factor by tumor necrosis factor alpha in human glioma cells possible roles of SP-1[J].J Biol Chem,1996,271(45):28220-28228.
[13] Miyazaki S,Sakai A.The effect of “living high-training low” on physical performance in rats[J].Int J Biom eteorol,2000,44(1):24-30.
[14] 张强.碱性成纤维细胞生长因子血管新生与应用的研究进展[J].实用医药杂志,2004,11(2):1036-1038.
Effectsof“Living-HighandTraining-Low”ontheVascularEndothelialCellGrowthFactor(VEGF)、BasicFibroblastGrowthFactor(BFGF)intheLungofMice
Gu Jing1,Li Shichang2
(1.Institute of P.E.,Shanxi Datong University,Datong,037009,Shanxi,China; 2.College of Physical Education & Health,East China Normal University,Shanghai,200241,China)
This paper discussed the effect of simulated living in high altitude and training in low altitude in atomosphere on VEGF and b-FGF in mice’s lung.Conclusion:VEGFmRNA and bFGFmRNA expression of mice’s lung all increased.The increased of bFGFmRNA expression should promote upregulat the VEGFmRNA xpression,and with the hyperplasia of lung’s bloof vessel it should improve the function of respiratory system in the hypoxia.
hypoxia;exercise;lung;VEGF;bFGF
2010-10-18;
2010-12-20
谷婧(1979-),女,山西大同人,硕士,讲师,研究方向:体育理论与教学研究。
G804.5
A
1672-1365(2011)03-0080-02

