杯碟法检测乳中的β-内酰胺酶
薛晓晶,李 玲,金 涌,李 礼,王 芳,任香夫,田世民*
(中国检验检疫科学研究院,北京 100123)
杯碟法检测乳中的β-内酰胺酶
薛晓晶,李 玲,金 涌,李 礼,王 芳,任香夫,田世民*
(中国检验检疫科学研究院,北京 100123)
采用微生物杯碟法对乳中β-内酰胺酶进行检测。基于青霉素抑制藤黄微球菌(Micrococcus luteus)生长并产生抑菌圈,利用舒巴坦特异性抑制β-内酰胺酶活性的特点,通过比较含青霉素样品中加入和未加入舒巴坦所产生的抑菌圈直径差异,间接判断样品中是否含有β-内酰胺酶。结果表明:青霉素G的最佳使用质量浓度为0.5μg/mL,β-内酰胺酶的检测限因生产厂家随标注单位不同而不一致,舒巴坦的最佳使用质量浓度为50μg/mL;在此基础上确立杯碟法检测β-内酰胺酶的优化方案:设立阴阳性样品对照组;并对同一样品进行4个不同添加处理:青霉素G处理,青霉素G、舒巴坦处理,青霉素G、β-内酰胺酶处理,青霉素G、β-内酰胺酶、舒巴坦处理,通过比较4个不同处理产生的抑菌圈直径差异,并同时参照阴阳性样品对照组结果,判定样品中是否存在β-内酰胺酶。
β-内酰胺酶;杯碟法;青霉素G;舒巴坦;乳
β-内酰胺酶[1-3]是指能催化水解6-氨基青霉烷酸(6-APA)、7-氨基头孢烷酸(7-ACA)及其N-酰基衍生物分子中β-内酰胺环酰胺键的灭活酶,即可选择性分解β-内酰胺类抗生素。近些年,部分不法生产者将其作为“生鲜牛乳抗生素分解剂”使用,用于分解牛乳中残留的β-内酰胺类抗生素,使牛乳达到乳品检验合格标准[4]。目前国内外对β-内酰胺酶的食用安全性还未得到证实,但是,经β-内酰胺酶分解后的抗生素分解产物可能对人体健康构成潜在威胁[5],如β-内酰胺酶可使青霉素四元环开环,丧失抑菌活性,其分解产物青霉噻唑酸是引起人体青霉素过敏的主要物质之一[6-8]。卫生部于2009年3月6日和23日相继发布了关于印发《全国打击违法添加非食用物质和滥用食品添加剂专项整治近期工作重点及要求》的通知(卫监督发〔2009〕21号)[9]和关于印发《全国打击违法添加非食用物质和滥用食品添加剂专项整治抽检工作指导原则和方案》的通知(食品整治办〔2009〕29号)[10],明确指出“添加β-内酰胺酶(解抗剂)等非食品用物质属违法行为”。
国内记载或报道的有关β-内酰胺酶检测方法[11-12]有头孢硝基噻吩显色法、酸度法、碘量法、高效液相色谱法、酶联免疫法和杯碟法。碘量法的检出限较高,假阴性率高;高效液相色谱法前处理复杂,背景噪声较大,假阳性率高;酶联免疫法易受乳品中其他蛋白干扰等;杯碟法即微生物培养法被认为是可靠和准确的检测方法[5-7]。杯碟法的原理是基于青霉素抑制藤黄微球菌(Micrococcus luteus)生长并产生抑菌圈的基础上,利用舒巴坦特异性抑制β-内酰胺酶活性的特点,通过比较含青霉素样品中加入和未加入舒巴坦所产生的抑菌圈直径差异,间接判断样品中是否含有β-内酰胺酶。此法灵敏度高、操作简便、结果判定简单,基本可以满足乳液及乳液制品中β-内酰胺酶的检测需要。
在实验中发现,不同厂家生产的β-内酰胺酶标准品,所用酶活性单位不一致。中国药检所和TCI公司β-内酰胺酶标准品单位均为“U”。前者对酶单位“U”未给出定义,后者给出的“1 U”定义为,在30℃、pH7.0时,每小时分解1IU青霉素为一个酶活性单位。Sigma公司β-内酰胺酶所用单位为国际单位“IU”,即在25℃、pH7.0时,每分钟水解1.0μmol青霉素的酶活性。β-内酰胺酶酶活性单位的不统一,将会影响该酶检测的可比性。鉴于以上原因,本实验将对几种不同品牌的β-内酰胺酶标准品进行比对实验,确定其在杯碟法中的检测限是否一致。
在此基础上,本实验对现有的杯碟法中涉及的青霉素G、舒巴坦、β-内酰胺酶检测限等实验参数进行验证并优化实验方案,以提高方法的可操作性和检测结果的稳定性,为我国制定相应β-内酰胺酶检测标准提供参考。
1 材料与方法
1.1 材料与试剂
藤黄微球菌[Micrococcus luteus CMCC(B) 28001] 国家医学菌种保藏管理中心。
脑心浸液、抗生素鉴定培养基2号(pH6.5~6.6)、舒巴坦 北京陆桥技术有限责任公司;青霉素G Dr.Ehrenstorfer GmbH公司;β-内酰胺酶 东京化学工业(TCI)公司、美国Sigma公司、中国药品生物制品检定所(中国药检所);脱脂奶粉 美国BD公司。
1.2 仪器与设备
KB240培养箱 德国Binder公司;WNB21L水浴锅德国Memmert公司;牛津杯(外径8mm);培养皿(90mm)。
1.3 方法
1.3.1 菌平板的制备
将藤黄微球菌单菌落接种于灭菌后的脑心浸液培养基中,36℃培养18~22h,使菌浓度达到1×108CFU/mL。将此菌液按1:20(V/V)接种于50~55℃温水浴的已灭菌抗生素鉴定培养基2号(pH6.5~6.6)中,充分混匀后用含菌培养基倒平板,约15mL/皿。待培养基凝固后,每培养皿上均匀放置4个牛津杯。
1.3.2 青霉素G最适使用质量浓度的选择
用10g/100mL脱脂奶液配制不同质量浓度的青霉素G溶液,其质量浓度为1.00、0.50、0.25μg/mL。混匀后用0.22μm滤膜过滤,分别加入放置于菌平板上的牛津杯中(200μL/杯),同时设不含青霉素G的脱脂奶液为阴性对照,每组重复3皿。36℃培养18~22h。选择抑菌圈直径大小约为25~30mm的试样组,其青霉素G质量浓度为实验最适使用质量浓度。
1.3.3 β-内酰胺酶对青霉素G抑菌效果的影响及检测限的确定
用10g/100mL的脱脂奶液配制不同酶用量的β-内酰胺酶/青霉素G混合溶液。β-内酰胺酶用量分别为:TCI组:5.00、2.50、1.00、0.50、0.25U/mL;Sigma组:5、1、0.5、0.1IU/L;中国药检所组:16、8、4、2、1U/mL。青霉素G所使用的质量浓度为选择后的最适使用质量浓度。混匀后,分别加入放置于抗生素鉴定培养基上的牛津杯中(200μL/杯),每组重复3皿,36℃培养18~22h。观察抑菌圈直径大小与青霉素最适浓度对照组的差异。
1.3.4 舒巴坦最适使用浓度的选择
用10g/100mL脱脂奶液配制不同质量浓度的舒巴坦-β-内酰胺酶-青霉素G混合溶液。舒巴坦质量浓度分别为200、100、50、25μg/mL,β-内酰胺酶为检测限的不同倍数浓度,青霉素G为最适使用质量浓度。混匀后分别加入放置于抗生素鉴定培养基上的牛津杯中(200 μL/杯),每组重复3皿。同上培养后测量抑菌圈直径。
2 结果与分析
2.1 青霉素G最适使用质量浓度的选择
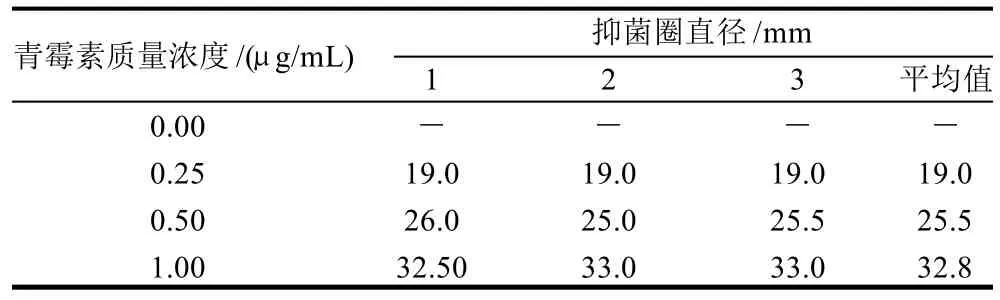
表1 不同质量浓度青霉素脱脂奶溶液的抑菌圈直径Table 1 Diameters of inhibition zone produced under different concentrations of penicillin G
按1.3.2节方法得到不同质量浓度青霉素G抑菌圈直径大小见表1。如表1所示,0.5μg/mL青霉素G产生的抑菌圈约为25~26mm,确定为本实验研究的适用质量浓度。
2.2 β-内酰胺酶对青霉素G抑菌效果的影响及检测限的确定
按1.3.3节方法得到不同公司的β-内酰胺酶对青霉素G抑菌效果(抑菌圈直径)的影响及其检测限见表2。

表2 含0.5μg/mL青霉素的不同β-内酰胺酶用量溶液的抑菌圈直径Table 2 Diameters of inhibition zone under different concentrations of β-lactamase and 0.5μg/mL penicillin
如表2所示,β-内酰胺酶Sigma组中0.5IU/L组(抑菌圈直径平均值为19.7mm)及更高用量组、TCI 组中0.5U/mL组(抑菌圈直径平均值为23.3mm)及更高用量组、中国药检所组中2U/mL组(抑菌圈直径平均值为20.2mm)及更高用量组,在含有0.5μg/mL青霉素G的脱脂奶溶液中所产生的抑菌圈与青霉素G对照组(抑菌圈直径平均值为26.8mm)比较,直径差异在3.0mm以上。参照卫生部的判断标准[7],当抑菌圈直径差异不小于3.0mm时即为“有显著差异”。以此判断上述3个浓度可分别确定为该厂家β-内酰胺酶的检测低限。
2.3 舒巴坦最适使用质量浓度的选择
按1.3.4节方法,以Sigma组的β-内酰胺酶实验组为例,得到不同质量浓度的舒巴坦/β-内酰胺酶对青霉素G作用所产生的抑菌圈大小见表3。计算各组抑菌圈与未添加舒巴坦对照组的直径差异见表4。
结果表明,25μg/mL舒巴坦-10.0IU/L β-内酰胺酶实验组抑菌圈直径为10.5mm,未添加舒巴坦-10.0IU/L β-内酰胺酶对照组未产生抑菌圈,按牛津杯直径计算为8.0mm,两组抑菌圈差异为2.5mm;50μg/mL舒巴坦-10.0IU/L β-内酰胺酶实验组抑菌圈直径为21.5mm,与对照组差异为13.5mm。以卫生部方法标准判定,25μg/mL舒巴坦对10.0IU/L β-内酰胺酶(检测低限乘以20倍)抑制作用不明显;50μg/mL舒巴坦可以有效抑制Sigma组β-内酰胺酶10.0IU/L对0.5μg/mL青霉素G的分解作用。相同方法进行另外两个品牌β-内酰胺酶实验,结果50μg/mL舒巴坦可以有效抑制中国药检所组β-内酰胺酶40U/mL、TCI组β-内酰胺酶40U/mL的分解作用。总结以上结果,本实验选择舒巴坦的最适使用质量浓度为50μg/mL。

表3 含0.5μg/mL青霉素G、不同用量β-内酰胺酶(Sigma组)和舒巴坦脱脂奶溶液的抑菌圈直径Table 3 Diameter of inhibition zone under different concentrations of sulbactam,β-lactamase (Sigma) and 0.5μg/mL penicillin G mm
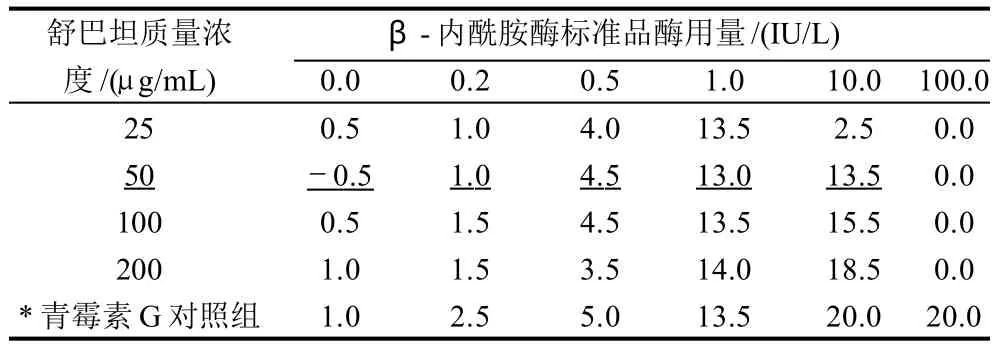
表4 各组所产生抑菌圈直径与未添加舒巴坦对照组抑菌圈直径的差异Table 4 Difference in the diameter of inhibition zone between the presence of sulbactam at various concentrations and its absence mm
2.4 乳样品中β-内酰胺酶的检测方案及结果判定
在以上结果的基础上,制定乳样品中β-内酰胺酶的检测方案。选用青霉素G母液质量浓度100μg/mL、舒巴坦母液质量浓度2mg/mL、Sigma公司的β-内酰胺酶母液酶用量0.02IU/mL。将待检样品充分混匀,调pH6.0~6.5。分别取1mL待检样品于4个1.5mL离心管中,标记A、B、C、D,每个样品做3个平行,共12管。同时,每次检验均设阳性质控对照和阴性对照。阳性质控对照为添加有Sig ma公司的β-内酰胺酶浓度为0.5IU/L(检测限)的10g/100mL脱脂奶液。阴性对照为10g/100mL脱脂奶液。制备操作同待检样品。
按照下列顺序分别将青霉素G母液、β-内酰胺酶标准品母溶液、舒巴坦母液加入到样品、阳性和阴性对照中:A(青霉素G 5μL);B(青霉素G 5μL、舒巴坦25μL);C(青霉素G 5μL、β-内酰胺酶25μL);D(青霉素G 5μL、β-内酰胺酶25μL、舒巴坦25μL)。此时相应样品中青霉素G质量浓度为5μg/mL、舒巴坦质量浓度为50μg/mL、Sigma公司β-内酰胺酶用量为0.5IU/L。混匀后,将上述A~D试样各200μL加入放置于检验用平板的4个牛津杯中,(36±1)℃培养18~22h后,测量其抑菌圈直径。每个样品,取3次平行实验的平均值。
结果判定标准:阴性对照组的结果应为:A、B、D产生抑菌圈,且A、B抑菌圈直径差异小于3mm,重复性良好;C抑菌圈直径小于D抑菌圈,且抑菌圈直径差异大于等于3mm,重复性良好。阳性添加对照组的结果应为:B、D产生抑菌圈,且A抑菌圈直径小于B抑菌圈直径,差异大于等于3mm,重复性良好;C抑菌圈直径小于D抑菌圈,且抑菌圈直径差异大于等于3mm,重复性良好。如为以上结果,则系统成立,检测限(灵敏度)为0.0005IU/mL。
样品组实际判定结果为:①B、D产生抑菌圈,且C抑菌圈直径小于D抑菌圈,抑菌圈直径差异大于等于3mm,重复性良好时,A抑菌圈直径小于B抑菌圈直径,差异大于等于3mm,重复性良好,则判定该样品检出β-内酰胺酶,报告β-内酰胺酶检验结果为阳性;若A、B抑菌圈差异小于3mm,重复性良好,则判定该样品未检出β-内酰胺酶,报告β-内酰胺酶检验结果为阴性。②当样品中A不产生抑菌圈且B产生的抑菌圈小于11mm或A、B均不产生抑菌圈,说明可能样品中β-内酰胺酶酶用量过高,舒巴坦无法有效抑制酶的活性。此时应将样品稀释1 0倍,再进行检测。
本实验室用此方法检测市场送检48例样品,检出阳性样品14例,检出率为29.17%。
3 结论与讨论
通过实验结果分析,不同厂家生产的β-内酰胺酶其检测限各不相同——Sigma组为0.5IU/L、TCI组为0.5U/mL、中国药检所组为2U/mL,说明酶的单位活性存在很大差异。这一现象与各个厂家所使用的酶活性单位及单位定义不一致有很大关系。制定β-内酰胺酶的检测标准,首先必须确定酶的检测限。在此酶活性单位的统一是一个重要问题。确定不同品牌的β-内酰胺酶活性单位的特定比例关系、单位换算公式以及酶在最适条件下的单位活性与实验条件下的单位活性之间的差异,是今后研究的重点内容。
经观察还发现,中国药检所组和TCI组的β-内酰胺酶均为液体,开封后酶活性降低较快,不易保存。Sigma公司的酶为干粉状,易于保存,溶解后在较长时间内活性稳定。根据实验结果,建议在酶单位未统一之前,选用以国际单位IU为标准单位、以干粉状态保存的Sigma公司的β-内酰胺酶作为实验中使用的标准物质,以保证实验结果的稳定性和一致性。
在舒巴坦质量浓度的选择上,卫生部方法所采用舒巴坦质量浓度为25μg/mL,在本实验中,此质量浓度对20倍于检测限浓度的β-内酰胺酶抑制效果不显著;50μg/mL舒巴坦对此浓度β-内酰胺酶的抑制效果非常显著。本实验使用的舒巴坦上限质量浓度为200μg/mL,50μg/mL舒巴坦远远低于上限质量浓度,此质量浓度本身不会引起实验结果的偏差,且对β-内酰胺酶酶用量检测上限更高。因此建议将舒巴坦质量浓度调整为50μg/mL用于实际检测。
在藤黄微球菌培养中,崔生辉等[5]实验中所使用的抗生素检测用培养基Ⅰ(pH6.5±0.1)和Ⅳ(pH6.1±0.1)培养基,菌生长状态不理想。本实验改用抗生素鉴定培养2号(pH6.5~6.6),菌生长良好。在检测平板的制备中,放弃底层基础培养基的铺设,直接铺倒含菌培养基于培养皿中,避免了铺设两层培养基可能带来的铺板过厚、不均匀等问题,同时简化操作程序,提高效率。经实验比较,两种铺板方法所产生的实验结果一致。
在检测方案的设计方面,以卫生部方法为基础进行了两点改进:一是添加了阳性对照组,该组样品添加有检测限浓度的β-内酰胺酶,以进一步确保实验的有效性和稳定性;二是将阴性/阳性对照组的溶液基质由水改为10g/100mL阴性脱脂奶液,使其与待检测样品的基质更为接近,保证了实验条件的一致性。
总而言之,β-内酰胺酶的检测方法研究还处于初期阶段,微生物杯碟法作为一种传统的检测方法在检测时长和精度上还存在着不足。此法只能满足定性检测的需要,在定量检测研究方面还存着很大的空白。而样品中存在的β-内酰胺酶除了人为添加外,还可能来源于微生物[5],目前已知的各种检测方法还无法对此两种来源的β-内酰胺酶进行区分,这可能致使检测中假阳性率偏高。为进一步完善β-内酰胺酶检测方法,对酶的稳定性、添加限量、定量检测等多方面进行研究是下一步的研究内容。
[1] 刑旺兴. β-内酰胺酶的基本特性及其检验方法[J]. 国外医药: 抗生素分册, 1995, 16(6): 409-414.
[2] KORYCKA-DAHL M, RICHARDSON T, BRADLEY R L Jr. Use of microbial beta-lactamase to destroy penicillin added to milk[J]. J Dairy Sci, 1985, 68(8): 1910-1916.
[3] 国家药典委员会. 中华人民共和国药典: 二部[S]. 北京: 化学工业出版社, 2005: 附录84.
[4] 于家丰, 田颖, 周惠强. 加强β-内酰胺酶监管刻不容缓[J]. 经营管理, 2009(9): 57-58.
[5] 崔生辉, 李景云, 马越, 等. “生鲜牛乳抗生素分解剂” 的鉴定与检测[J]. 中国食品卫生杂志, 2007, 19(2): 113-116.
[6] 夏翠华. 青霉素过敏反应机理及过敏试验研究近况[J]. 中华护理杂志, 1994, 29(11): 682-683.
[7] 农业部畜牧兽医局. 动物性食品中青霉素类抗生素残留检测方法: 微生物法[J]. 中国兽药杂志, 2004, 38(3): 14-15.
[8] SUTHELAND R. β-内酰胺酶抑制剂与抗生素耐药性的逆转[J]. 刘小康, 译. 国外医药: 抗生素分册, 1993, 14(4): 259-263.
[9] 卫生部. 关于印发《全国打击违法添加非食用物质和滥用食品添加剂专项整治近期工作重点及要求》的通知(卫监督发[2009]21号)[EB/OL]. http://www.sda.gov.cn/WS01/CL0056/38681.html.
[10] 卫生部. 关于印发《全国打击违法添加非食用物质和滥用食品添加剂专项整治抽检工作指导原则和方案》的通知(食品整治办[2009]29号)[EB/OL]. http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohwsjdj/s3594/200903/39650.htm.
[11] 桂炳东. β-内酰胺酶测定进展及临床意义[J]. 临床检验杂志, 2002,20: 64-66.
[12] 唐群力. 两种β-内酰胺酶检测方法的应用比较[J]. 检验医学与临床,2008, 5(7): 427-428.
Detection ofβ-Lactamase in Milk Based on Cylinder Plate Method
XUE Xiao-jing,LI Ling,JIN Yong,LI Li,WANG Fang,REN Xiang-fu,TIAN Shi-min*
(Chinese Academy of Inspection and Quarantine, Beijing 100123, China)
Here, we adopted microbiological cylinder plate method to detectβ-lactamase in milk. Since penicillin inhibits the growth of Micrococcus luteus, producing a zone of inhibition, the difference between the diameters of inhibition zone produced by penicillin alone and together with sulbactam, which specifically inhibits the activity of β-lactamase, will indirectly suggest whether or not a sample contains the enzyme. The optimum working concentration of penicillin G determined in this study was 0.5μg/mL. The influence ofβ-lactamase products from different manufacturers with different given units on the antimicrobial activity of penicillin G in liquid skim milk was evaluated, and the results showed that the limits of detection of the developed method for them were different. Addition of sulbactam at 50 μg/mL provided optimum detection of β-lactamase. Based on the above investigations, the optimum protocol for detecting β-lactamase by cylinder plate method in milk was that the presence or not ofβ-lactamase was identified based on differences in the diameter of inhibition zone among additions of penicillin G alone or in combination with sulbactam or/and β-lactamase to one sample together with the results from constructed positive and negative controls.
β-lactamase;cylinder plate method;penicillin G;sulbactam;milk
TS252.7
A
1002-6630(2011)04-0216-04
2010-03-26
薛晓晶(1981—),女,实习研究员,硕士,研究方向为食品安全及生物检测。E-mail:xxjing528@163.com
*通信作者:田世民(1964—),男,研究员,博士,研究方向为食品安全及生物检测。E-mail:shimintian@yahoo.com.cn

