后处理对缺血再灌注损伤大鼠肺Egr-1和IL-1β表达的影响*
伍火志, 袁 江, 王理想, 刘 鑫, 黄清华
(遵义医学院第五附属医院心胸外科,广东 珠海 519100)
后处理对缺血再灌注损伤大鼠肺Egr-1和IL-1β表达的影响*
伍火志△, 袁 江, 王理想, 刘 鑫, 黄清华
(遵义医学院第五附属医院心胸外科,广东 珠海 519100)
目的研究后处理对在体缺血再灌注损伤大鼠肺早期生长反应因子1(Egr-1)和白细胞介素1β(IL-1β)表达的影响,并分析其可能的肺保护作用机制。方法建立大鼠在体肺脏缺血再灌注损伤模型,将SD大鼠24只随机分为假手术(sham)组、缺血再灌注(I/R)组和缺血后处理(IPostC)组,每组8只。在体鼠I/R损伤模型制备完成后,阻断左肺门,终止血供及通气,造成左肺缺血,达预定时间后松开阻断带恢复血供及通气形成再灌注损伤。sham组只游离左侧肺门、套阻断带但不阻断,等待3 h后直接取标本;I/R组缺血1 h后再灌注2 h;IPostC组缺血1 h后给予重复3次的5 min灌注和5 min缺血的后处理,继以恢复血供行再灌注1.5 h。3组实验结束后均留取左侧肺组织,制成10%的组织匀浆,用于测定髓过氧化物酶(MPO)的含量;留取小块肺组织测定肺湿/干重比(W/D),并在光镜下观察肺组织的病理变化;RT-PCR法检测Egr-1 mRNA及IL-1β mRNA的表达量。结果3组间各项检测指标比较,差异均显著(P<0.05)。与sham组比较,I/R组肺组织中Egr-1 mRNA、IL-1β mRNA的表达量、MPO的活性及W/D值均明显升高(P<0.05);肺组织炎症反应明显加重。IPostC组肺组织中Egr-1 mRNA及IL-1β mRNA的表达量、MPO的活性及W/D值与I/R组相比均明显下降(P<0.05);肺组织炎症反应明显减轻。结论后处理能够明显减轻大鼠肺缺血再灌注损伤,其机制可能与抑制Egr-1和IL-1β的表达有关。
肺缺血; 再灌注损伤; 后处理; 早期生长反应因子1; 白细胞介素1β
肺移植、肺栓塞血管再通、体外循环以及需暂时阻断一侧肺动脉同期行血管成形术的中央型肺癌手术等过程中均可发生肺缺血再灌注损伤(ischemic reperfusion injury, IRI),导致术后肺功能障碍。从基因水平研究发现,缺血再灌注肺组织中早期生长反应因子1(early growth response factor 1,Egr-1)的高表达,通过其下游基因白细胞介素1β(interleukin-1β,IL-1β)表达的参与,引起肺组织炎症损伤,是导致肺缺血再灌注损伤的发生机制之一[1]。近年来,在对缺血再灌注损伤的组织和脏器保护措施的研究中,引入了缺血后处理的概念,即在再灌注开始时,进行重复多次的短暂灌注和缺血处理,从而起到器官保护作用[2-4]。我们已经对离体缺血再灌注鼠肺进行后处理的研究表明,后处理可以降低缺血再灌注肺中IL-6、IL-8等细胞因子的表达,减轻中性粒细胞炎症反应,从而减轻肺缺血再灌注损伤[5]。本实验旨在通过建立在体肺缺血再灌注损伤模型,研究后处理对在体鼠肺缺血再灌注损伤的保护作用,通过分析其对缺血再灌注肺组织中Egr-1和IL-1β表达的影响,从基因水平进一步探讨其可能的肺保护机制。
材 料 和 方 法
1材料
1.1动物 健康SD大鼠24只,雌雄不限,体重280-320 g,随机分为假手术组(sham组)、缺血再灌注组(I/R组)和缺血后处理组(IPostC组)每组8只。
1.2试剂 MPO试剂盒(南京建成生物有限公司);PCR仪(北京东胜创新生物科技有限公司);Trizol(Invitrogen);FI/Rst Strand cDNA Synthesis Kit(TaKaRa);Taq PCR Master Mix(北京百泰克生物技术有限公司);引物合成(Invitrogen)。
2方法
取大鼠称重,以5%异戊巴比妥钠(0.3 g/kg BW)行大鼠腹腔麻醉,麻醉成功后,气管插管,接小动物呼吸机(上海奥尔科特生物有限公司),通气频率90次/min,潮气量2-3 mL/次,吸呼比1∶2,吸入空气进行辅助呼吸。右侧卧位,消毒左胸部皮肤,沿左胸骨切断第3-5肋软骨,打开胸腔,游离左肺门并穿过止血带,静脉注射肝素(1 mg/kg)抗凝。Sham组只游离肺门不阻断,等待3 h直接取标本;I/R组和IPostC组均阻断肺门,终止血供及通气造成左肺缺血,1 h后松开阻断带恢复血供及通气形成再灌注。IPostC组缺血1 h后给予重复3次的5 min灌注和5 min缺血的后处理,继以恢复血供行再灌注1.5 h。
3肺湿/干重比(W/D)的计算
再灌注2 h后钳夹切取左侧肺组织称得的重量为湿重,随即将该肺组织放入干燥箱内以80 ℃的温度鼓风干燥12 h后称取的重量为干重,两者之间的比值为肺湿/干重比。
4髓过氧化物酶(myeloperoxidase,MPO)的检测
实验结束后留取小块肺组织(约100 mg),-40 ℃低温保存,实验完成后统一制成组织匀浆,比色法检测MPO的含量。
5光镜观察
切取小块左肺上半部分用多聚甲醛固定做病理检查。
6RT-PCR法检测EGR-1mRNA及IL-1βmRNA表达水平
CRISPR/Cas9系统也有局限性。如存在一定的脱靶效应。CRISPR/Cas9系统的特异性取决于sgRNA上的识别序列。为了避免脱靶效应,有必要将Cas9引导至其基因组中精确靶标的sgRNA。为了确保Cas9的靶向活性和正常功能,使用Ⅱ型CRISPR/Cas系统和Cas9表征的研究已经证明需要与靶基因序列完美匹配[26-28]。有学者研发了很多软件辅助CRISPR/Cas9系统快速筛选特定基因序列靶点,有针对性地避开可能脱靶的位点,从而降低甚至消除脱靶现象[29]。
6.1RNA提取及RT-PCR反应 称取冻存肺组织100 mg,以Trizol法匀浆提取总 RNA,紫外分光光度法测定其浓度与含量。取1μg总RNA,逆转录成 cDNA。
6.2PCR 以β-actin为内参照,采用50 μL体系进行扩增。EGR-1:上游引物 5′-AAAGTTTGCCAGGAGTGAT-3′,下游引物5′-GCAGGAGACGGGTAGGTA-3′,扩增产物 225 bp。IL-1β:上游引物 5′-CCTCTGTGACTCGTGGGA-3′,下游引物 5′-CTTCTTTGGGTATTGTTTGG-3′,扩增产物322 bp。β-actin:上游引物 5′-TGCCCATCTATGAGGGTTAC-3′,下游引物 5′-TGGAAGGTGGACAGTGAGG-3′,扩增产物 571 bp。 PCR 反应条件为95 ℃ 5 min;扩增31个循环(内参照35个循环)[95 ℃ 30 s,57 ℃(退火温度)30 s,72 ℃ 30 s],最后72 ℃延伸10 min。
6.3产物分析 产物用1%琼脂糖凝胶电泳,用凝胶成像分析系统摄像分析。结果用各样品的条带灰度值与β-actin的条带灰度值之比表示。
7统计学处理
结 果
1Egr-1mRNA及IL-1βmRNA的表达
应用RT-PCR检测发现,I/R组肺组织中Egr-1 mRNA及IL-1β mRNA的相对表达量明显高于sham组,而IPostC组肺组织中Egr-1 mRNA及IL-1β mRNA的相对表达量明显低于I/R组,3组间比较差异均显著(P<0.05),见表1及图1、2。
表1各组Egr-1mRNA及IL-1βmRNA相对表达量


GroupEgr-1mRNArelativeexpressionIL-1βmRNArelativeexpressionSham0.2975±0.02890.2308±0.0083I/R0.6147±0.0152#0.5500±0.0281#IPostC0.4680±0.0166*0.3661±0.0080*
#P<0.05vssham group;*P<0.05vsI/R group.
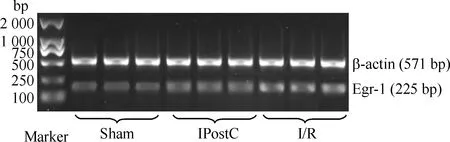
Figure 1. Egr-1 mRNA expression detected by RT-PCR.
图1RT-PCR检测各组Egr-1mRNA的表达
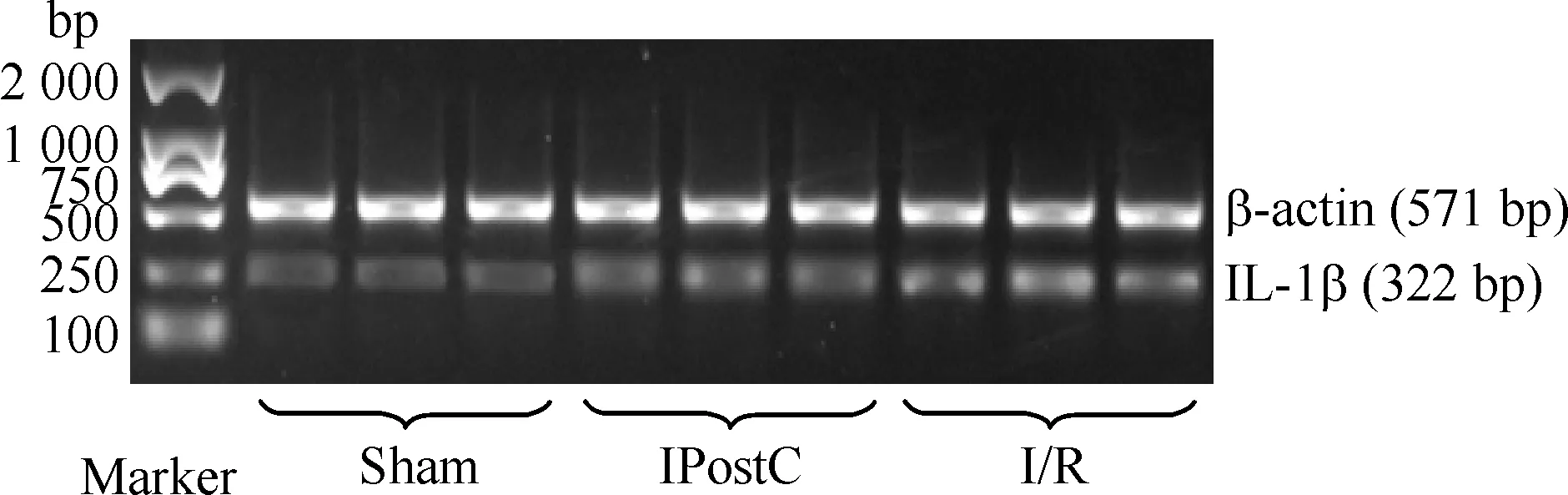
Figure 2. IL-1β mRNA expression detected by RT-PCR.
图2RT-PCR检测各组IL-1βmRNA的表达
I/R组肺组织W/D及MPO活性明显高于sham组,而IpostC组肺组织W/D及MPO活性则明显低于I/R组,3组间比较差异显著(P<0.05),见表2。
表2各组MPO活性和W/D的比较


GroupMPOactivityLungwet/dryratio(W/D)Sham1.1847±0.26364.4935±0.4171I/R2.2732±0.5593#6.6513±0.3820#IPostC1.6317±0.2015*5.5151±0.2693*
#P<0.05vssham group;*P<0.05vsI/R group.
3肺组织病理观察
Sham组肺组织无明显炎症反应。I/R组均出现不同程度的肺泡水肿,毛细血管破裂出血,肺间质增宽并有水肿,炎症细胞浸润,肺泡内有较多血液成分渗出,损伤明显。IPostC组肺间质轻度水肿,少量炎症细胞浸润,肺泡较完整,见图3。

Figure 3. Lung tissue sections were stained with HE for morphological evaluation(×200). A:sham group; B: I/R group; C: IPostC group.
图3肺组织HE染色显示假手术组、缺血再灌注组和后处理组的病理组织学变化
讨 论
Egr-1是首先在小鼠体内发现的一种核转录因子,控制多个下游基因的表达,涉及白细胞的募集与黏附、血液凝固及纤维化[6]。 当机体受到机械损伤、躲避性应激、细胞因子及缺氧等细胞外刺激后,受刺激的组织和细胞就会表达Egr-1。在鼠肺缺血再灌注损伤中,Egr-1 mRNA表达明显升高,并局限于肺巨噬细胞和平滑肌细胞中,而且与野生型小鼠相比,Egr-1基因剔除小鼠体内的炎症介质的水平、纤维蛋白的量及白细胞聚集明显减少,生存期明显延长[7]。陈乾坤等[1]研究证实,在肺缺血再灌注损伤中,通过IL-1β的参与,Egr-1发挥重要的炎症损伤作用,缺血再灌注可以诱导肺组织中Egr-1的表达在短时间内迅速升高,而且其表达量随着再灌注时间的延长而显著增高。本实验中I/R组Egr-1 mRNA表达量明显高于假手术组,与以上研究结果相符,表明再灌注肺组织中Egr-1表达的升高是肺缺血再灌注损伤发生的原因之一。
利用大鼠肺缺血再灌注损伤模型,CO能抑制肺组织Egr-1的表达从而减轻白细胞淤滞和纤维素沉积,促进气体交换而延长大鼠生存期[8]。应用吗替麦考酚酯可减少Egr-1的表达而减轻肺血管通透性、减少髓过氧化物酶含量及肺泡中白细胞计数[9]。说明采取一定的干预措施可以抑制肺组织中Egr-1的表达。
在后处理减轻肺损伤机制的研究中,王继武等[10]报道,给予在体大鼠重复5次的1 min灌注+1 min缺血的后处理,发现缺血后处理组的肺组织中脂质代谢产物丙二醛含量较对照组明显下降,而抗自由基酶超氧化物歧化酶活性明显增加。我们前期的研究发现,后处理可以降低缺血再灌注肺中IL-6、IL-8等细胞因子的表达,减小中性粒细胞炎症反应,从而减轻肺缺血再灌注损伤[5]。鲁建军等[11]利用犬肺移植模型研究发现,缺血后处理可以减轻供体肺的缺血再灌注损伤,改善供体肺功能。本实验中IPostC组Egr-1 mRNA的表达量明显低于I/R组,提示缺血后处理可以抑制缺血再灌注肺组织中Egr-1的表达,这可能是缺血后处理发挥肺保护作用的机制之一。
本实验同时对Egr-1的下游基因IL-1β的表达的变化进行了研究。前炎症因子IL-1β主要由单核细胞和巨噬细胞产生,它的释放是缺血再灌注损伤的机制之一[12]。结果表明,I/R组肺组织中IL-1β mRNA的表达量明显高于假手术组,而IPostC组肺组织中IL-1β mRNA的表达量则明显低于I/R组,此结果与其上游基因Egr-1表达量的改变相一致,提示缺血后处理可以抑制缺血再灌注肺中IL-1β mRNA的表达,并且此作用可能与后处理抑制了IL-1β的上游基因Egr-1的表达密切相关。
中性粒细胞的活化及其所介导的炎症损伤作用是肺缺血再灌注损伤的机制之一[13]。W/D反映肺组织的水肿程度,可直接评价组织炎症损伤程度。本实验对各组肺组织W/D及MPO活性进行测量,结果表明,I/R组肺组织W/D及MPO活性明显高于假手术组,病理切片显示炎症反应明显加重。而IPostC组肺组织W/D及MPO活性均明显低于I/R组,病理学观察发现炎症反应明显减轻。肺组织Egr-1 mRNA的表达量与MPO的活性均呈正相关,提示后处理所引起肺组织炎症反应的改变与其抑制了Egr-1的表达密切相关。
综上所述,缺血后处理能够明显减轻鼠肺缺血再灌注损伤,其机制可能与后处理抑制再灌注损伤鼠肺Egr-1及其下游基因IL-1β的表达有关。
[1] 陈乾坤,姜格宁,丁嘉安,等. 早期生长反应因子-1在移植肺缺血再灌注过程中的炎症损伤作用[J]. 中华器官移植杂志,2008,29(8):464-467.
[2] Rosseau S, Hammerl P, Maus U,et al. Surfactant protein A down-regulates proinflammatory cytokine production evoked by Candida albicans in human alveolar macrophages and monocytes [J]. J Immunol, 1999,163(8):4495-4502.
[3] Yamashita H, Akamine S, Sumida Y, et al. Inhaled nitric oxide attenuates apoptosis in ischemia-reperfusion injury of the rabbit lung[J]. Ann Thorac Surg, 2004,78(1):292-297.
[4] Huang H,Yao T,Wang W,et al. Combination of balanced ultrafiltration with modified ultrafiltration attenuates pulmonary injury in patients undergoing open heart surgery[J]. Chin Med J(Engl), 2003,116(10):1504-1507.
[5] 伍火志,罗常进,袁茂溪. 缺血后处理拮抗鼠肺缺血再灌注损伤的机制研究[J].中国病理生理杂志,2009,25(6):1202-1205.
[6] Harada H, Lama VN, Badri LN, et al. Early growth response gene-1 promotes airway allograft rejection [J]. Am J Physiol Lung Cell Mol Physiol, 2007,293(1):L124-L130.
[7] Yah SF, Fujita T, Lu JS, et al. Egr-1, a master switch coordinating upregulation of divergent gene families underlying ischemic stress[J]. Nature Med, 2000, 6(12):1355-1361.
[8] Hoetzel A, Dolinay T, Vallbracht S, et al. Carbon monoxide protects against ventilator-induced lung injury via PPAR-γ and inhibition of Egr-1 [J]. Am J Respir Crit Care Med, 2008,177(11):1223-1232.
[9] Farivar AS, Mackinnon-Patterson BC, Barnes AD, et al. Cyclosporine modulates the response to hypoxia-reoxygenation in pulmonary artery endothelial cells[J]. Ann Thorac Surg,2005,79(3):1010-1016.
[10]王继武,段明科,马立明. 缺血后处理对肺再灌注损伤中脂质过氧化反应的调整[J]. 中国临床康复, 2005,9(23): 102-103.
[11]鲁建军,翁慧雯,秦存伟,等. 缺血后处理对移植犬肺功能的影响[J]. 中国病理生理杂志, 2009,25(10):1975-1978.
[12]Krishnadasan B, Naidu BV, Byrne K, et al. The role of proinflammatory cytokines in lung ischemia-reperfusion injury [J]. J Thorac Cardiovasc Surg,2003,125(2):261-272.
[13]Kodama T, Yukioka H, Kato T, et al, Neutrophil elastase as a predicting factor for development of acute lung injury [J]. Intern Med,2007,46(11):699-704.
Effectofischemicpost-conditioningonEgr-1andIL-1βexpressioninischemia-reperfusioninjuredlunginrats
WU Huo-zhi, YUAN Jiang, WANG Li-xiang, LIU Xin, HUANG Qing-hua
(DepartmentofCardiothoracicSurgery,TheFifthAffiliatedHospital,ZunyiMedicalCollege,Zhuhai519100,China.E-mail:gary_wu5445@163.com)
AIM: To investigate the protective effects of ischemic post-conditioning on the expression of early growth response factor 1 (Egr-1) and interleukin-1β(IL-1β) in ischemia-reperfusion injured lung in rats.METHODSThe model of lung ischemia-reperfusion injury was established in 24 rats and the rats were randomly allocated to 3 different groups (n=8 in each group): (1) sham group: only sham operation (thoracotomy) and no ischemia for 3 h; (2)ischemia-reperfusion group (I/R group): interruption of pulmonary perfusion and ventilation for 1 h followed by reperfusion for 2 h; (3) ischemic post-conditioning group (IPostC group): ischemic post-conditioning (5 min of reperfusion and 5 min of ischemia for 3 times) between the end of ischemia and the beginning of the reperfusion followed by reperfusion for 1.5 h. The lung tissues (prepared to small pieces of about 20 mg) were collected and homogenized at the end of the experiment. The concentration of myeloperoxidase (MPO) in the homogenate was determined. The wet to dry weight ratio (W/D) of the lung tissues was also measured at the end of reperfusion. The pathological changes of the lung tissues were observed under light microscope after reperfusion. The mRNA expression of Egr-1 and IL-1β in the lung tissues was detected by RT-PCR.RESULTSCompared with sham group, the mRNA expression of Egr-1 and IL-1β, the levels of MPO and W/D were significantly increased in I/R group (P<0.05). The inflammatory responses of the lungs in I/R group were significantly severer than those in sham group. Compared with I/R group, the mRNA expression of Egr-1 and IL-1β, the levels of MPO and W/D in IPostC group were significantly decreased (P<0.05). The inflammatory responses of the lungs in IPostC group were also significantly attenuated.CONCLUSIONIschemic post-conditioning significantly reduces ischemic reperfusion injury of the lung by inhibiting the expression of Egr-1 and IL-1β.
Lung ischemia; Reperfusion injury; Post-conditioning; Early growth response factor-1; Interleukin-1β
R563
A
10.3969/j.issn.1000-4718.2011.01.006
1000-4718(2011)01-0033-04
2010-07-16
2010-09-21
贵州省科学技术基金资助项目(黔科合J字No.20092313)
△通讯作者 Tel:0756-5523329;E-mail:gary_wu5445@163.com

