α-(2-甲基-3-呋喃硫基)酮类肉香味料化合物的合成
田红玉,余洁菲,陈海涛,孙宝国
(北京工商大学化学与环境工程学院,北京100037)
α-(2-甲基-3-呋喃硫基)酮类肉香味料化合物的合成
田红玉,余洁菲,陈海涛,孙宝国
(北京工商大学化学与环境工程学院,北京100037)
α-(2-甲基-3-呋喃硫基)酮类是2-甲基-3-呋喃硫醇的重要衍生物,具有非常独特的肉香味特征。研究了以溴代烷为原料,通过格氏反应、Swern氧化、卤素取代和亲核取代四步反应制备α-(2-甲基-3-呋喃硫基)酮类化合物的方法。首先溴代烷与甲酸乙酯通过格氏反应生成醇,产率85%左右;醇通过Swern氧化得到酮,产率75%左右;所得到的酮与液溴反应制得相应的α-溴代酮,产率70%左右;α-溴代酮在碳酸钾的作用下与2-甲基-3-呋喃硫醇反应,得到最终产物α-(2-甲基-3-呋喃硫基)酮,产率65%左右。最终产物通过1H NMR、13CNMR及MS进行了表征。
α-(2-甲基-3-呋喃硫基)酮,肉味香料化合物,合成
2-甲基-3-呋喃硫醇广泛存在于煮牛肉、猪肉、鸡肉等多种肉制品及许多肉味热反应模型体系的挥发性香成分中,对肉香味具有非常重要的贡献,是目前为止发现的最重要的肉味香料化合物[1-9]。由其衍生的硫醚类化合物也是很重要的肉香味的香料化合物,如甲基2-甲基-3-呋喃基硫醚、甲基2-甲基-3-呋喃基二硫醚、丙基2-甲基-3-呋喃基二硫醚等,这些硫醚类衍生物比2-甲基-3-呋喃硫醇具有更好的稳定性,广泛用于各种香型的肉香味香精的调配中[10]。α-(2-甲基-3-呋喃硫基)酮类也是 2-甲基-3-呋喃硫醇的重要衍生物,具有非常独特的肉香味特征。文献报道的该类化合物的合成是通过相应的酮类化合物与硫酰氯反应得到α-氯代酮,然后在醇钠作用下与2-甲基-3-呋喃硫醇反应得到产物[11]。该路线主要缺点是α-氯代酮不够活泼,发生亲核取代反应比较困难;采用醇钠这样的强碱,副反应多,因此产率低。该系列化合物目前具有FEMA号的有三个,分别为3-(2-甲基-3-呋喃硫基)-4-庚酮、4-(2-甲基-3-呋喃硫基)-5-壬酮和 2,6-二甲基-3-(2-甲基-3-呋喃硫基)-4-庚酮[12]。本文探讨了以相应的卤代烷烃为起始原料,通过格氏反应、氧化反应、α-溴代反应和亲核取代反应制备上述三个肉香味化合物的方法,合成路线如图1所示。
1 材料与方法
1.1 材料与仪器
1-溴-2-甲基丙烷 购自Sigma-Aldrich公司,纯度99%;其它试剂 均为分析纯,购自北京化学试剂公司。
Bruker AV400核磁共振仪,6890N/5973I气相色谱-质谱联用仪(Agilent)。
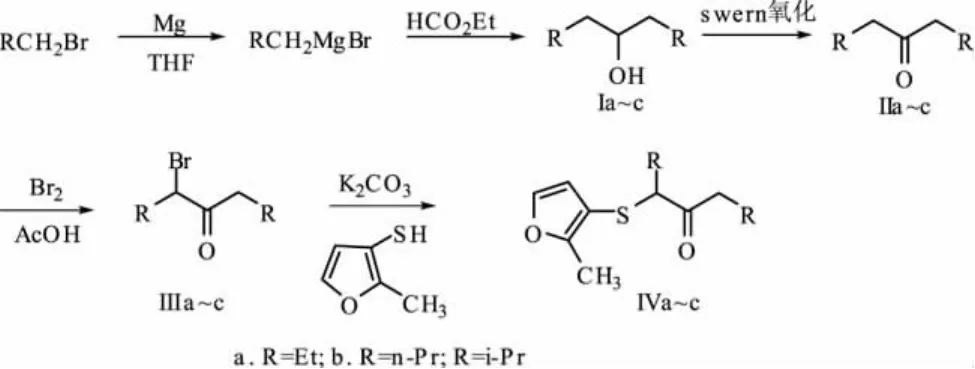
图1 α-(2-甲基-3-呋喃硫基)酮类的合成
1.2 4-庚醇(Ia)的制备
在氮气保护下,往250m L圆底烧瓶瓶中加入100m L无水THF、8.64g镁粉(0.36mol)和一小粒碘。将27m L溴丙烷(0.3mol)溶解在20m L无水THF中,往烧瓶中加入1m L溴丙烷溶液,加热引发反应,然后缓慢滴加剩余溴乙烷溶液,保持回流。滴加完毕后,继续搅拌回流0.5h,溶液冷却,制得丙基溴化镁的THF溶液。
将8m L甲酸乙酯(0.1mol)溶解在10m L无水THF中,滴加到丙基溴化镁的THF溶液中,冰水浴控制温度在30℃左右,滴加完毕后再加热回流30m in。反应混合物先旋蒸除去大量的四氢呋喃,加入50m L水稀释,用稀盐酸中和至中性。水相用乙醚萃取(100m L×3)。合并有机相,用饱和食盐水洗涤,无水硫酸镁干燥。旋蒸除去溶剂,减压蒸馏,收集45℃/600Pa的馏分,得到10g无色液体,产率86%。
产品结构通过1H NMR和质谱进行了确认。MS(EI),m/z:115(M+-1)。1H NMR(CDCl3),δ:0.90(t,6H),1.20~1.60(m,8H),3.61(m,1H),4.05(br,1H)。
5-壬醇(Ib)和2,6-二甲基-4-庚醇(Ic)的制备同上。5-壬醇(Ib):产率88%。MS(EI),m/z:143(M+-1)。1H NMR(CDCl3),δ:0.90(t,6H),1.22~1.65(m,12H),3.58(m,1H),4.26(br,1H)。2,6-二甲基-4-庚醇(Ic):产率 83%。MS(EI),m/z:143(M+-1)。1H NMR(CDCl3),δ:0.91(d,12H),1.22(m,2H),1.35(m,2H),1.77(m,2H),3.75(m,1H),4.10(br,1H)。
1.3 4-庚酮(IIa)的制备
在氮气保护下,往250m L圆底烧瓶中加入10m L草酰氯(0.12mol)、50m L无水二氯甲烷,冷却至-78℃,缓慢滴加无水8m L DMSO(0.11mol)的无水二氯甲烷(50m L)溶液。滴加完毕后,搅拌5m in,加入6.96g 4-庚醇(0.06mol)的无水二氯甲烷(50m L)溶液。在-78℃下搅拌15m in后,滴加42m L无水三乙胺(0.3mol),在-78℃搅拌反应10m in。反应混合物升至室温,依次用饱和氯化铵和饱和食盐水洗涤,无水硫酸镁干燥。过滤后旋蒸除去二氯甲烷,产物减压蒸馏,收集82~86℃/850Pa的馏分,得到5.2g浅黄色粘稠液体,产率76%。
产品结构通过1H NMR和质谱进行了确认。MS(EI),m/z:114(M+)。1H NMR(CDCl3),δ:0.91(t,6H),1.60(m,4H),2.56(t,4H)。
5-壬酮(IIb)和 2,6-二甲基-4-庚酮(IIc)的制备同上。5-壬酮(IIb):产率72%。MS(EI),m/z:142(M+)。1H NMR(CDCl3),δ:0.89(t,6H),1.28(m,4H),1.56(m,4H),2.38(t,4H)。2,6-二甲基-4-庚酮(IIc):产率 70%。MS(EI),m/z:142(M+)。1H NMR(CDCl3),δ:0.92(d,12H),2.15(m,2H),2.25(d,4H)。
1.4 3-溴-4-庚酮(IIIa)的制备
往50m L圆底烧瓶内加入2.6g 4-庚酮(22mmol)、10m L冰醋酸和50m L水,搅拌加热到70~80℃,滴加4.5g液溴(28mmol),控制滴加速度避免液溴累积,滴加完毕后再搅拌反应30m in。反应混合物用冰水浴冷却至10℃左右,用饱和碳酸氢钠溶液调节pH至中性,用二氯甲烷萃取(100m L×3)。合并有机相,用无水硫酸镁干燥,过滤,旋蒸除去溶剂。减压蒸馏,收集48℃/500Pa的馏分,得到淡黄色液体2.9g,产率68%。
产品结构通过1H NMR和质谱进行了确认。MS(EI),m/z:192,194(M+)。1H NMR(CDCl3),δ:0.94(t,3H),1.02(t,3H),1.66(m,2H),1.95(m,1H),2.04(m,1H),2.66(m,2H),4.19(t,1H)。
4-溴-5-壬酮(IIIb)和2,6-二甲基-3-溴-4-庚酮(IIIc)的制备同上。4-溴-5-壬酮(IIIb):产率71%。MS(EI),m/z:220,222(M+)。1H NMR(CDCl3),δ:0.95(m,6H),1.35(m,2H),1.49~1.68(m,4H),1.96(m,2H),2.68(m,2H),4.27(t,1H)。2,6-二甲基-3-溴-4-庚酮(IIIc):产率 65%。MS(EI),m/z:220,222(M+)。1H NMR(CDCl3),δ:0.94(d,6H),0.98(d,3H),1.10(d,3H),2.22(m,2H),2.49(d × d,1H),2.59(d × d,,1H),4.02(d,1H)。
1.5 3-(2-甲基-3-呋喃硫基)-4-庚酮(IVa)的制备
在50m L四口烧瓶中加入0.3g 2-甲基-3-硫基呋喃(2.5mmol)﹑0.4g碳酸钾(3mmol)﹑乙腈20m L和少许冠醚,搅拌加热至回流,缓慢滴加0.4g 3-溴-4-庚酮(2mmol)。滴加完毕后,GC跟踪反应,直至原料3-溴-4-庚酮完全消失(反应约3~4h)。然后反应混合物冷却至室温,旋蒸除去大量乙腈,加入约30m L水,用稀盐酸中和至中性,乙醚萃取(30m L×3)。合并有机相,用无水硫酸镁干燥,过滤,旋蒸除去溶剂。产物通过柱层析分离[硅胶柱,V(石油醚)/V(乙酸乙酯)=10/1洗脱],得到浅黄色粘稠液体0.3g,产率66%。
产品结构通过1H NMR、13C NMR和质谱进行了确认。1H NMR(CDCl3),δ:1.01(m,6H),1.64(m,3H),1.78(m,1H),2.30(s,3H),2.51(m,1H),2.62(m,1H),3.23(t,1H),6.22(d,1H),7.25(d,1H)。13C NMR(CDCl3),δ:11.27,11.77,13.69,17.34,23.07,42.23,57.72,107.01,115.30,140.57,156.64,206.63。MS(EI),m/z:226(M+)。
4-(2-甲基-3-呋喃硫基)-5-壬酮(IVb)和2,6-二甲基-3-(2-甲基-3-呋喃硫基)-4-庚酮(IVc)的制备同上。4-(2-甲基-3-呋喃硫基)-5-壬酮(IVb):产率 63%。1H NMR(CDCl3),δ:0.91(m,6H),1.35(m,2H),1.46(m,2H),1.60(m,2H),1.71(m,2H),2.29(s,3H),2.52(m,1H),2.63(m,1H),3.31(t,1H),6.22(d,1H),7.25(d,1H)。13C NMR(CDCl3),δ:11.82,11.91,13.89,20.51,22.40,26.14,31.95,40.05,55.76,107.17,115.44,140.81,156.72,206.70。MS(EI),m/z:254(M+)。2,6-二甲基-3-(2-甲基-3-呋喃硫基)-4-庚酮(IVc):产率68%。1H NMR(CDCl3),δ:0.92(m,9H),1.16(d,3H),1.97(m,1H),2.09(m,1H),2.29(s,3H),2.40(d × d,1H),2.50(d ×d,1H),3.01(d,1H),6.26(d,1H),7.25(d,1H)。13C NMR(CDCl3),δ:11.82,20.44,20.83,22.42,22.69,24.07,28,33,50.10,64.44,107.85,114.87,140.59,156.03,206.02 。MS(EI),m/z:254(M+)。
2 结果与讨论
在本文合成路线中,首先以相应的溴代烷烃为原料,通过格氏反应与甲酸乙酯反应,分别制得4-庚醇(Ia)、5-壬醇(Ib)和 2,6-二甲基-4-庚醇(Ic),产率85%左右,在产物的质谱图中都有相应的M+-1峰。所得醇经过Swern氧化得到相应的酮。本文对4-庚醇氧化制备4-庚酮的投料比进行了考察,实验结果见表1。实验结果表明,氧化剂用量对4-庚酮产率产生明显的影响。当4-庚醇与草酰氯、DMSO的摩尔比为 1∶1.2∶1.1时,4-庚酮(IIa)产率只有52%;随着氧化剂用量增加,4-庚酮产率明显提高。当4-庚醇与草酰氯、DMSO 的摩尔比为 1∶2.0∶1.8时,4-庚酮产率达到76%;5-壬醇和2,6-二甲基-4-庚醇在该投料比条件下进行氧化,产率都在70%以上。

表1 投料比对4-庚酮产率的影响
所得到的酮与溴反应得到相应的α-溴代酮,液溴的用量和滴加的速度都对反应产生明显的影响。液溴过量,滴加速度过快,都会导致二溴取代的产物生成。实验结果表明,控制液溴与酮的摩尔比在1.2∶1到1.4∶1之间,在滴加液溴的过程中注意避免溴的累积,可有效减少二溴取代产物的形成,α-溴代酮的产率在70%左右。在所得到的三个α-溴代酮的质谱图中,分子离子峰都以同位素峰族的形式存在。
本文试图参照文献方法,2-甲基-3-呋喃硫醇在甲醇溶液中在甲醇钠的作用下与α-溴代酮反应,所得到产物产率非常低。改用碳酸钾,在乙腈溶液中回流,α-(2-甲基-3-呋喃硫基)酮(IVa-c)的产率可达到65%左右。最终产物通过1H NMR、13C NMR和MS进行了鉴定。在产物的1H NMR图中,与羰基相连的亚甲基的两个氢受羰基另一侧的碳手性中心的影响表现出化学位移不等价,3-(2-甲基-3-呋喃硫基)-4-庚酮和 4-(2-甲基-3-呋喃硫基)-5-壬酮的亚甲基表现为两组多重峰,2,6-二甲基-3-(2-甲基-3-呋喃硫基)-4-庚酮的亚甲基则表现为两组d×d峰。
3 结论
本文研究了以溴代烷为原料,通过格氏反应与甲酸乙酯得到相应的醇,然后通过Swern氧化得到酮。酮与液溴反应制得α-溴代酮后,在碳酸钾的作用下与2-甲基-3-呋喃硫醇反应,得到最终产物α-(2-甲基-3-呋喃硫基)酮。路线总收率产率30%左右。与文献中由相应的α-氯代酮在甲醇钠作用下与2-甲基-3-呋喃硫醇反应的合成方法相比,该路线操作更为简便,且产率更高。
[1]Song H,Xia L.Aroma extract dilution analysis of a beef flavouring prepared from flavour precursors and enzymatically hydrolysed beef [J].Flavour and Fragrance Journal,2008,23(3):185-193.
[2]Cerny C,Briffod M.Effect of pH on the Maillard Reaction of[13C5]Xylose,Cysteine,and Thiamin [J].Journal of Agricultural and Food Chemistry,2007,55(4):1552-1556.
[3]Aliani M,Farmer L J.Precursors of Chicken Flavor.II.Identification of Key Flavor Precursors Using Sensory Methods[J].Journal of Agricultural and Food Chemistry,2005,53(16):6455-6462.
[4]Cerny C,Davidek T.α-Mercaptoketone Formation during the Maillard Reaction of Cysteine and [1-13C]Ribose [J].Journalof Agricultural and Food Chemistry,2004,52(4):958-961.
[5]Carrapiso A I,Ventanas J,Garcia C.Characterization of the Most Odor-Active Compounds of Iberian Ham Headspace [J].Journal of Agricultural and Food Chemistry,2002,50(7):1996 -2000.
[6]Kerscher R,Grosch W.Quantification of 2-Methyl-3-furanthiol,2- Furfurylthiol,3- Mercapto-2- pentanone,and 2-Mercapto-3-pentanone in Heated Meat[J].Journal of Agricultural and Food Chemistry,1998,46(5):1954-1958.
[7]Farkas P,Sadecka J,Kovac M,et al.Key Odourants of Pressure-Cooked Hen Meat[J].Food Chemistry,1997,60(4):617-621.
[8]Hofmann T,Schieberle P.Evaluation of the Key Odorants in a Thermally Treated Solution of Ribose and Cysteine by Aroma Extract Dilution Techniques [J].Journal of Agricultural and Food Chemistry,1995,43(8):2187-2194.
[9]Meynier A,Mottram D S.The effect of pH on the formation of volatile compounds in meat-related model systems [J].Food Chemistry,1995,52(4):361-366.
[10]孙宝国.含硫香料化学[M].北京:科学出版社,2007:75-76,109-110.
[11]Evers W J,Heinsohn H H,Vock M H,et al.Novel 3-furyl beta oxoalkyl sulfides,processes for producing same and methods for using same for altering the organoleptic properties of foodstuffs[P].US:3985907,1976-10-12.
[12]Burdock G A.Fenaroli’s Handbook of Flavor Ingredients[M].Florida:CRC Press,2005:473-474,1193-1194.
Synthesis ofα-(2-methyl-3-furylthio)ketones as meaty flavors
TIAN Hong-yu,YU Jie-fei,CHEN Hai-tao,SUN Bao-guo
(School of Chemistry and Environmental Engineering,Beijing Technology and Business University,Beijing 100037,China)
α-(2-M ethyl-3-furylthio)ketones are the im portant derivatives of 2-m ethyl-3-furyl thiol and have very uniquemeaty flavor properties.They were synthesized starting from bromoalkanes by the Grignard reaction,the Swern oxidation,halosubstitution and nucleophilic substitution.Bromoalkanes reacted w ith ethyl formate by the Grignard reaction to give alcohols in about 85%yield,the alcohols obtained were oxidized by the Swern oxidation to produce the corresponding ketones in about 75%yield.α-brom oketones were prepared by the reactions of ketones w ith brom ine in about 70%yield.α-bromoketones reacted w ith 2-m ethyl-3-furyl thiol in the presence of K2CO3to give α-(2-methyl-3-furylthio)ketones in about 65%yield.The final products were characterized by1H NMR,13C NMR and M S.
α-(2-Methyl-3-furylthio)ketones;meaty flavors;synthesis
TS202.3
A
1002-0306(2011)06-0339-03
2010-12-08
田红玉(1972-),女,副教授,主要从事有机合成以及合成香料的开发。
北京市属高等学校人才强教计划资助项目(PHR201008244,PHR20090504)。

