基于图像的计算机辅助软组织导航技术
李雪琦,马宝秋,张国鹏,朱 霆,卢虹冰
基于图像的计算机辅助软组织导航技术
李雪琦,马宝秋,张国鹏,朱 霆,卢虹冰
介绍了基于图像的软组织导航技术和发展过程,从术前计划、术中导航和术后验证3个阶段探索了导航技术的原理、过程,通过系统框架、组成及过程等几个方面阐述了该技术的理论及实现方案,可辅助医生进行更精确、微创、安全、快速的手术治疗,并拓展了外科手术的适应症范围,在临床上具有广泛的应用前景。
软组织;图像导航;计算机辅助手术
AbstractThe technique and developing progress on image-based soft tissue navigation for computer aided surgery are introduced.The principle and process of image-based soft tissue navigation are expounded in the three stages of preoperation,intraoperation and postoperation.Through analyses of the framework,composition and process,the theory and realization are proposed and discussed.The technique of image-based soft tissue navigation can extend the indications of surgery,which can make surgery more accurate,minimally invasive,safer and faster.The technique will show wide prospects in the future.[Chinese Medical Equipment Journal,2011,32(2):125-126]
Key wordssoft tissue;image guided navigation;CAS
1 引言
计算机辅助手术(computer-aided surgery,CAS)技术是指利用现代计算机、光学、电磁、三维成像等技术手段,为实施手术的医生提供直观的融合有病灶图像、关键组织或器官位置、各手术器械定位等信息在内的模拟手术场景的导航图像,以辅助手术过程的技术的总称。CAS技术具有增加医生对解剖结构的理解、降低周围组织损伤、减少手术并发症、增加术中患者安全性等优点[1],可降低手术的难度、提高临床医生手术的准确性,因此近年来在神经外科、耳鼻喉科、骨科(脊柱及关节)等手术以及活检切除、组织消融等介入治疗中得到快速发展及广泛应用。
由于目前大部分CAS系统均基于刚性解剖结构假设,而在腹部开放或微创手术中,由于没有骨骼的支撑,任何外部压力均会使腹腔内的肝脏、肾脏等软组织发生形变,甚至血压的变化都会影响像肝脏这样的软组织的外形[2],加上呼吸的影响,产生的软组织形变很难预测。这不但降低了术前图像在术中的价值,而且也使传统的CAS技术很难对这类手术提供有效支持,这就强化了对胸腹部导航技术的迫切需求。
本文将通过对相关文献的回顾及讨论,研究探索基于图像的计算机辅助软组织导航技术的原理、过程及实现。按照手术实施的过程,我们将软组织导航的流程分为术前计划、术中导航和术后验证3个阶段,并在下面各节分别阐述。
2 术前计划
术前计划主要完成以下基本工作:
(1)患者三维图像的获取。此部分和传统的CAS过程基本相同,目的是得到解剖结构的三维分布,常用成像设备包括CT、螺旋CT或MRI。对于CT图像的切片厚度,文献中报道一般为1~2 mm。鉴于MRI较高的软组织分辨力,更适用于腹部解剖结构的三维成像。为了提高导航的精度,在成像前需在患者身上放置一定数目的标示物,通过对标示物位置的识别,实现对成像空间和定位系统的注册和配准,用于术中导航。
(2)病灶感兴趣区域(ROI)的划分。利用图像处理工具及算法,从患者的扫描图像中划分出病灶区域及周围的重要组织结构,通过三维重建可以得到相应ROI区域的三维模型,以便对病情进行分析。
(3)制定手术计划。针对患者情况,制定详细的手术实施方案。如果需要,医生可以通过术前计划系统进行模拟手术,以更好地设计手术入路及步骤,为手术的顺利实施提供基础。
3 术中导航
术中导航部分主要针对手术实施阶段,传统CAS技术主要包括3个必须的要素[4]:可被跟踪的手术器械、可以跟踪手术器械的导航定位系统和配准算法。对于软组织的术中导航,为了反映术中组织结构的运动和形变,还必须包括一个要素,即可以获得术中患者实时变化的成像系统。图1给出了软组织术中导航系统的主要构成,下面对各个构成要素分别进行分析和讨论。
3.1 定位及术中成像系统
(1)术中定位系统的选择。对于CAS技术,理想的定位设备应具有以下属性:小型、完全(可6个自由度定位)、精确(分辨率<1 mm 及 0.1°)、快速(更新率>1 000 Hz,等待时间<1 ms)、并行(可同时跟踪多个目标)、不被阻挡、鲁棒(不受环境影响)、工作区域大、可长时无线操作且价格便宜。医学领域常用的跟踪技术包括机械臂、光纤跟踪、光学跟踪、电磁跟踪及基于超声的跟踪等,已有很多文献对不同跟踪技术的特点进行了综述。近年来,随着技术的发展,光学及电磁定位装置得到了广泛应用。与光学定位的高分辨率(<0.1 mm)相比,电磁定位的精度约为1 mm和0.5°,且易受工作范围内金属物或电磁场环境的影响。由于电磁定位不受遮挡物的影响,且传感器体积小,可实现对体内器械的追踪,同时采取适当措施可使手术环境对系统的影响控制在可接受的范围内。因此,对于软组织手术导航,由于腹部器官(例如肝脏)多位于人体较深部位,光学定位易受遮挡,无法深入人体内部,电磁定位更具有优势[6-7]。
作者单位:710032 西安 第四军医大学生物医学工程系(李雪琦、马宝秋、张国鹏、朱 霆、卢虹冰)
(2)术中成像系统的选择。目前术中成像的手段主要包括:超声成像、内窥镜摄像成像、动态X射线成像、CT/MRI成像、混合成像。其中,术中CT/MRI成像设备复杂昂贵且无法实时成像,在临床中的应用受到技术及资金的限制。前3种成像技术可实现实时成像,因而对软组织形变的跟踪更有优势。但由于这3种成像手段一般得到的是感兴趣区域的二维成像,故很难直接获得完整的、实时的人体组织三维成像,因此在软组织导航方案中需要将术中导航定位系统与实时成像系统结合,在成像探头上添加定位传感器,获得实时二维图像的位置信息,并与术前三维图像相结合,利用术中图像不断对术前图像及计划进行校正来反映术中人体软组织的三维形变。考虑到X线的辐射影响,超声成像作为软组织的术中图像采集方式更为适宜[2]。在微创手术中,内窥镜成像可以清楚地显示手术区域周围表面的情况,但由于内窥镜的视场较小,因此可与超声成像互补,通过混合成像的方式进行。在的应用中,可采用的组合方式有:超声+电磁或光学定位 (用于开放手术),超声+电磁+内窥镜(用于微创手术)[1-3]。
3.2 导航信息的配准与融合
在导航过程中,只有将术前成像、术中成像、手术器械、患者所处物理空间与定位系统的坐标进行统一,才能为手术提供更准确的定位信息。此过程主要分为2步:一是使这些影像及信息的坐标系达到空间位置的一致,即配准过程;二是对已配准图像及位置信息的综合显示,即融合过程。
(1)配准过程:图像配准就是通过寻找一种(或一系列)空间变换,使2幅图像的对应点达到空间位置和解剖结构上的完全一致。在软组织导航手术中,在采用单一导航方式和单一术中成像方式的情况下,需要进行以下3个配准过程:①术前图像坐标与手术患者空间的配准;②术中图像坐标与术前图像坐标的配准;③手术器械位置及坐标与术前图像的配准。具体实现方案如图2所示。
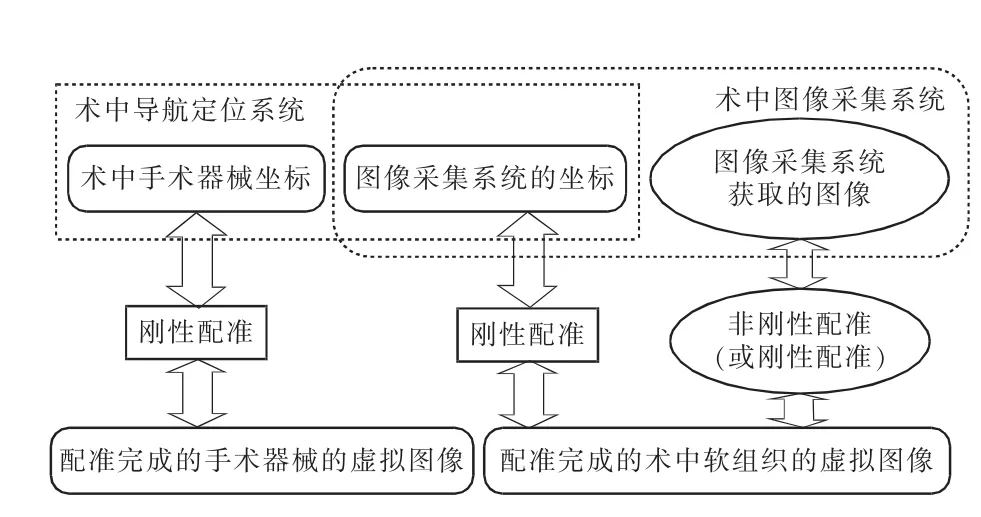
图2 术前、术中图像与手术器械的配准过程
为了提高导航的准确度,在术前需要先完成上述配准过程,再进一步开展手术,因此称为术前配准。在手术过程中,由于间隔一段时间后或软组织发生变形会引起定位误差,为了得到软组织器官的正确反映,需要对术中图像与术前图像进行多次配准,即为术中配准;当然,术中配准的时间应越短越好,一般应控制在1 min以内。当患者移动或医生认为需要校正图像时,重复以上术中配准的过程进行重新校正,再继续进行手术。如果需要,术中也可以通过患者身上的标示物进行定位系统与术前图像或计划的再配准[7]。
(2)融合过程:术中软组织导航需要将多种图像及信息进行融合并综合显示,包括术前图像、感兴趣区域的三维模型、手术器械位置信息、术中图像及位置信息与术前图像或模型的融合等,因此对融合效果及可视化算法的速度要求较高。
4 术后验证及展望
术后验证的目标是综合术前计划阶段和术中导航阶段的信息和结果,根据患者术后的恢复情况进行手术效果的分析、验证和综合评价,并对患者的愈后进行评估,为患者的下一步治疗做好准备。术后验证对于评价手术方案、改进手术效果、对术中导航过程进行修改和完善具有重要作用。
随着计算机及成像技术的发展,基于图像的软组织导航技术近年来得到了广泛关注。目前,该项技术仍处于探索阶段,还有许多值得研究和完善的领域。目前软组织导航技术主要应用在肝脏手术中,在子宫肌瘤的消融治疗、前列腺、肾切除手术中亦有报道。该技术的深入研究将为医生提供适用于软组织手术的导航系统,辅助医生进行更为精确、微创、安全、快速的手术治疗。同时,还可拓展外科手术的适应证范围,使以往的手术禁区在导航系统的辅助下成为适应证,扩大微创/介入治疗的适用范围,因而具有广泛的应用前景。
[1]Eliashar R,Sichel J Y,Gross M,et al.Image guided navigation system—a new technology for complex endoscopic endonasal surgery[J].Postgrad Med J,2003,79:686-690.
[2]Yuichi T,Nobuhiko S,Toshihiko S,et al.Surface-based registration accuracy of CT-based image-guided spine surgery[J].CAOS USA 2000 meeting in Pittsburgh,Eur Spine J,2005,14:291-297.
[3]KurtS,MichaelF,MarkusD,etal.Stabilityofminiatureelectromagnetictrackingsystems[J].PhysMedBiol,2005,50:2 089-2 098.
[4]Beller S,Huenerbein M,Lange T,et al.Feasibility and accuracy of image guided liver resection using 3D ultrasound-based optoelectronic navigation[J].Int J CARS,2007,2(Suppl 1):273-S282.
[5]Filip B,Jonathan T,Sheng Xu,et al.Precision targeting of liver lesions using a novel electromagnetic navigation device in physiologic phantom and swine[J].Med Phys,2005,32(8):2 698-2 705.
[6]Wagner A,Schicho K,Birkfellner W,et al.Quantitative analysis of factors affecting intraoperative precisionand stability of optoelectronic and electromagnetic tracking systems[J].Med Phys,2002,29(5):905-912.
[7]Wollf A,Tangen G A,Solberg O V,et al.Real-time endoscope and intraoperative ultrasound integration in computer assisted navigated surgery[J].International Congress Series,2005,1 281:606-611.
(收稿:2010-09-30 修回:2010-11-24)
Image-based Soft Tissue Navigation for Computer Aided Surgery
LI Xue-qi,MA Bao-qiu,ZHANG Guo-peng,ZHU Ting,LU Hong-bing
(Faculty of Biomedical Engineering,the Fourth Military Medical University,Xi'an 710032,China)
TP391.7
B
1003-8868(2011)02-0125-02
李雪琦(1970-),女,山东宁津人,硕士,讲师,主要从事生物医学工程方面的研究工作,E-mail:tyjlxq@fmmu.edu.cn。
卢虹冰,E-mail:luhb@fmmu.edu.cn