运动、膳食干预对瘦素抵抗大鼠中枢受体后信号通路作用机制的研究
谈 艳,陈文鹤,郭 黎,孙庆艳
运动、膳食干预对瘦素抵抗大鼠中枢受体后信号通路作用机制的研究
谈 艳1,陈文鹤2,郭 黎2,孙庆艳3
大多数肥胖症患者体内表现为高瘦素(Leptin)水平及对瘦素治疗不敏感,提示其存在瘦素抵抗现象,而饮食诱导的肥胖通常与中枢瘦素抵抗和外周瘦素抵抗相联系[39]。瘦素主要是通过中枢限制食物的摄入和增加能量消耗而达到控制体重的目的,因此,弄清中枢瘦素抵抗的发生机制显得尤为重要。关于瘦素抵抗发生众多机制的研究中,细胞因子信号转导抑制蛋白3(SOCS3)被认为是瘦素抵抗、胰岛素抵抗信号通路的负性调节因子之一。特别是它对瘦素在中枢神经系统中敏感性调节起到关键性的作用,而运动、膳食干预又是改善肥胖的主要手段之一[20,30]。目前,关于运动与瘦素的研究较多,但有关运动、膳食干预对SOCS3、中枢长型瘦素受体(LP-Rb)及其受体后Janus激酶-转录子的单转导体和活化体(JAK-STAT)通路的影响却鲜有报道。因而,探讨 SOCS3在运动、膳食干预下的变化及其在瘦素抵抗中的作用,将为瘦素抵抗发生机制的研究提供新视角,为推广运动联合膳食调控的科学减肥方法提供实验依据。
尽管目前关于瘦素抵抗取得了一定的研究进展,但仍然有一些问题需要进一步展开研究和讨论:1)中枢瘦素抵抗发生的机制尚未完全明了,SOCS3是由瘦素诱导的潜在瘦素抵抗因子,它对瘦素信号通路的抑制作用及其自身的调控因素目前还有待于进一步阐明;2)有氧运动是否可以增加肥胖症患者LP-Rb水平,从而使其与体内的瘦素结合,激活受体后通路,增加热量消耗,达到减肥的目的;3)运动和膳食干预是否会对SOCS3产生影响,其具体机制是什么。
基于以上研究背景,本研究通过对肥胖伴有瘦素抵抗现象的大鼠进行有氧运动及降低热量摄入的膳食干预,观察其下丘脑中SOCS3、LP-Rb及信号转换和转录激活因子3(STAT 3)磷酸化水平这几项指标的变化,探讨运动、膳食干预是否能够通过SOCS3变化影响下丘脑LP-Rb及受体后主要信号转导通路JAK2-STAT 3活化水平,继而改善瘦素抵抗现象。
1 材料与方法
1.1 实验动物分组
健康、雄性纯系7周龄 Sprague-Dawley(SD)大鼠130只,体重206~257g,购于上海西普尔—必凯实验动物有限公司。参照随机数字表分组,空白对照组(C组,n=10);高脂膳食模型组(H组,n=120)。分笼饲养,每笼5只。室温22℃±2℃,相对湿度55.6%±4%。每日光照黑暗时间各为12 h,自由饮水、活动,不限饲料量,每天早晚2次添加饲料,保证饲料供应。
采用不同喂养方式8周后,筛选高脂膳食模型组体重排序前1/3的40只大鼠,与对照组比较体重、血清瘦素水平及判断肥胖程度的相对指标——Lees指数[29]。建模成功后,高脂膳食建模组大鼠重新随机分组为高脂膳食对照组(H16)、高脂膳食运动组(HHE)、普通膳食运动组(HNE)、普通膳食组(HN)及原有的空白对照组(N16)。
1.2 实验动物喂养
标准啮齿类动物饲料适应性喂养7天,然后,分别给予对照组和建模组不同饲料喂养,连续喂养8周。普通标准啮齿类饲料由中国人民解放军第二军医大学动物实验中心提供,高脂饲料由中国科学院上海实验动物中心上海斯莱克实验动物有限责任公司提供。高脂饲料配方在参考孙志等人方法的基础上改进[7]。在普通饲料中添加10%猪油,15%蔗糖,0.2%胆固醇,0.2%蛋黄及少量维生素和矿物质。高脂饲料低温保存,喂养前复温24 h后给食。
1.3 运动干预方案
根据运动减肥中运动强度应为中、小强度有氧运动的原则,动物运动干预采用段式 PT-98型动物跑台进行训练,运动训练方案参考Bedford动物运动负荷方案等文献制定[11]。为了使大鼠逐渐适应运动强度,运动开始时连续运动9天,第1天跑速10 m/min,持续时间20 min,以后隔日增加强度2 m/min,持续时间增加10 min,第9天起跑速达18 m/min,持续时间达60 min,5%的坡度。在第5~8周将跑速调节到20 m/min,其余和前4周相同,每周运动5天,共运动8周。在运动实施前预实验中分别检测了大鼠安静及运动后血乳酸值,分别为2.3±0.4 mmol/L及3.7±0.6 mmol/L,提示,训练属于中等强度有氧运动。
作者单位:1.南京邮电大学体育部体育科学研究所,江苏南京210046;2.上海体育学院运动科学学院,上海200438;3.安徽师范大学生命科学院,安徽芜湖241000
1.4 取材
分别于实验第8周和第16周末,运动组运动48 h后,通过大鼠眼球后内眦静脉采血测试部分血液指标。第16周采血后,运动组恢复运动1天,距最后一次运动48 h后进行取材。所有大鼠禁食12 h,用10%水合氯醛(400 mg/kg)腹腔内注射麻醉成功后,将大鼠仰卧固定于自制的手术台上,打开腹腔与胸腔,于下腔静脉取血约8 ml左右,静置待血清析出,3 000 rpm离心5 min分离血清,于-20℃冰箱保存待检。
取血后,即刻将大鼠断头,以组织剪沿头部正中矢状轴剪开皮毛、颅骨,再以小号咬骨钳咬断、剔除颅骨,暴露脑组织。在4℃冰面上,轻轻翻转脑组织,分离脑区,以灰结节和视交叉之间的中心点为中心确定下丘脑组织(前界为视交叉前缘,后界为乳头体后缘,两侧为颞侧沟,宽约4 mm,深约2 mm,长约4 mm),取出下丘脑组织,迅速投入液氮中保存备用。
1.5 指标测定方法
1.5.1 体重、Lees指数测定
每周周二统一时间由专人称量大鼠体重、测量鼻尖到肛门的长度,计算Lees指数。
1.5.2 血清瘦素水平测定
血清瘦素水平采用酶联免疫吸附法测定(ELISA)。试剂盒由美国R&D公司提供,MK3型酶标仪为芬兰 Thermo公司产。
1.5.3 下丘脑 SOCS3、LP-Rb、STAT3、p-STAT3蛋白免疫印迹测定
采用Western blot法检测大鼠下丘脑中SOCS3水平,以 GAPDH为内参对照。1)组织总蛋白提取:取冻融下丘脑约100 mg,加含抑制剂预冷的蛋白质抽提试剂,每次30 s低速匀浆,至组织完全裂解,裂解液于预冷的离心机中12 000 rpm离心15 min,取上清液。2)蛋白浓度测定:以BCA蛋白定量法测定上清液中蛋白浓度。3)SDS-PAGE电泳、转膜:将蛋白样品加入3×上样缓冲液,煮沸3~5 min后冰浴5 min,经 SDS-PAGE电泳后,转移至 PVDF膜(恒流200 mA,h)。4)膜的封闭和抗体孵育:用 TBST洗PDF膜3次后,置封闭液(含5%BSA+TBST)中于水平摇床上缓慢摇动,室温下封闭1 h封闭膜上非特异结合;封闭后分别加入一级抗体孵育4℃过夜(兔抗大鼠SOCS3抗体1∶1 000,博奥森生物技术有限公司;兔抗大鼠LP-Rb抗体1∶1 000,博士德生物工程有限公司;兔抗大鼠STAT 3抗体1∶1 000,博士德生物工程有限公司;兔抗大鼠 Phospho-STAT 3(Tyr705)抗体1∶500,Bioworld Technology公司)和 GAPDH一抗;TBST洗膜后加入 HRP标记的二级抗体(1∶3 000)以结合一级抗体。5)蛋白检测:PVDF膜蛋白面向上,反应液铺于膜上室温孵育3 min;膜夹于两塑料薄膜中,于暗室中压片,以 X光胶片曝光,显影定影后胶片备存;扫描图片,以 ImageJ分析软件进行分析比较。电泳、转移装置为美国BIO-RAD公司产。
1.5.4 下丘脑SOCS3 mRNA表达测定
采用实时荧光定量 PCR法测定大鼠下丘脑 SOCS3 mRNA表达。Realtime PCR引物由ABI公司引物设计软件Primer 5.0设计,以 GADPH为内参,引物由上海康成生物公司合成。
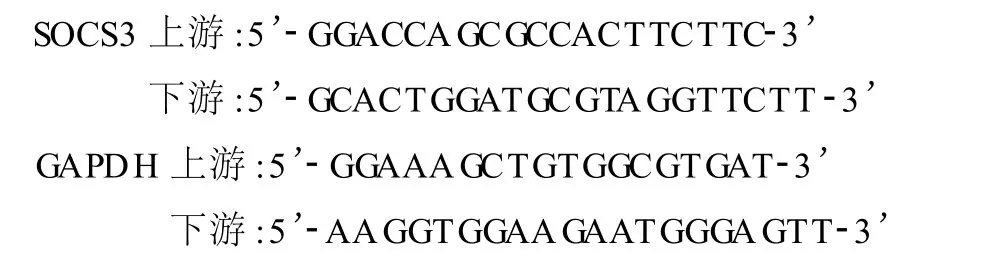
1)总 RNA抽提:每约50 mg组织样品中,加入约1 ml TRIZOL试剂后匀浆。每1 ml匀浆样品中加入约0.2 ml氯仿,于4℃12 000 rpm离心15 min,取上层水相至新离心管,加入 0.5 ml异丙醇混匀,15℃~30℃孵育10 min后,于4℃12 000 rpm离心10 min;弃上清,加入75%乙醇1 ml洗涤,7 500 rpm离心5 min;空气中自然干燥RNA沉淀约5~10 min,加入DEPC处理水。2)逆转录合成 CDNA:总 ENA为2μg,反应体系总体积为20μg。3)PCR反应:PCR反应溶液于 Realtime-PCR仪上进行 PCR反应,95℃,5 min;35个 PCR循环(95℃,10 s;58℃,15 s;72℃,20 s;81℃,5 s)。扩增反应结束后,继续从72℃缓慢加热至99℃以便建立PCR产物熔解曲线。PCR仪在扩增过程中自动汇总采集荧光信号,并转换成待测样品的Ct值(循环阈值)。4)反应产物检测及定量分析:根据梯度稀释DNA标准曲线、待测样品Ct值,算出该样品的起始拷贝数。各目的基因、管家基因浓度直接由机器读出,每个样品目的基因浓度除以其管家基因浓度,即为此基因校正后的相对含量。
1.6 统计方法
2 结果
2.1 运动、膳食干预后各组大鼠体重、Lees指数、血清瘦素的变化
干预措施后,相对于 H16组,各干预组大鼠体重、Lees指数指标都具显著性差异(P<0.01)。单独膳食、单独运动及两者联合这3种干预措施中,可以看出运动联合膳食干预措施效果较好。HNE组大鼠在这两项指标中都显著性低于 HHE组或 HN组(P<0.05)。HNE组瘦素水平显著性低于 H16组、HHE组及 HN组 (P<0.01)。但各干预组瘦素水平依然显著高于N16组(P<0.05;表1)。
表1 本研究干预措施后各组大鼠体重、Lees指数、血清Leptin变化一览表Table 1 Weight,Lees,Serum Leptin of Each G roup Rats after Interventions(±SD)

表1 本研究干预措施后各组大鼠体重、Lees指数、血清Leptin变化一览表Table 1 Weight,Lees,Serum Leptin of Each G roup Rats after Interventions(±SD)
注:各组与N16组比较(each group compared with N16),## P<0.01,# P<0.05;各干预组与 H16比较(intervention group compared with H16),* *P<0.01,* P<0.05;HHE、HN组与 HNE组比较(HHE,HN compared with HNE),@@P<0.01,@P<0.05;下同。
n 体重(Weight,g) Lees指数(Index) Leptin(ng/ml)HNE 10 539.75±29.65** 312.64±6.84** 2.57±0.60**#HHE 10 560.60±23.50##** 323.28±11.17#**@ 3.49±0.68##*@@HN 10 570.50±26.96##**@@ 321.93±9.72#**@ 3.74±0.77##@@H16 10 670.05±17.19## 336.76±6.71## 4.08±0.70##N16 10 522.37±22.98 312.47±10.13 1.86±0.40
2.2 大鼠下丘脑LP-Rb蛋白水平
8周高脂膳食后,H16组大鼠下丘脑LP-Rb水平显著低于 N16组(P<0.05)。而与 H16组比较,HNE及HHE组较之有显著性提高(图1、表2)。

图1 大鼠下丘脑LP-Rb蛋白水平检测结果示意图Figure 1. LP-Rb Protein Expression in Hypothalamus of Rats
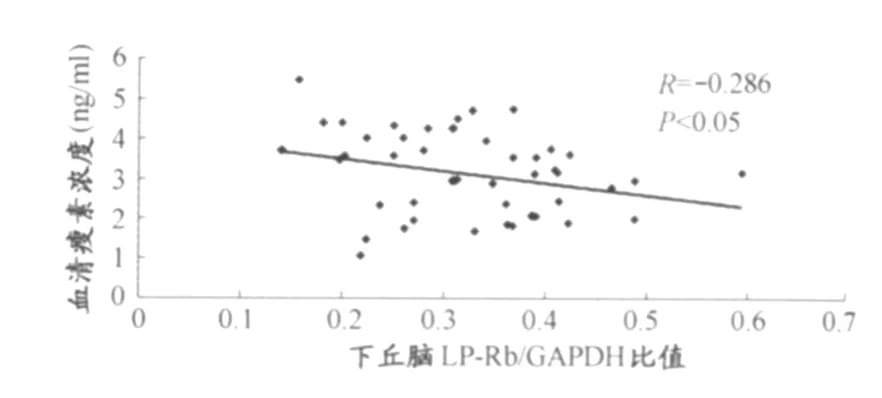
图2 干预措施后大鼠血清瘦素与下丘脑LP-Rb水平相关趋势示意图Figure 2. Correlation between Serum Leption and LP-Rb in Hypothalamus of Rats after Interventions

图3 大鼠下丘脑p-STAT3、STAT3蛋白水平检测示意图Figure 3. p-STAT3,STAT3 Protein Expression in Hypothalamus of Rats
表2 本研究干预措施后各组大鼠下丘脑LP-Rb/GAPDH比较一览表Table 2 LP-Rb/GAPDH in Hypothalamus of Each G roup Rats after Interventions(±SD)
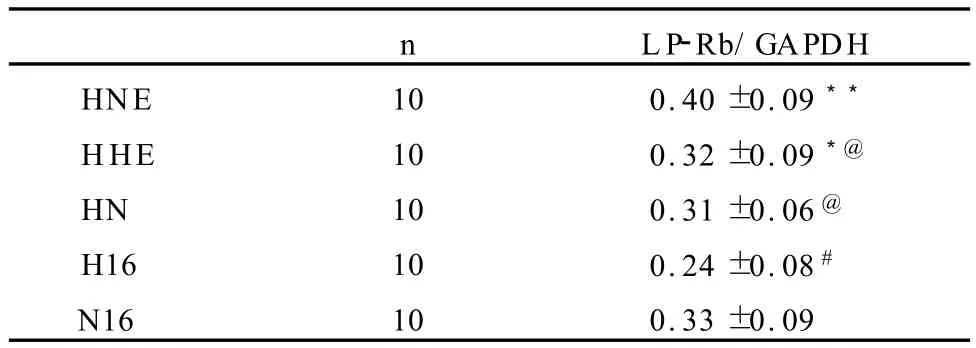
表2 本研究干预措施后各组大鼠下丘脑LP-Rb/GAPDH比较一览表Table 2 LP-Rb/GAPDH in Hypothalamus of Each G roup Rats after Interventions(±SD)
n LP-Rb/GAPDH HNE 10 0.40±0.09**HHE 10 0.32±0.09*@HN 10 0.31±0.06@H16 10 0.24±0.08#N16 10 0.33±0.09
2.3 干预措施后大鼠血清瘦素与下丘脑LP-Rb相关性
如图2所示,8周运动、膳食干预措施后大鼠血清瘦素与下丘脑LP-Rb呈微弱负相关性,R=-0.286(P<0.05)。
2.4 大鼠下丘脑STAT3蛋白及其磷酸化水平检测结果
8周的高脂膳食并未造成H16组与N16组大鼠下丘脑STAT3、p-STAT3及p-STAT3/STAT3的差异 ,而运动、膳食干预则提高了 HNE组与 HHE组的p-STAT3及p-STAT3/STAT3水平,较 H16组有显著性差异(P<0.05;图3、表3)。
表3 本研究干预措施后各组大鼠下丘脑p-STAT3/STAT3水平检测结果一览表Table 3 p-STAT3/STAT3 Protein Expression in Hypothalamus of Each R at after Interventions(±SD)

表3 本研究干预措施后各组大鼠下丘脑p-STAT3/STAT3水平检测结果一览表Table 3 p-STAT3/STAT3 Protein Expression in Hypothalamus of Each R at after Interventions(±SD)
n STAT3/GAPDH p-STAT3/GAPDH p-STAT3/STAT3 HNE 10 0.57±0.05 0.44±0.18** 0.78±0.35*HHE 10 0.54±0.11 0.39±0.17* 0.72±0.28*HN 10 0.53±0.11 0.29±0.09 0.53±0.12 H16 10 0.49±0.09 0.17±0.08 0.36±0.21 N16 10 0.55±0.08 0.32±0.15 0.57±0.22
2.5 大鼠下丘脑总RNA提取完整性检测结果
大鼠下丘脑总RNA提取经琼脂糖凝胶电泳后显示:总RNA提取完整,无污染,无拖尾现象,18 s及 28 s核糖体RNA显示清晰。紫外分光光度计测其230 nm、260 nm和280 nm处的紫外吸光值(A),以 A260/A230、A260/A280用于浓度和纯度分析,所有 RNA样品A260/A230均在 1.8~2.1之间,A260/A280均大于2.0(图4)。

图4 大鼠下丘脑总RNA提取质检电泳图Figure 4. Electropherogram of Total RNA in Hypothalamus of Rats
2.6 大鼠下丘脑SOCS3 mRNA水平的表达
8周干预措施后,各组大鼠下丘脑SOCS3 mRNA表达量无显著性差异(P>0.05;表4)。
表4 干预措施后大鼠下丘脑SOCS3 mRNA表达量比较一览表T able 4 Expression of SOCS3 mRNA in Hypothalamus of Rats after Interventions(±SD)
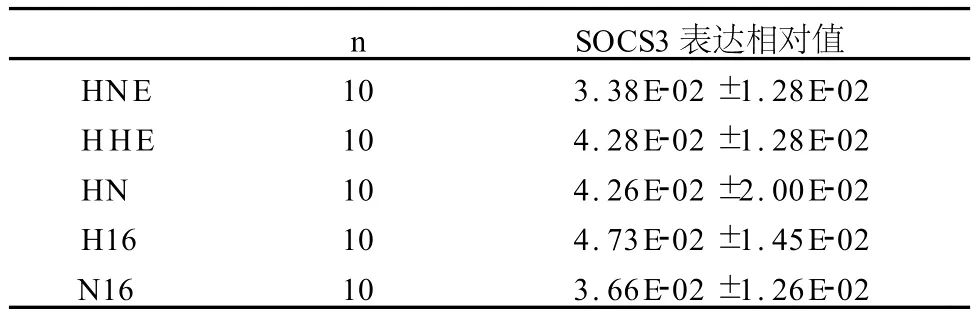
表4 干预措施后大鼠下丘脑SOCS3 mRNA表达量比较一览表T able 4 Expression of SOCS3 mRNA in Hypothalamus of Rats after Interventions(±SD)
n SOCS3表达相对值HNE 10 3.38E-02±1.28E-02 HHE 10 4.28E-02±1.28E-02 HN 10 4.26E-02±2.00E-02 H16 10 4.73E-02±1.45E-02 N16 10 3.66E-02±1.26E-02
2.7 大鼠下丘脑SOCS3蛋白水平
8周的高脂膳食并未造成H16组与N16组大鼠下丘脑SOCS3蛋白水平显著性的差异。而8周的运动联合膳食干预或单独运动干预措施却能明显降低 HNE组及HHE组大鼠下丘脑 SOCS3蛋白水平,且较 H16组有显著性差异 (P<0.05),其中,HNE组显著低于N16组(P<0.05)。而 HHE及 HN组显著性高于 HNE组(P<0.01;图5、表5)。

图5 大鼠下丘脑SOCS3蛋白水平示意图Figure5. SOCS3 Protein Expression in Hypothalamus of Rats
表5 本研究干预措施后大鼠下丘脑SOCS3/GAPDH检测结果一览表Table 5 SOCS3/GAPDH in Hypothalamus of Each G roup Rats after Interventions(±SD)

表5 本研究干预措施后大鼠下丘脑SOCS3/GAPDH检测结果一览表Table 5 SOCS3/GAPDH in Hypothalamus of Each G roup Rats after Interventions(±SD)
n SOCS3/GAPDH HNE 10 0.26±0.06**##HHE 10 0.41±0.14*@@HN 10 0.44±0.11@@H16 10 0.52±0.12 N16 10 0.50±0.12
2.8 大鼠下丘脑SOCS3蛋白水平与血清瘦素浓度相关性
8周干预措施后,大鼠下丘脑 SOCS3蛋白水平与血清瘦素浓度呈低度相关,相关系数 R=0.338(P<0.05;图6)。
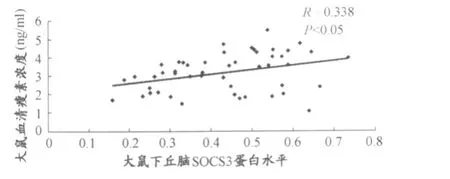
图6 干预措施后大鼠下丘脑SOCS3水平与血清瘦素浓度相关趋势示意图Figure 6. Correlation between Serum Leption and SOCS3 in Hypothalamus of Rats after Interventions
3 讨论与分析
3.1 运动、膳食干预对大鼠血清瘦素及下丘脑LP-Rb蛋白水平的影响及作用机制
瘦素必须与其受体结合后才能激活其受体后信号通路,从而发挥降低食欲、增加能耗、调节体重的作用。在众多的瘦素受体中只有长型受体LP-Rb具有信号传导功能,为功能性受体。下丘脑是LP-Rb重要分布区域,它与瘦素结合后,主要通过JAK2-STAT3信号途径发挥作用。因此,本研究以LP-Rb做为实验指标之一。虽然,外周多种组织都有瘦素受体的表达,但下丘脑被认为是最重要的代谢和能量平衡的调节中枢[3]。大多数肥胖者体内存在高瘦素水平,即瘦素抵抗现象,瘦素抵抗又是肥胖症的一个潜在诱发因素,两者相互作用形成恶性循环,导致体重增加[40]。高瘦素血症、瘦素受体表达下调及受体后缺陷通常被认为是造成瘦素抵抗的众多原因之一。
运动、膳食控制做为肥胖症等代谢性疾病的主要调控手段,可以对机体内分泌功能、能量代谢、基因的表达产生多重影响[14]。而瘦素在中枢的主要生理功能之一是调节食欲、控制能量平衡,因此,本实验有理由假设运动、膳食干预会对瘦素、瘦素受体及受体后通路产生一定的影响。
运动对瘦素的影响受到很多因素控制,如运动方式、运动负荷等。通常认为,一次短时间的运动对瘦素不会产生影响,即便有影响也可能是由于昼夜节律或自身血液浓缩造成的,而单次长时间(>60 min)运动使瘦素水平的下降与机体能量负平衡有关[4]。除2型糖尿病病人外,有研究认为,小于12周的运动对瘦素没有影响,而大于12周的运动对瘦素影响结果并不一致[27]。本实验目的是为了给肥胖人群进行科学减肥提供基础理论依据,因此,运动干预方式采用了中等强度的有氧运动。国内学者对大鼠进行6周有氧跑台运动训练,结果显示,有氧运动可以降低血清瘦素水平,且具有时相性[1]。张缨等在实验中则得出了相反的结论,她发现,6周的自由泳训练可以显著升高大鼠血清瘦素浓度[9]。而Baek在研究膳食干预对瘦素影响的实验中发现,在保证基本热量需要的情况下,4周后实验组进食量降低30%,与实验前比较其血清瘦素水平下降27%,且体重也有降低(P<0.05),对照组瘦素及体重都呈上升水平(P<0.05)[10]。
本研究结果提示,运动联合膳食干预改善高瘦素血症较单独运动或饮食干预效果明显,而血清瘦素对运动干预较膳食干预敏感。至于本实验中单独膳食干预未能显著性降低大鼠血清瘦素水平,而运动干预效果次于联合措施,可能是由于虽然能量消耗是引起瘦素下降的前提条件之一,但瘦素对单纯的能量消耗或热量摄入不敏感,只有其两者之间的平衡才对瘦素有影响[24]。这与 Solomon的研究结果是一致的,他将23名老年肥胖人群分为2组,一组为正常饮食,另一组为能量摄入限制饮食,2组受试者都以75%的最大耗氧量,每次60 min,每周5次,进行为期12周的有氧运动。结果2组受试者血清瘦素水平都有所下降,但运动结合能量摄入限制组更具有显著性[41]。同样,118名具有糖尿病和心血管高危因素的男性在经过一年每周3次的有氧运动和限制饱和脂肪酸及胆固醇的膳食干预后,单纯运动组血清瘦素下降了5%,单纯膳食干预组下降10%,而运动结合膳食干预组下降了24%[37]。运动、膳食干预通常会对肥胖人群体成分、胰岛素水平产生影响,而这两者又是通过“脂肪—胰岛素轴”相互联系的,这可能是导致机体瘦素水平变化的原因。
瘦素必须在中枢或外周与LP-R结合后,通过信号转导调节神经肽 Y(NPY)、阿黑皮素原(POMC)等蛋白基因表达和活性,才能发挥其调节摄食、能量平衡、代谢、生殖等生理作用。将小剂量的瘦素注入第三脑室,可以明显降低大鼠体重,表明瘦素主要通过中枢神经系统(CNS)发挥作用[15]。在CNS中下丘脑是调节机体能量平衡最重要的部位,也是LP-R最主要的分布区域[16]。而LP-Rb是下丘脑中惟一能进行信号转导的功能性受体。
肥胖者大多伴有瘦素抵抗,尽管其形成原因很多,但LP-R及受体后缺陷是其重要的发生机制之一。向膳食诱导的肥胖大鼠中枢注入瘦素,并无任何疗效,证实了这一点[34]。本实验中,经过16周高脂喂养后,H16组大鼠下丘脑中LP-Rb水平显著低于空白对照组(N16),提示,肥胖可以导致下丘脑LP-Rb蛋白水平明显降低,而这必然导致瘦素与其结合的数量减少,最终使瘦素不能实现在中枢的生物学效应,这可能是瘦素抵抗发生的机制之一。
目前,关于运动、膳食干预对LP-R影响的研究比较少,特别是对中枢LP-Rb的研究。仅有少量实验证实耐力训练可以上调饮食性肥胖大鼠脂肪细胞LP-R的基因表达,而其中以运动结合饮食控制效果最为显著[5]。国内学者丛琳等也发现,糖尿病大鼠经过12周中、小强度的运动后,骨骼肌内LP-R的mRNA及蛋白水平都有显著升高[2]。但也有不同的实验结果,运动8周后,无论高脂、高碳水化合物或普通饮食,大鼠肝脏 a、b、e型LP-R基因表达水平都显著下降[48]。本实验中,与高脂对照组(H16)比较,单独的膳食干预虽引起肥胖大鼠下丘脑LP-Rb蛋白含量的上升,但未有显著性差异,单独运动干预引起了LP-Rb含量显著上升(P<0.05),而两者的联合干预使LP-Rb水平上升幅度异常显著(P<0.01),提示,运动结合膳食干预增加LP-Rb的表达可能是改善瘦素抵抗的机制之一。有观点认为,LP-R与机体的BMI呈负相关,且瘦素与其受体的结合率随着体重的下降而上升[46]。前期实验已证实,干预措施后,HNE组较HHE、HN组无论在体重或体脂下降都最为显著。因而可以推测,运动、膳食干预或许通过改变体重及体脂的含量而间接的影响LP-R水平。而刘正娟在其博士论文中认为,高脂诱导的肥胖大鼠体内瘦素与LP-Ra、LP-Rb之间存在负反馈调节,瘦素抵抗机体中的高瘦素可能会抑制其受体的表达[6]。本实验结果中,虽然在干预措施后,与 H16组比较,血清瘦素有下降变化趋势,下丘脑中LPRb则有上升趋势,但大鼠血清瘦素与下丘脑LP-Rb之间只有非常弱的负相关作用。这可能是由于血清瘦素必须要透过血脑屏障才能到达中枢与其受体结合发挥作用,因而可能LP-R与中枢的瘦素水平更为密切。因此,运动、膳食干预对下丘脑LP-Rb影响的具体机制尚需进一步研究。
3.2 运动、膳食干预对大鼠下丘脑STAT3及其磷酸化蛋白水平的影响及作用机制
瘦素与其受体结合后需要完整的信号通路才能发挥其生物效应,已经确认的LP-R信号通路有JAK-STAT通路、分裂素活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷酸肌醇 3激酶(phosphoinositide 3-kinase,PI3-K)通路,而JAK2-STAT3目前被认为是瘦素最主要的信号转导途径[31,45]。
瘦素信号通过LP-Rb进行调节,LP-R属于Ⅰ型细胞因子受体,缺乏自身的酪氨酸激酶的活性。当瘦素与其受体结合后,使JAK2上的酪氨酸激酶激活,这样又导致受体胞内的某些酪氨酸残基磷酸化,从而为STAT3提供了结合位点。被激活的磷酸化STAT3形成二聚体,从核膜转入核内,在核内调节不同基因的转录[21]。在若干STAT蛋白中,瘦素能特异性增加STAT3的磷酸化水平和STAT3的DNA的结合率[31],STAT3信号途径障碍可以导致肥胖的发生。饮食诱导的肥胖大鼠下丘脑中除了发现其LP-R蛋白表达降低,还发现了瘦素信号转导中STAT3表达水平的下降[18]。提示,下丘脑信号通路中STAT3的减弱可能与高脂诱导的肥胖机体发生瘦素抵抗有关。有研究已经发现,高脂饮食诱导的瘦素抵抗大鼠下丘脑弓状核(ARC)内伴随着STAT3磷酸化水平的不足[33]。磷酸化的STAT3相当于LP-Rb的第二信使,在下丘脑中广泛表达[23]。与此相似的结果还有,STAT3神经元敲除的大鼠出现肥胖和瘦素抵抗现象[17]。
本实验结果中,与 N16组比较,H16组大鼠下丘脑中STAT3和p-STAT3水平虽有所下降,但没有显著性差异。提示,高脂诱导肥胖大鼠的瘦素抵抗并不一定存在下丘脑中STAT3蛋白及其磷酸化水平的降低,或者说,LP-Rb-STAT3信号通路并不一定与瘦素生理功能相平行。当然,此结果也有可能与干预周期不够长,不足以引起p-STAT3水平显著性变化有关。8周干预措施后,各组大鼠下丘脑中的STAT3的总蛋白虽没有显著性的差异,而其活性状态的 705位点的 p-STAT3水平,与 H16组比较,HNE、HHE组有显著性的上升,其中,HNE组 P<0.01,HHE组 P<0.05。提示,运动、膳食干预未显著影响LP-R后信号通路中 STAT3蛋白水平,但运动能显著提高其磷酸化水平,其中以运动结合膳食干预影响为最,说明运动结合膳食干预可能对瘦素信号通路JAK2-STAT3存在正性调节作用。这与 Flores的观点相符,他认为运动能增加下丘脑一些蛋白的磷酸化水平[20]。Patterson将高脂膳食诱导的肥胖大鼠分为安静对照组、3周运动后停训10周组及连续13周运动组。在实验开始3周后,以5 mg/kg瘦素对大鼠进行腹腔注射,结果运动组大鼠下丘脑弓状核p-STAT3水平高于对照组23%,同时增加的还有腹内侧核和背内侧核的LP-R。至13周实验结束时,仅 13周运动组 p-STAT3水平高于对照组32%[35]。而在人体实验中,Trenerry在对大强度抗阻训练后老年人肌肉进行活检发现,其骨骼肌内的STAT3水平增加了23倍,而年轻人也增加了5倍,且同时升高的还有 IL-6和 SOCS3 mRNA水平,但 SOCS3胞内蛋白水平是受到抑制的[44]。在仅有少数膳食干预对 STAT3影响的研究中,有实验报道,膳食诱导的肥胖 F344-BN雄性大鼠在给予30天的能量摄入限制后(60%标准啮齿类动物饲料热能),下丘脑中p-STAT3水平增加了85%,而对照组增加了45%,同时增加的还有两组的LP-Rb基因表达和蛋白水平[47]。
目前,关于运动、膳食干预对瘦素抵抗机体下丘脑中STAT3影响机制的研究较少,干预措施后p-STAT3水平上升的原因还不清楚。有可能与瘦素抵抗改善后机体对瘦素敏感性增加及LP-Rb水平上升有关,因为LP-Rb可以通过与JAK2的结合催化STAT3磷酸化表达,JAK2结合到受体与配体形成的二聚体后激活受体,随后使与LP-R结合的STAT3磷酸化。因此,LP-Rb水平的增加必然使其与JAK2结合和自身磷酸化数量上升,从而最终增加p-STAT3水平。本实验结果中,HNE组LP-Rb蛋白含量上升最多,正符合了此观点。
3.3 运动、膳食干预对大鼠下丘脑 SOCS3 mRNA及蛋白水平的影响及其在中枢瘦素抵抗中的作用机制
即使有完整的JAK2-STAT3的信号通路,下丘脑神经元依然可以发生瘦素抵抗,SOCS3和其他一些瘦素信号的负性调节因子可能在中枢瘦素抵抗中起到关键性的作用[38]。
通常认为,瘦素的信号途径JAK2-STAT3是受到SOCS3的负反馈调控的。虽然过度表达的 SOCS3可以在哺乳动物的细胞株内弱化JAK-STAT信号,但瘦素在下丘脑可诱导SOCS3的表达及激活NPY和 POMC神经元内SOCS3,因此,SOCS3增加通常被认为是瘦素抵抗的标志[12]。SOCS3可以通过多种机制弱化LP-R后信号:通过SH2位点SOCS3可以竞争性与磷酸化的LP-Rb结合而抑制STAT3的激活,也可以通过其 N末端激酶抑制区抑制JAK酪氨酸激酶活性,或者通过C端 SOCS盒募集泛素转移酶系统调节LP-Rb与JAK复合物的降解,从而阻信号的转导[13]。
作为瘦素信号通路的一个潜在抑制因子,人们推测SOCS3表达的变化或许是肥胖人群发生瘦素抵抗的机制之一。Howard发现,SOCS3杂合子缺乏的大鼠与其野生型相比,在外源性瘦素作用下,其下丘脑瘦素受体后信号通路显著上升,体重下降,抗饮食诱导肥胖和代谢综合征能力也显著提高[25]。在高脂饮食诱导的瘦素抵抗肥胖大鼠下丘脑弓状核内,人们也发现其SOCS3 mRNA水平较对照组显著上升,而LP-Rb和蛋白酪氨酸磷酸酶(PTP1B)mRNA都未有显著性变化。ARC中增加50%的SOCS3就可以显著降低高脂饮食下大鼠LP-Rb-STAT3的信号通路及增加大鼠体重[33]。国内也有报道,8周高脂饮食喂养后,大鼠下丘脑中 SOCS3 mRNA水平显著上升,并且与升高的血清瘦素呈正相关[8]。而本实验中,经过16周高脂喂养后,大鼠下丘脑无论 SOCS3在mRNA或蛋白水平,H16组与N16组都没有显著性差异,这与 Fam的研究结果一致[19]。提示,高脂膳食导致的瘦素抵抗并不一定必然的伴有中枢 SOCS3 mRNA或蛋白水平的升高。
目前,已经确定的是 SOCS3是瘦素抵抗的一个负性调节因子,但很少有关于运动干预对 SOCS3影响的研究报道,而已有的研究结果中也并无统一的结论。4周的高脂膳食能够导致大鼠出现瘦素抵抗及骨骼肌中的SOCS3 mRNA水平增加,而耐力运动可以通过加强 FFA的氧化改善瘦素抵抗现象,但并不降低 SOCS3的水平[43]。相反的报道有,大鼠经过12周速度渐增的跑台运动诱导IL-6表达增加而使骨骼肌内的 SOCS3水平上升及大鼠后肢经过一天悬垂后,比目鱼肌内的 SOCS3 mRNA水平显著降低[42]。由此可见,不同的运动方式、运动时间及运动量对机体SOCS3水平产生不同的影响效果,且目前大多数研究集中于骨骼肌 SOCS3的变化,而摄食和能量平衡的调节中枢—下丘脑中 SOCS3水平却鲜有报道。关于热能摄入控制对 SOCS3的影响研究也鲜有报道,Peralta提出胰岛素抵抗合并中枢瘦素抵抗老年大鼠下丘脑中升高的SOCS3 mRNA水平,在实施3个月饮食控制后得到了改善[36]。
为了确定膳食及运动干预对中枢 SOCS3有无影响,若有影响SOCS3的变化是在转录还是翻译环节,本实验同时测了SOCS3的 mRNA及蛋白水平。8周干预措施后,各组之间的 SOCS3 mRNA未出现显著性差异,H16组与N16组蛋白水平也无差异,HNE、HHE组 SOCS3 mRNA虽无变化,但蛋白水平较 H16组显著性下降。调控基因表达的层次很多,转录或翻译只是其中的一个环节。虽然在一定程度上mRNA水平与其蛋白水平有着必然的联系,但是两者的检测水平不能混为一谈,特定基因的mRNA丰度不是必然与其翻译产物——蛋白的水平呈线性关系。国外有学者通过对密码子的进一步研究,提出单纯从mRNA水平推测蛋白的表达是不够的,蛋白的表达比mRNA水平更有价值[22]。HNE、HHE组大鼠mRNA和蛋白水平变化的不同步性,正体现了转录和翻译过程不是必然的线性关系。此外,蛋白质水平的降低也可能与干预措施导致其降解过多有关。
HNE、HHE组大鼠 SOCS3蛋白水平在干预措施后较 H16组显著性下降,提示,单独运动或运动与膳食的联合干预措施能显著降低大鼠SOCS3水平,而SOCS3对运动的调控相对于膳食更为敏感。SOCS3是瘦素抵抗的负性调节因子,它可由瘦素特异性诱导表达,又通过抑制STAT3的磷酸化水平负反馈调节瘦素受体后信号通路。本实验中,大鼠下丘脑SOCS3蛋白水平与血清瘦素呈低度相关,提示,血清瘦素含量可能是导致 SOCS3变化的因素之一。根据前期研究结果,作者推测,干预措施造成SOCS3改变的机制,可能是由于运动、膳食控制后影响大鼠体重、体脂的变化,从而导致脂源性激素瘦素发生量变,进而使中枢SOCS3水平发生相应的改变。
JAK2-STAT3是瘦素在中枢的最主要信号通路,当配体结合到LP-Rb后,导致了JAK2的激活和LP-Rb的Tyr985和 Tyr1138磷酸化。磷酸化的 Tyr985与酪氨酸磷酸化酶(SHP-2)结合能够调节上游的细胞外信号调节激酶(EPK)活性、c-fos转录及抑制 STAT3活性。而1 138位的酪氨酸磷酸化募集了包含SH2结构域的转录因子STAT3,使其磷酸化及核转移。STAT3进入核内后即启动基因的转录,其中也包括瘦素信号的负反馈调节因子SOCS3,因此,p-STAT3被认为是中枢瘦素信号转导的特征性参数之一[49]。目前研究认为,SOCS3可以利用其SH2结构域与 STAT相似,竞争性结合LP-Rb的 Tyr985结合位点,阻止 STAT3的活化,抑制瘦素受体后信号转导[26]。此外,SOCS3还可以直接与JAK2结合抑制其酪氨酸激酶活性,进而抑制瘦素受体后JAK-STAT信号通路[12],提示,SOCS3可能通过JAK2-STAT3通路阻断瘦素受体后信号通路。
中枢瘦素抵抗发生过程中,除了JAK2-STAT3通路、SOCS3外还有很多其他参与的信号通路及负性调节因子。瘦素信号的 PI3 K-PDE3B-cAMP通路在瘦素抵抗中起着重要作用,有实验证实了在饮食诱导的肥胖 FVB/N小鼠中,是下丘脑中 PI3 K通路缺陷而非JAK-STAT通路导致了其中枢瘦素抵抗[32]。蛋白酪氨酸磷酸酶 1B(PTP1B)是LP-R信号的另外一个负性调节因子,在下丘脑LP-Rb表达的地方同样有表达[50]。PTP1B敲除大鼠对饮食诱导的肥胖有抵抗作用,且对瘦素高度敏感,提示,其在下丘脑瘦素信号中有着显著作用[28]。因此,可能PTP1B与SOCS3之间的平衡和相互作用对正常的瘦素信号起着关键性的作用,同样也决定着中枢瘦素抵抗的发生。所以,若有条件可以选用 PTP1B敲除及SOCS3阻滞剂进行进一步的研究,将有利于瘦素抵抗的机制的探明。
因此,高脂饮食引起的肥胖与瘦素抵抗可能是包括SOCS3在内的多个抑制因子共同作用,多个环节相互关联的结果。要彻底了解运动、膳食干预改善瘦素抵抗和肥胖的生物学基础,还需更多深入、复杂的研究工作。
4 结论
1.高脂膳食可以导致大鼠血清瘦素上升,下丘脑中LP-Rb蛋白水平下降,这可能是瘦素抵抗发生的机制之一。
2.运动联合膳食干预较单独的运动或膳食干预可以明显改善大鼠中枢瘦素抵抗,其机制可能与下列因素有关:1)降低血清瘦素水平,上调下丘脑中LP-Rb受体蛋白水平;2)增加下丘脑中JAK2-STAT3通路中 STAT3磷酸化水平;3)降低下丘脑中SOCS3蛋白水平。
3.高脂膳食导致的瘦素抵抗并不必然伴有下丘脑中SOCS3 mRNA和蛋白水平的升高,但运动及运动联合膳食干预却可以通过下调SOCS3蛋白水平改善瘦素抵抗,在预防和治疗肥胖症中可能起到一定的作用。
[1]柏建清.有氧运动对大鼠血清瘦素水平(Leptin)的影响[J].天津体育学院学报,2008,23(1):74-76.
[2]丛琳,陈吉棣.运动对糖尿病大鼠瘦素受体基因水平与功能的影响[J].体育科学,2001,21(4):54-57.
[3]葛可佑,中国营养科学全书(第一版)[M].北京:人民卫生出版社,2004.
[4]黄彩华,刘礼斌,高松龄,等.瘦素与运动[J].体育科学,2005,25(3):65-69.
[5]李琳燕,衣雪洁.运动对饮食性肥胖大鼠脂肪细胞瘦素受体基因表达的影响[J].山东体育学院学报,2008,24(4):64-67.
[6]刘正娟.瘦素对瘦素长、短型受体mRNA表达调节作用的研究[D].中国医科大学博士学位论文,2005:11-23.
[7]孙志,张中成,刘志诚.营养性肥胖动物模型的实验研究[J].中国药理学通报,2002,18(4):466-467.
[8]张旭.高脂肥胖大鼠下丘脑内OB-Rb、SOCS3mRNA表达的研究[D].大连医科大学硕士学位论文,2007:8-20.
[9]张缨,冯美云,吴昊,等.有氧运动训练对大鼠下丘脑食欲调节肤的影响[J].中国运动医学杂志,2002,21(1):19-22.
[10]BAEK K,BARLOW A A,ALLEN M R,et al.Food restriction and simulated microgravity:effects on bone and serum leptin[J].J Appl Physiol,2008,104(4):1086-1093.
[11]BEDFORD T G,CHARLES M,TIPTON N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedure[J].J Appl Physiol,1979,46(6):1278-1283.
[12]BJORBAEK C,EL-HASCHIMI K,FRANTZ J D,et al.The role of SOCS3 in leptin signaling and leptin resistance[J].J Biol Chem,1999,274:30059-30065.
[13]BJORBAK C,LAVERY H J,BATES S H,et al.SOCS3 mediates feedback inhibition of the leptin receptor via Tyr985[J].J Biol Chem,2000,275(51):40649-40657.
[14]CHIBALIN A V,YU M,RYDER J W,et al.Exercise-induced changes in expression and activity of proteins involved in insulin signal transduction in skeletal muscle:differential effects on insulin-receptor substrates 1 and 2[J].Proc Natl Acad Sci USA,2000,97(1):38-43.
[15]CAMPFIELD L A,SMITH F I,GUISEZ Y,et al.Recombinant mouse OB protein:Evidence for a peripheral signal linking adiposity and central neural networks[J].Sci,1995,269:546-549.
[16]COTTRELL E C,CRIPPS R L,DUNCAN J S,et al.Developmental changes in hypothalamic leptin receptor:relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat[J].Am J Physiol Regul Integr Comp Physiol,2009,296(3):R631-639.
[17]CUI Y,HUANG L,ELEFTERIOU F,et al.Essential role of STAT3 in body weight and glucose homeostasis[J].Mol Cell Biol,2004,24(1):258-269.
[18]EL-HASCHIMI K,PIERROZ D D,HILEMAN S M,et al.Two defects contribute to hypothalamic leptin ressistance in mice with diet-induced obesity[J].J Clin Invest,2000,105(12):1827-1832.
[19]FAM B C,MORRIS M J,HANSEN M J,et al.Modulation of central leptin sensitivity and energy balance in a rat model of diet-induced obesity[J].Diabetes Obes Metab,2007,9(6):840-852.
[20]FLORES M B,FERNANDES M F,ROPELLE E R,et al.Exercise improves insulin and leptin sensitivity in hypothalamus of Wistar rats[J].Diabetes,2006,55(9):2554-2561.
[21]GUO Z,JIANG H,XU X,et al.Leptin-mediated cell survival signaling in hippocampal neurons mediated by JAK STAT3 and mitochondrial stabilization[J].J Biol Chem,2008,283(3):1754-1763.
[22]GYGI S P,ROEHON Y,FRANZA B R,et al.Correlation between Protein and mRNA Abundance in Yeast[J].Mol Cell Biol,1999,19(3):1720-1730.
[23]HAKANSSON M L,MEISTER B.Transcription factor STAT3 in leptin target neurons of the rat hypothalamus[J].Neuroendocrinology,1998,68(6):420-427.
[24]HICKEY M S,CALSBEEK D J.Plasma leptin and exercise:recent findings[J].Sports Med,200,31(8):583-589.
[25]HOWARD J K,CAVE B J,OKSANEN L J,et al.Enhanced leptin sensitivity and attenuation of diet-induced obesity in mice with haploinsufficiency of Socs3[J].Nat Med,2004,10(7):734-738.
[26]HOWARD J K,FLIER J S.Attenuation of leptin and insulin signaling by SOCS proteins[J].Trends Endocrinol Metab,2006,17(9):365-371.
[27]KRAEMER R R,CHU H,CASTRACANE V D.Leptin and Exercise[J].Experimental Biology Med,2002,227(9):701-708.
[28]KLAMAN L D,BOSS O,PERONI O D,et al.Increased energy expenditure,decreased adiposity,and tissue-specific insulin sensitivity in protein-tyrosine phosphatase 1B-deficient mice[J].Mol Cell Biol,2000,20:5479-5489.
[29]LAUTERIO T J,BOND J P,ULMANl E A.Development and characrization of a purified diet to identify obesity-susceptible and resistant rat[J].J Nutr,1994,124(11):2172-2178.
[30]LUBIS A R,WIDIA F,SOEGONDO S.The role of SOCS3 protein in leptin resistance and obesity[J].Acta Med Indones.2008,40(2):89-95.
[31]MEISTER B.Control of food intake via leptin receptors in the hypothalamus[J].Vitam Horm,2000,59:265-304.
[32]METLAKUNTA A S,SAHU M,SAHU A.Hypothalamic phosphatidylinositol 3-kinase pathway of leptin signaling is impaired during the development of diet-induced obesity in FVB/N mice[J].Endocrinology,2008,149(3):1121-1128.
[33]MUNZBERG H,FLIER J S,BJORBAEK C.Region-specific leptin resistance within the hypothalamus of diet-induced obese mice[J].Endocrinology,2004,145(11):4880-4889.
[34]PAL R,SAHU A.Leptin signaling in the hypothalamus during chronic central leptin infusion[J].Endocrinology,2003,244(9):789-798.
[35]PATTERSON C M,BOURET S G,DUNN-MEYNELL A A,et al.Three weeks of postweaning exercise in DIO rats produces prolonged increases in central leptin sensitivity and signaling[J].Am J Physiol Regul Integr Comp Physiol,2009,296(3):R537-548.
[36]PERAL TA S,CARRASCOSA J M,GALLARDO N,et al.Ageing increases SOCS3 expression in rathypothalamus:effects of food restriction[J].Biochem Biophys Res Commun,2002,296(2):425-428.
[37]ROKLING-ANDERSEN M H,RESELAND J E,VEIEROD M B,et al.Effects of long-term exercise and diet intervention on plasma adipokine concentrations[J].Am J Clin Nutr,2007,86(5):1293-1301.
[38]SAHU A.Minireview:A hypothalamic role in energy balance with special emphasis on leptin[J].Endocrinology,2004,145(6):2613-2620.
[39]SCARPACE PJ,TUMER N.Peripheral and hypothalamic leptin resistance with age-related obesity[J].Physiol Behav,2001,74(4-5):721-727.
[40]SCARPACE P J,ZHANG Y.Leptin resistance:a prediposing factor for diet-induced obesity[J].Am J Physiol Regul Integr Comp Physiol,2009,296(3):R493-500.
[41]SOLOMON T P,SISTRUN S N,KRISHNAN R K,et al.Exercise and diet enhance fat oxidation and reduce insulin resistance in older obese adults[J].J Appl Physiol,2008,104(5):1313-1319.
[42]SPANGENBURG E E,BROWN D A,JOHNSON M S,et al.Exercise increases SOCS3 expression in rat skeletal muscle:potential relationship to IL-6 expression[J].J Physiol,2006,572(Pt 3):839-848.
[43]STEINBERG G R,SMITH A C,WORMALD S,et al.Endurance training partially reverses dietary-induced leptin resistance in rodent skeletal muscle[J].Am J Physiol Endocrinol Metab,2004,286(1):E57-63.
[44]TRENERRY M K,CAREY K A,WARD A C,et al.Exerciseinduced activation of STAT3 signaling is increased with age[J].Rejuvenation Res,2008,1(4):717-724.
[45]UDAGAWA J,HATTA T,NAORA H,et al.Expression of the long form of leptin receptor(Ob-Rb)mRNA in the brain of mouse embryos and newborn mice[J].Brain Res,2000,868(2):251-258.
[46]VAN DIELEN F M,VAN’T VEER C,BUURMAN W A,et al.Leptin and soluble leptin receptor levels in obese and weightlosing individuals[J].Clin Endocrinol Metab,2002,8(4):1708-1716.
[47]WILSEY J,SCARPACE P J.Caloric restriction reverses the deficits in leptin receptor protein and leptin signaling capacity associated with diet-induced obesity:role of leptin in the regulation of hypothalamic long-form leptin receptor expression[J].J Endocrinol,2004,181(2):297-306.
[48]YASARI S,WANG D,PRUD’HOMME D,et al.Exercise training decreases plasma leptin levels and the expression of hepatic leptin receptor-a,-b,and,-e in rats[J].Mol Cell Biochem,2009,324(1-2):13-20.
[49]ZHANG Y,SCARPACE P J.Circumventing central leptin resistance:lessons from central leptin and POMC gene delivery[J].Peptides,2006,27(2):350-364.
[50]ZABOLOTNY J M,BENCE-HANULEC K K,STRICKERKRONGRAD A,et al.PTP1B regulates leptin signal transduction in vivo[J].Dev Cell,2002,2:489-495.
Mechanism of Exercise and Diet Interventions on Central Posterior Receptor Signaling of Leptin Resistance Rats
TAN Yan1,CHEN Wen-he2,GUO Li2,SUN Qing-yan3
目的:观察运动、膳食干预对具有瘦素抵抗现象肥胖大鼠中枢受体后信号通路的影响,探讨SOCS3在瘦素抵抗发生及改善过程中的作用。方法:雄性SD大鼠130只,随机分为对照组10只,建模组120只,分别给予普通标准啮齿类动物饲料和高脂饲料喂养8周。筛选出建模组体重排序前1/3大鼠,测量其血清瘦素水平,随机分为高脂膳食对照组(H16)、高脂膳食运动组(HHE)、普通膳食运动组(HNE)、普通膳食组(HN),原有的空白对照组为N16组,各组大鼠分别给予中等强度的跑台运动干预或膳食干预8周。采用 ELISA法测量血清瘦素水平;Western blot法检测下丘脑中LP-Rb、STAT 3、p-STAT 3及SOCS3蛋白水平;实时荧光定量PCR法测定下丘脑 SOCS3 mRNA水平。结果:1)HNE、HHE组血清瘦素水平显著性低于 H16组(P<0.05),且 HNE组显著性低于 HHE及 HN组 (P<0.01);2)H16组下丘脑LP-Rb水平显著低于N16组(P<0.05),HNE及 HHE组较 H16组有显著性提高;血清瘦素与下丘脑LP-Rb呈微弱负相关性,R值为-0.286(P<0.05);3)运动、膳食干预提高了 HNE组与 HHE组的p-STAT 3/STAT 3水平,较 H16组有显著性差异(P<0.05);4)各组大鼠下丘脑SOCS3 mRNA表达量无显著性差异(P>0.05);HNE组、HHE组SOCS3蛋白水平显著低于 H16组(P<0.05);HNE组显著低于 N16组(P<0.05),而HHE及 HN组显著高于 HNE组(P<0.01);大鼠下丘脑 SOCS3蛋白水平与血清瘦素浓度呈低度相关,相关系数 R值为0.338(P<0.05)。结论:运动联合膳食干预较单独运动或膳食干预可以明显改善中枢瘦素抵抗,其机制可能与降低血清瘦素水平,上调下丘脑中LP-Rb受体蛋白水平;增加下丘脑中JAK2-STAT 3通路中 STAT 3磷酸化水平;降低下丘脑中SOCS3蛋白水平有关。
运动;膳食;干预;瘦素抵抗;细胞因子信号转导抑制蛋白3;鼠;动物实验
Objective:To observe the effect of exercise and diet interventions on central posterior receptor signaling of leptin resistance obese rats in order to study the effect of SOCS3 on leptin resistance.Method:Totally 130 SD male rats were randomly divided into control group(n=10)and model group(n=120).Two groups were fed with common rodent animal feed and high fat diet respectively.After 8 weeks,we selected 1/3 body weight rats ahead in model group,then measure the serum leptin.The model group rats(n=40)were randomized into four groups:high fat diet group(H16),high fat diet and exercise group(HHE),common diet and exercise group(HNE),common diet group(HN).The control group was recorded as N16.Each group rats were given meal intervention or had medium intensity treadmill exercise for 8 weeks.The serum leptin was measured by ELISA.SOCS3,in hypothalamus was observed by Western blot.SOCS3 mRNA in hypothalamus was showed by real time fluorescent quantitation PCR.Result:1)Leptin of HNE,HHE groups were lower than that of H16(P<0.05),and leptin of HNE group was significantly lower than those of HHE,HN groups(P<0.01).2)LP-Rb in hypothalamus of H16 group was lower than that of N16 group(P<0.05);those of HNE,HHE group significantly elevated compared with H16 group(P<0.05);those of HHE,HN groups were lower than that of HNE group(P<0.05).LP-Rb in hypothalamus had weaker negative correlation with leptin,r=-0.286,(P<0.05).3)p-STAT3/STAT3 of HNE,HHE groups elevated because of exercise and diet interventions,compared with H16 group(P<0.05).4)SOCS3 mRNA of each group had no difference(P>0.05).SOCS3 of HNE,HHE group was significantly lower than that of H16(P<0.05),SOCS3 of HNE was lower than that of N16 group(P<0.05).SOCS3 of HHE,HN group was significantly high-er than that of HNE(P<0.01).SOCS3 in hypothalamus had low correlation with serum leptin,R=0.338,(P<0.05).Conclusions:Exercise combination with diet invention was better than exercise or diet to improve central leptin resistance,which mechanisms were possible related to following factors:Leptin lowering,LP-Rb in hypothalamus rising.P-STAT in hypothalamus rising.SOCS3 in hypothalamus lowered.
exercise;diet;intervention;Leptin resistance;SOCS3;rat;animal ex periment
G804.2
A
1000-677X(2011)04-0057-10
2010-12-03;
2011-03-13
上海市第三期运动人体科学重点学科开放基金课题(S30902)。
谈艳(1974-),女,安徽蚌埠人,讲师,博士,研究方向为运动生理学,Tel:(025)85866343,E-mail:xitanyan@hotmail.com;陈文鹤(1947-),男 ,上海人 ,教授 ,博士研究生导师,研究方向为运动生理学,Tel:(021)51253250,E-mail:wenhechen@126.com。
1.Sports Information Institute,Physical Education Department,Nangjing University of Posts and Telecommunications,Nangjing 210046,China;2.School of Kinesiology,Shanghai University of Sport,Shanghai 200438,China;3.College of Life Sciences,Anhui Normal University,Wuhu 241000,China.

