人溶菌酶基因在毕赤酵母中的表达及其抗菌活性检测
夏 清 风, 侯 英 敏, 曹 芳, 金 朝 霞
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
人溶菌酶(Human Lysozyme, HLY)又称胞壁质酶,能水解细菌细胞壁中黏多糖的β(1→4)糖苷键,它是由130个氨基酸组成的碱性多肽,分子质量为14.7 ku[1]。人溶菌酶参与机体的防御机制,有消炎、抗感染、抗肿瘤和免疫调节的作用,因而在医药和食品领域被广泛应用[2-4]。与其他来源的溶菌酶相比,人溶菌酶具有许多独特的优越性,如活性是蛋清溶菌酶的3倍,且不易产生副作用和耐药性[5]。但通常天然人溶菌酶是从人奶或胎盘中少量提取,制备材料相当有限,来源极其困难,远远不能满足市场的需要,所以开发重组人溶菌酶具有十分光明的市场前景。
毕赤酵母(P.pastoris)是一种高效的真核表达系统,该系统表达外源蛋白具有基因操作简单、外源蛋白能正确加工与修饰、表达量高、易大量发酵培养、易纯化等优点[6],这使得毕赤酵母成为目前应用较广的分泌型真核表达系统,已有许多成功高效表达外源蛋白的报道[7-8]。毕赤酵母不仅克服了原核表达系统产物不易分离纯化和不能保持重组蛋白活性等缺点,还具有其他酵母表达系统无法比拟的优点[9]。作者亚克隆了人溶菌酶基因,利用pPIC9K穿梭质粒,实现了人溶菌酶毕赤酵母高效表达。
1 实 验
1.1 原 料
人胎盘,大连市妇产医院;酵母表达质粒pPIC9K,大连工业大学;毕赤酵母(Pichiapastoris)菌株GS115,Invitrogen公司;大肠杆菌DH5α、pGH质粒、溶壁微球菌、枯草杆菌和金黄色葡萄球菌,实验室保存;TRNzol总RNA提取试剂、质粒提取试剂盒和DNA回收试剂盒等,Tiangen公司;常用限制性内切酶和连接酶,宝生物公司;G418、酵母氮源(YNB),上海生工公司;人溶菌酶标品,北京鼎国生物公司;酵母培养分别采用完全培养基(YPD)、选择培养基(MD)、诱导培养基(BMGY)和甲醇诱导培养基(BMMY)。
1.2 引物的设计与合成
根据GenBank上已发表的人溶菌酶基因序列(AK311779)设计能特异性扩增人溶菌酶编码基因的引物序列。考虑到pPIC9K载体上已有α-factor的信号肽,故去掉人溶菌酶基因的18个氨基酸的自身信号肽序列,扩增成熟蛋白编码序列。为了便于将基因直接构建在毕赤酵母表达载体 pPIC9K上,分别在上下游引物中引入EcoRⅠ和NotⅠ酶切位点。引物序列:
P1:5′-CGGAATTCATGAAGGTCTTTGAAAGGTGT- 3′,
P2:5′-TTGCGGCCGCTTACACTCCACAACCTTGAAC- 3′。
1.3 人胎盘组织总RNA的提取及cDNA模板的建立
取新鲜的人胎盘100 mg用无菌剪刀迅速处理成黄豆大小的块,迅速冷冻在液氮中以防止RNA降解,按照TRNzol试剂盒说明书冷冻研磨并提取人胎盘组织总RNA。 以人的总RNA为模板,利用TIANScript cDNA第1链合成试剂盒合成人胎盘组织cDNA第1条链。
1.4 人溶菌酶基因的PCR扩增与克隆
以反转录的cDNA为模板,P1和P2为引物进行PCR反应。反应体系:10×PCR buffer 5 μL,MgCl23 μL,dNTP 4 μL,引物各1 μL,cDNA模板2 μL,TaqDNA聚合酶 0.5 μL,补水至总体积50 μL。反应条件:94 ℃预变性5 min,然后进行(94 ℃ 30 s,54 ℃ 45 s,72 ℃ 30 s)30个循环,72 ℃延伸10 min。PCR产物用1.2%琼脂糖凝胶电泳检测后回收并纯化。将回收后的DNA片段与pGH载体连接,转化E.coliDH5α,蓝白斑筛选阳性克隆,提取质粒后HindⅢ酶切鉴定重组质粒pGH-HLY,阳性克隆质粒由上海捷瑞生物公司进行序列测定。
1.5 真核表达载体的构建和鉴定
用EcoR Ⅰ和NotⅠ分别对pGH-HLY重组质粒和pPIC9K质粒进行双酶切,纯化后将人溶菌酶基因与pPIC9K载体片段经T4DNA连接酶于16 ℃连接,获得真核重组表达载体pPIC9K-HLY;连接产物转化DH5α感受态细胞,挑选单个阳性克隆菌落,提取重组表达质粒进行双酶切鉴定。
1.6 重组质粒对毕赤酵母GS115 的转化
将重组质粒pPIC9K-HLY用SalⅠ酶线性化后,通过电转化酵母菌株GS115,同时转化空载的pPIC9K作为阴性对照。将转化的酵母经过MD 培养基(酵母氮碱YNB 13.4 g/L,生物素0.4 mg/L,葡萄糖20 g/L,琼脂15 g/L)平板筛选出His+表型菌落,28 ℃恒温培养2~4 d,然后接种到含G418质量浓度梯度为0.5~4.0 g/L的YPD平板上,逐级筛选目的基因高拷贝重组菌株,最后选取长势最好的菌落进行转化子验证。
1.7 重组酵母菌株的诱导表达
将高拷贝重组酵母菌株接种到BMGY培养基(酵母提取物10 g/L,胰蛋白胨20 g/L,YNB 13.4 g/L,生物素0.4 mg/L,pH 6.0磷酸缓冲液100 mmol,甘油1%)中,在30 ℃,220 r/min 的条件下培养OD600至2~6后,离心收集菌体,用等体积的BMMY(0.5%甲醇代替BMGY中的甘油)培养基重悬菌体,30 ℃诱导培养。诱导培养3 d后收集表达上清液,用75%饱和硫酸铵沉淀,透析浓缩,用SDS-PAGE检测蛋白表达产物,并利用Bradford法测定蛋白含量。
1.8 重组人溶菌酶蛋白抗菌活性检测
采用平板扩散法鉴定人溶菌酶的生物活性。将对数期的溶壁微球菌液稀释到OD600约0.4,均匀涂布于培养基上,再在培养基上打孔(d=3 mm),取20 μL上清加入小孔内,37 ℃恒温培养24 h测量抑菌圈直径。采用相同方法检测金黄色葡萄球菌、大肠杆菌和枯草杆菌的抑菌活性。
2 结果与讨论
2.1 人溶菌酶基因cDNA的PCR扩增
通过RT-PCR反应,扩增出大小约414 bp的人溶菌酶基因片段,与预期结果一致,电泳结果见图1。用UNIQ-10柱式DNA胶回收试剂盒回收并纯化PCR产物,用于下一步的连接反应。
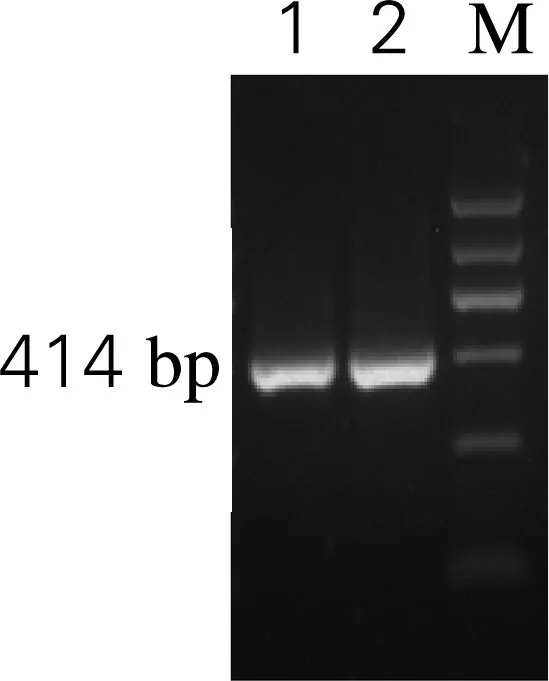
M,DL 2000 DNA 标准;1、2,PCR产物
2.2 HindⅢ酶切鉴定
将含有成熟酶编码基因序列的PCR产物与pGH载体连接过夜后转化大肠杆菌DH5α,因为pGH载体的多克隆位点上有2个HindⅢ酶切位点,分别位于人溶菌酶基因片段两侧672 bp和1 118 bp处,故用HindⅢ单酶切阳性质粒后,可得到长度约2.89 kb和446 bp的2条带。酶切结果见图2,与预期一致。

M,DNA 标准Ⅲ;1,pGH-HLY/HindⅢ
2.3 人溶菌酶基因序列测定与分析
对经酶切鉴定的重组质粒克隆进行测序。基因测序结果用BLAST程序比较,该序列与GenBank上登录号AK3117792的人溶菌酶编码基因序列完全相同(去除了信号肽序列)。序列分析表明:该基因长度为414 bp,包含编码130个氨基酸残基的人溶菌酶成熟肽的完整序列,ATG、TAA以及引入的保护性碱基和酶切位点24 bp。
2.4 重组表达载体pPIC9K-HLY的构建与鉴定
将HLY编码基因定向克隆至毕赤酵母表达载体pPIC9k的EcoRⅠ和NotⅠ位点,重组质粒经双酶切验证,酶切片断与目的基因大小相一致。该结果表明人溶菌酶基因已经成功插入pPIC9K载体,重组质粒结构和酶切鉴定结果分别见图3、4。DNA测序结果显示其基因序列与读码框架均正确。
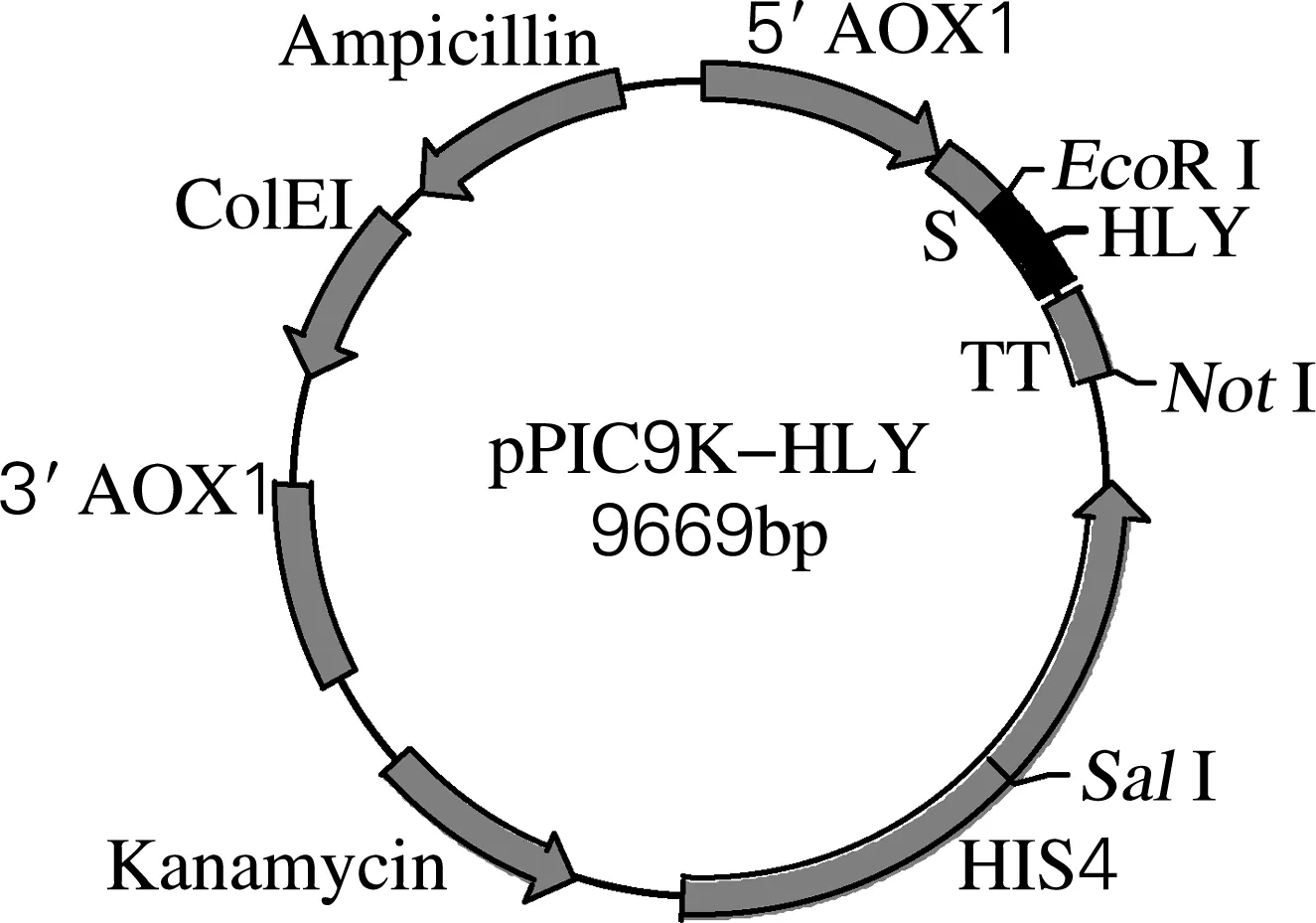
图3 重组表达载体pPIC9K-HLY的结构

M,DL10000 标准;1,pPIC9K-HLY/EcoRⅠ+NotⅠ
2.5 重组酵母菌株的构建与鉴定
pPIC9K-HLY用SalⅠ酶切线性化的载体转化在MD平板上可长出158个His+转化子,进一步通过G418筛选获得高拷贝克隆。用PCR方法鉴定重组菌株,即提取重组菌株的染色体DNA为模板,以P1、P2为引物进行PCR扩增。挑取的4 个菌落均扩增出预期大小的目标条带,而对照则无(图5),表明人溶菌酶基因已经成功转入并整合到酵母基因组上。

1~4,人溶菌酶基因的酵母转化子;5,pPIC9K空载转化的酵母
2.6 表达产物的SDS-PAGE检测
选取阳性GS115/pPIC9K-HLY重组菌株,收集发酵上清液经沉淀浓缩后进行12%的SDS-PAGE电泳分析,同时用pPIC9K/Yeast空载转化子表达产物作对照。结果显示:与对照相比,发酵培养上清液中检测到分泌表达的15 ku的外源蛋白,分子质量与国外报道以及氨基酸序列推导的大小一致,表达产物占上清中总蛋白的32%。在诱导表达48 h开始分泌表达,72 h表达量达最高(图6)。

1,诱导48 h;2,阴性对照;3,诱导72 h;4、5,浓缩样
2.7 重组人溶菌酶蛋白抑菌活性检测
对4种菌的抑菌活性检测实验如图7所示,溶菌圈的直径为0.4~1.4 cm,表明重组人溶菌酶蛋白对溶壁微球菌、大肠杆菌、金黄色葡萄球菌和枯草杆菌均有不同程度的抑菌作用。
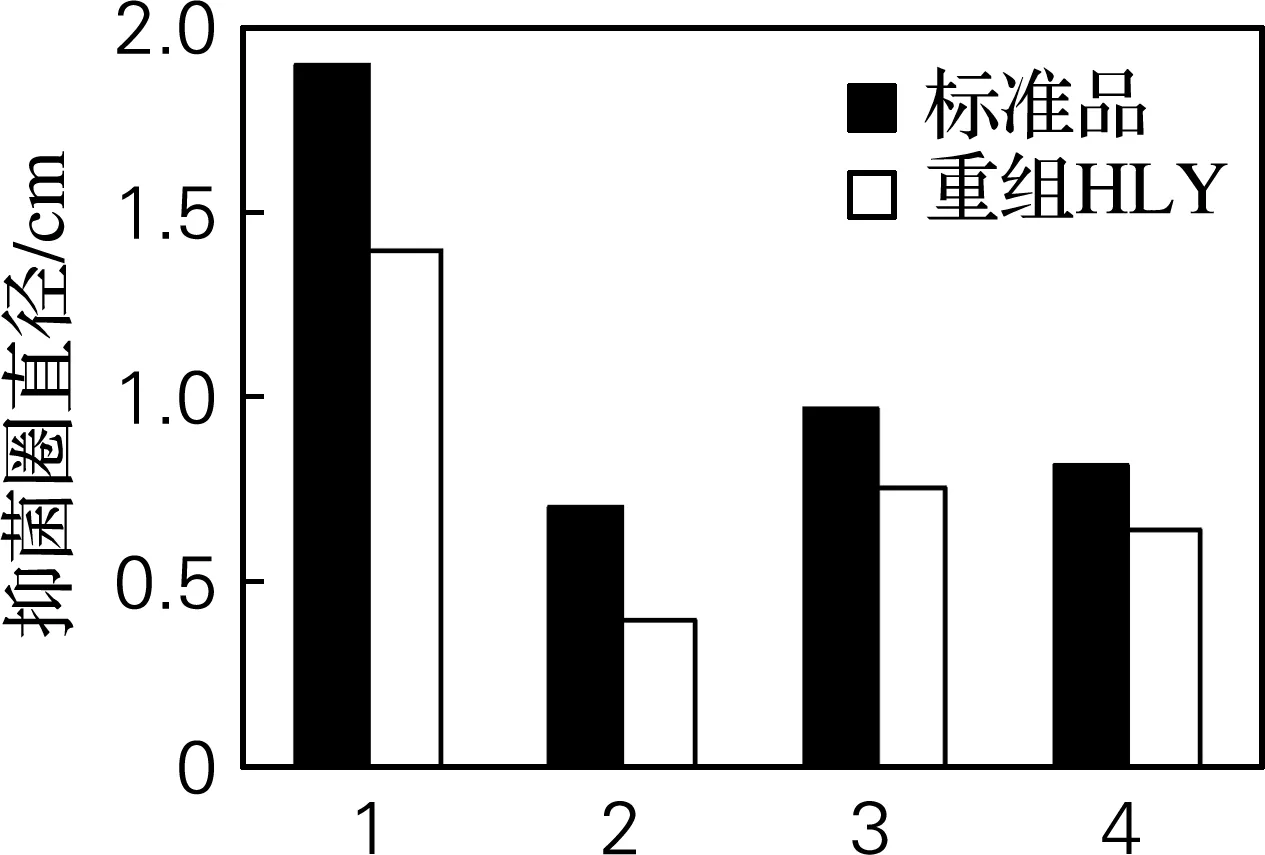
1,溶壁微球菌;2,大肠杆菌;3,金黄色葡萄球菌;4,枯草杆菌
3 结 论
实验以人溶菌酶基因为研究对象,利用RT-PCR技术成功扩增了去除人溶菌酶内含子及其信号肽序列的编码人溶菌酶基因片段,包含编码130个氨基酸残基的人溶菌酶成熟肽的完整序列,将其与酵母分泌型表达载体pPIC9K连接后,成功获得了稳定表达目的蛋白的重组菌株,研究结果为实现人溶菌酶大规模工业化生产奠定了理论基础。
[1] OZOREN N, KIM K, BURNS T F, et al. The caspase 9 inhibitor z-LEHD-FMK protects human liver cells while permitting death of cancer cells exposed to tumor necrosis factor-related apoptosis-inducing ligand [J].Cancer Research, 2000, 22:6259-6265.
[2] NAIDU A S. Natural Food Antimicrobial Systems[M]. Boca Raton:CRC press, 2000:185-210.
[3] LONNERDAL B. Review:Expression of human milk proteins in plants [J]. Journal of the American College of Nutrition, 2002, 21:218-221.
[4] LOPEZ-PEDEMONTE T J, ROIG-SAGUES A X, TRUJILLO A J, et al. Inactivation of spores of Bacillus cereus in cheese by high hydrostatic pressure with the addition of nisin or lysozyme[J]. Journal of Dairy Science, 2003, 86:3075-3081.
[5] 何晓宁,彭树英,杨瑞锋,等.人溶菌酶基因cDNA的克隆和序列分析[J].安徽农业科学, 2006, 34(11):2333-2335.
[6] CEREGHINO J L, CREGG J M. Heterologous protein expression in the methylotrophic yeastPichiapastoris[J]. FEMS Microbiology Reviews, 2000, 24:45-66.
[7] 贾向志,袁汉英,马文煜,等.人溶菌酶基因的克隆及其在毕赤酵母中的表达[J].第四军医大学学报, 2001, 22(22):2068-2072.
[8] 胡乔,赵凌侠,唐克轩.在毕赤酵母中表达人溶菌酶蛋白的研究[J].上海交通大学学报:农业科学版, 2008, 26(3):233-236.
[9] SU Zhijian, WU Xiaoping, FENG Ya, et al. High level expression of human endostatin inPichiapastorisusing a synthetic gene construct[J]. Applied Microbiology and Biotechnology, 2007, 73:1355-1362.

