地膜中酞酸酯类化合物及重金属对土壤一大豆体系的污染研究
于立红,王鹏,焦 峰,王孟雪,于立河
(黑龙江八一农垦大学,黑龙江大庆163319)
地膜是农业生产的重要物质资料,我国每年地膜应用量近百万吨,地膜覆盖面积达1 000多万公顷[1]。随着地膜应用量和使用年限的不断增加,大量残留地膜造成的白色污染不但严重影响农业生产的进行,而且对农业环境的安全与生态健康也构成了巨大的威胁。地膜尤其是PVC塑料薄膜的生产过程中需添加40%~60%左右的增塑剂,主要是酞酸酯类化合物,以保证塑料的可塑性[2]。酞酸酯(PAEs)类化合物亦称邻苯二甲酸酯类化合物,是苯二甲酸酐与醇类酯化反应生成的化合物,有邻位、对位和间位3种异构体。酞酸酯类化合物从二甲基酯到十三烷基酯共20多种化合物。我国塑料添加剂中最常用的是邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二异辛酯(DEHP)。PAEs存在于土壤中,不仅影响作物的生长和产品质量,而且能够通过食物链进入人体,在人体内富集,最终对人体的健康造成影响。研究表明DBP和DEHP具有致突、致畸、致癌性和遗传毒性,能够干扰动物和人体的内分泌系统,对人和动物的生殖系统造成较大的危害[3-7]。美国EPA和中国环境监测总站都将它们列为优先控制污染物。因此人们对它们在土壤中的污染和在作物体内的累积给予了极大的关注。此外,为了使农膜在日光的照射下能够保持稳定性,还要在其中加入一些热稳定剂,农用塑料薄膜生产应用的热稳定剂中大部分都含有Cd和Pb。在大量使用地膜过程中造成土壤重金属的污染[8]。
对于酞酸酯类化合物的毒理性及对水体、空气、食品等的污染研究国内外学者已经做了大量工作[9-10],对土壤和植物体的污染也有一些研究,但多数都是关于酞酸酯类化合物在土壤中的迁移降解性及利用微生物进行生物降解研究[11-13]。对于地膜中酞酸酯类化合物对土壤-作物体系污染的研究较少。国内外学者研究重金属对土壤及作物体系污染较为广泛,其中对土壤中重金属分布规律、污染状况、污染评价及植物对土壤中重金属的吸收效应等研究较多,而对地膜中重金属污染研究未见报道。本文通过在盐化草甸土和草甸白浆土上,采用田间试验方法,深入研究大豆各生育时期不同地膜残留量处理,土壤、植株和籽粒中DBP、DEHP和重金属Pb、Cd含量的差异及累积特性,为农产品的安全生产提供理论依据。
1 材料与方法
1.1 供试材料
试验设在黑龙江八一农垦大学试验基地(大庆)和黑龙江农垦总局850农场。黑龙江八一农垦大学试验基地大豆品种为绥农14,土壤类型为盐化草甸土,前茬作物为玉米。850农场大豆品种为垦丰16,土壤类型为草甸白浆土,前茬作物为大豆。供试地膜宽50 cm,厚0.008 mm,主要成分聚乙烯、抗氧化剂、增塑剂等,大庆市第五塑料厂提供。土壤中DBP、DEHP及Pb、Cd本底含量见表 1。
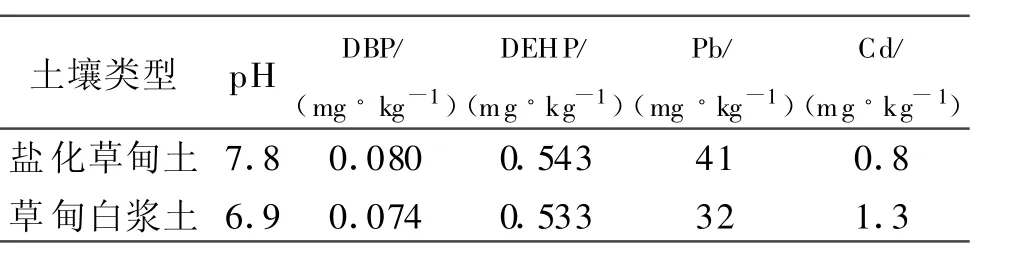
表1 供试土壤基础含量
1.2 试验设计
1.2.1 试验方法 两个试验点处理方法一致,将地膜剪成边长为0.05 m的正方形小块,均匀搅拌于大豆耕层内0.2 m,然后播种大豆。大豆栽培密度为:190 570株/hm2,行距为0.7 m,株距0.05 m,人工逐个摆种。小区面积为17.5 m2(3.5 m×5 m),每区播种5行。大豆施肥量按当地常规用量,田间管理按当地习惯进行。
1.2.2 试验设计 在田间小区试验中,每个处理设3次重复,随机区组排列,两个试验场的小区试验处理相同。资料显示植物体中DEHP含量很低,检测不出来[14],因此本试验考虑到检测水平增加地膜残留量,试验设3个处理,分别为CK(0)、1倍(65.9 kg/hm2)和3倍(197.7 kg/hm2)地膜残留量。大豆播种时间为5月7日,播种后30,60,90,120 d取样测定土壤样品和地上植株样品中 DBP、DEHP和Pb、Cd含量。取样及测定的所有过程均不接触塑料及金属制品。
1.2.3 数据处理 用DPS软件对结果进行统计分析和显著性检验。
1.3 采样及检测
1.3.1 土壤与植株取样方法 用环刀取0-20 cm深度耕层土壤样品,自然风干,研磨前去除根系和杂质,过100目尼龙筛保存。植株样品于105℃杀青30 min,70℃烘干称重粉碎。
1.3.2 DBP和 DEHP检测 气相色谱仪:Agilent6890N,配置火焰离子化检测器(FID)(Made in USA),色谱柱采用DP-5毛细管柱。色谱条件:进样口温度300℃,分流进样。柱箱采用程序升温方式升温。检测器温度 320℃,H2:40 ml/min,空气:400 ml/min,N2:40 ml/min分别测定DBP和DEHP。
1.3.3 铅和镉检测 样品在大庆市绿色食品检测中心测定,采用石墨炉方法。土壤Pb和Cd含量测定标准执行GB/T 17141-1997;植株Pb和Cd含量测定标准执行GB/T 5009.12-2003。
2 结果与分析
2.1 大豆不同生育时期土壤中DBP和DEHP含量
2.1.1 盐化草甸土土壤中DBP和DEHP含量差异从图1可以看出,各个生育时期,高倍地膜残留量土壤中DBP、DEHP含量均高于低倍残留量;各处理土壤中DBP和DEHP含量差异均达到显著水平。随着生育周期延长,CK处理土壤中DBP和DEHP含量均显著降低。资料显示土壤中DBP和DEHP不易被降解[15-16],表明大豆对酞酸酯类化合物有显著吸收作用。对土壤中DBP和DEHP含量与生育时期做相关分析,相关系数分别为0.973和0.962,均为显著相关。1倍和3倍处理,土壤中DBP和DEHP含量都随着生育周期的延长呈增加趋势,表明地膜中酞酸酯类化合物是缓慢释放的而且释放量逐渐增加,释放速度大于作物的吸收速度。同样1倍和3倍处理对土壤中DBP和DEHP含量与生育时期做相关分析,相关系数分别为0.967,0.966和0.957,0.954,均为显著相关。
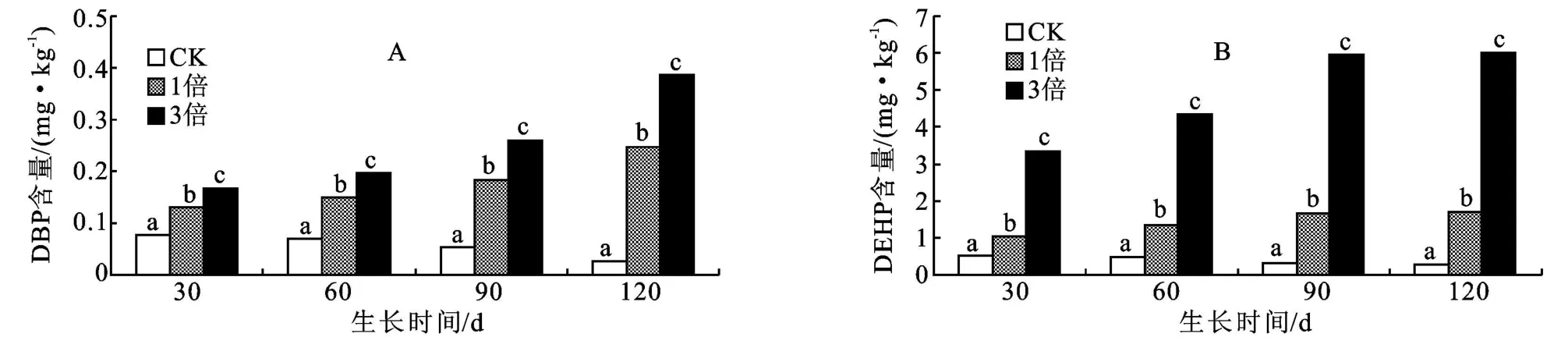
图1 盐化草甸土上大豆各生育时期3种残留量土壤中DBP和DEHP含量比较
2.1.2 草甸白浆土土壤中DBP和DEHP含量差异图2表明,各生育时期,高倍地膜残留量土壤中DBP、DEHP含量高于低倍残留量,各处理土壤中DBP和DEHP含量差异均达到显著水平。这与盐化草甸土结论相同。
随着生育周期延长,CK处理土壤中DBP和DEHP含量显著降低,对土壤中DBP和DEHP含量与生育时期做相关分析,呈线性关系,相关系数分别为0.978和0.961,达到显著水平;1倍地膜残留量土壤中DBP和DEHP含量随着生育周期延长呈增加趋势,相关系数分别为0.968和0.964,达到显著水平;3倍地膜残留量土壤中DBP与生育时期相关系数为0.728,相关性不显著,DEHP含量随着生育周期延长均呈缓慢增加趋势,相关系数为0.953,达到显著水平。
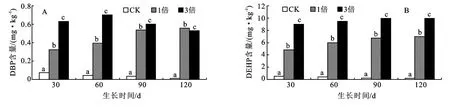
图2 草甸白浆土上大豆各生育时期3种地膜残留量土壤中DBP、DEHP含量比较
2.2 大豆不同生育时期植株体内DBP和DEHP含量
从图3中可以看出,两类土壤上各个生育时期,高倍地膜残留量植株中DBP含量高于低倍残留量,各处理DBP含量差异均达到显著水平。在两类土壤上,整个生育期大豆植株中都能检测到DBP,生育期内DBP含量变化规律相同。生育前期,随着大豆生长发育根系吸收能力增强,各处理植株体内DBP含量均有增加的趋势;生育中期,植株体内的DBP随植株生长发育向新组织转移,所以在作物生长旺盛时期各处理植株体内DBP含量有降低趋势;生育后期,随着根系不断吸收,植株体新生组织增长缓慢,各处理植株体内DBP含量又有增加趋势。
两种土壤上,大豆各生育时期各处理植株体内均未检测出DEHP含量。根据尹睿等[15]研究表明,土壤中的DEHP绝大多数都被土壤颗粒所吸附,从而影响了其植物可利用性。在植物的地上部分DBP的含量较高,而DEHP含量很低,用GC方法测不出来。Kato等[16]报道在生长于DEHP污染的土壤上的茼蒿、芜菁和菠菜中测不到DEHP。本试验结果与他们的报道相一致。这些结果都表明植物对DEHP的吸收是很少的。
2.3 大豆不同生育时期土壤中Pb和Cd含量比较
从图4中可以看出,各生育时期,高倍地膜残留量盐化草甸土土壤中Pb、Cd含量均高于低倍残留量。各处理间土壤中Pb含量差异均达到显著水平,生育期60 d和90 d各处理土壤中Cd含量差异达到显著水平,30 d和120 d时1倍地膜残留量与3倍地膜残留量Cd含量差异显著。随着生育周期延长,相同处理土壤中Pb和Cd含量变化不大,表明地膜中重金属释放缓慢。
与盐化草甸土相同,相同处理各生育时期,草甸白浆土土壤中Pb、Cd含量也无明显差异,进一步证明上面的结论。比较相同生育期不同地膜处理土壤中Pb、Cd含量可以看出,各处理存在差异显著性,见图5。
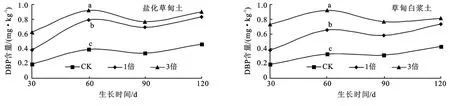
图3 不同土壤上大豆各生育时期3种地膜残留量植物体内DBP含量比较
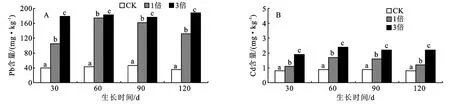
图4 盐化草甸土上大豆各生育时期3种地膜残留量土壤中Pb、Cd含量比较
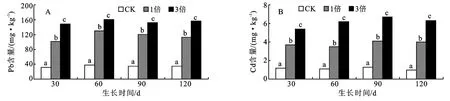
图5 草甸白浆土大豆各生育时期3种地膜残留量土壤中Pb、Cd含量比较
2.4 大豆各生育时期植株体内Pb和Cd含量比较
从图6中可以看出,盐化草甸土上高倍地膜残留量植株和籽粒中Pb、Cd含量均高于低倍残留量。显著性比较可以看出,植株和籽粒中Pb含量1倍和3倍处理间差异不显著;Cd含量各处理间差异均不显著。说明大豆对重金属吸收数量少,增加地膜残留量,植株和籽粒中重金属含量没有明显区别。各处理籽粒中Pb、Cd含量低于植株。

图6 盐花草甸土上3种地膜残留量大豆收获期植株和籽粒中Pb、Cd含量比较

图7 草甸白浆土上3种地膜残留量大豆收获期植株和籽粒中Pb、Cd含量比较
与盐化草甸土相同,草甸白浆土上植株和籽粒中,高倍地膜残留量Pb、Cd含量均高于低倍残留量。显著性比较可以看出,植株中Pb含量各处理间差异不显著,籽粒中1倍和3倍处理间差异不显著;植株中Cd含量1倍处理和3倍处理间差异显著,籽粒中Cd含量各处理间差异均不显著。草甸白浆土试验结果也能看出籽粒中Pb、Cd含量低于植株,见图7。
3 小结
本研究结果表明,盐化草甸土和草甸白浆土大豆各生育时期,高倍地膜残留量土壤和植株中DBP、DEHP高于低倍残留量,差异达到显著水平,两类土壤植株中均未检测出DEHP。CK处理土壤中DBP和DEHP含量随着生育周期延长显著降低,而1倍和3倍地膜残留量则呈增加趋势,表明地膜中酞酸酯类化合物是缓慢释放的而且释放量逐渐增加,释放速度远大于作物的吸收速度。各生育时期,高倍地膜残留量土壤中Pb、Cd含量均高于低倍残留量,差异达到显著水平。相同处理土壤中Pb、Cd含量在大豆整个生育期内变化不大,表明地膜中重金属释放缓慢。1倍和3倍处理植株和籽粒中Pb含量差异不显著,说明大豆对重金属吸收数量少,增加地膜残留量,植株和籽粒中重金属含量无明显区别。各处理籽粒中Pb、Cd含量低于植株。两类土壤试验结论相同。
[1] 何文清,严昌荣,赵彩霞,等.我国地膜应用污染现状及其防治途径研究[J].农业环境科学学报,2009,28(3):533-538.
[2] 安琼,靳伟,李勇,等.酞酸酯类增塑剂对土壤-作物系统的影响[J].土壤学报,1999,36(1):118-125.
[3] Baram G L,Azarova I N,Gorshkov A G,et a1.Determination of bis(2-ethylhexyl)phthalate in water by highperformance liquid chromatography with direct on-column preconcentration[J].Journal of Analytical Chemistry,2000,55(8):750-754.
[4] 张娜,刘欣.邻苯二甲酸酯类化合物的研究进展[J].环境科学导刊,2009,28(3):25-28.
[5] Casajuana N,Lacorte S.Presence and release of phthalic esters and other endocrine disrupting compounds in drinking water[J].Chromatographia,2003,57(9/10):649-655.
[6] Ogunfowokan O,Torto N,Adenuga A A,et a1.Survey of levels of phthalate ester plasticizers in a sewage lagoon effluent and a receiving stream[J].Environmental Monitoring and Assessment,2006,118(1/3):457-480.
[7] Yan Xu,Gregory T,Knipp,et a1.Effects of di-(2-ethylhexyl)-phthalate and its metabolites on the lipid profiling in rat HRP-1 trophoblast cells[J].Archives of Toxicology,2006,80(5):293-298.
[8] 郑喜川,鲁安怀,高翔,等.土壤中重金属污染现状与防治方法[J].土壤与环境,2002,11(1):79-84.
[9] Yoshida T,Tanabe T,Chen A,et al.Method for the degradation of dibutyl phthalate in water by gamma-ray irradiation[J].Journal of Radio Analytical and Nuclear Chemistry,2003,255(2):265-269.
[10] Yano K,Hirosawa N,Sakamoto Y,et al.Phthalate levels in baby milk powders sold in several countries[J].Bulletin of Environmental Contamination and Toxicology,2005,74(2):373-379.
[11] Patil N K,Kundapur R,Shouche Y S,et a1.Degradation of a Plasticizer,di-n-Butylphthalate by Delftia sp.TBKNP-05[J].Current Microbiology,2006,52(3):225-230.
[12] Patil N,Karegoudar T.Parametric studies on batch degradation of a Plasticizer Di-n-Butylphthalate by immobilized bacillus sp[J].World Journal of Microbiology and Biotechnology,2005,21(8/9):1493-1498.
[13] Koch H,Bolt H,Angerer J.Di(2-ethylhexyl)phthalate(DEHP)metabolites in human urine and serum af ter a single oral doseof deuterium-labelled DEHP[J].Archives of Toxicology,2004,78(3):123-130.
[14] 尹睿,林先贵,王曙光,等.土壤中 DBP/DEHP污染对几种蔬菜品质的影响[J].农业环境科学学报,2004,23(1):1-5.
[15] Cartwright C D,Thompson I P,Burns R G.Degradation and impact of phthalate plasticizers on soil microbial communities[J].Environ.Toxicol Chem.,2000,19(5):1253-1261.
[16] 蔡全英,莫测辉,吴启堂,等.水稻土施用城市污泥盆栽通菜土壤中邻苯二甲酸酯(PAEs)的残留[J].环境科学学报,2003,23(3):365-369.

