动脉粥样硬化斑块OxLDL靶向的MR分子影像学实验研究
付明翠,文 颂,卢 瞳,柳东芳,周官辉,安艳丽,廖 蕾,居胜红,滕皋军
动脉粥样硬化(atherosclerosis, AS)及其相关心脑血管疾病是西方发达国家患者死亡和致残的首位原因[1]。在我国,近年来AS的发病率也有明显增加的趋势。最新的研究表明,急性心脑血管事件(脑卒中、短暂性脑缺血发作、急性冠脉综合征) 主要是由于动脉粥样硬化内的易损性斑块引起的[2],而与血管狭窄程度无直接关系[3]。传统影像技术在诊断动脉粥样硬化斑块时,只能显示斑块所造成的血管狭窄程度,并不能有效地反映斑块的病理生理学性质和稳定性。近年来,分子影像技术作为易损斑块早期检测的一种新策略,引起心血管病研究者的重视[4,5]。
氧化型低密度脂蛋白(oxLDL)在动脉粥样硬化斑块的发生、发展以及不稳定斑块进展中发挥了重要的作用[6,7]。本研究以oxLDL作为MR分子影像成像靶点,构建anti-oxLDL-USPIO靶向分子探针,采用7.0 T micro-MR 成像检测apoE-/-小鼠颈动脉粥样斑块中oxLDL的动态变化,建立动脉粥样硬化斑块形成中的特异性评价体系,并为下一步探讨他汀类药物治疗AS 的作用机制和疗效评价提供一个新的视角。
1 材料与方法
1.1 材料
超微超顺磁氧化铁粒子(聚乙二醇 (polyethylene glycol, PEG)包被USPIO,表面携带羧基活性基团,由中国科学院化学所惠赠[8,9]),兔抗小鼠anti-oxLDL多克隆抗体(北京博奥森公司),非特异性小鼠IgG抗体(北京博奥森公司),1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC.HCl)和Sulfo-NHS均为上海共价化学公司产品,硼酸(江苏永华精细化学品有限公司),十水合四硼酸钠(西陇化工股份有限公司),微量震荡器(上海亚荣生化仪器厂),高速冰冻离心机(eppendorf centrifuge 5804R),透射电子显微镜(TEM,JEM-200CX, 日本JEOL 公司),动态光散射检测(90 Plus ParticleSize Analyzer, Brookha-ven公司),超滤离心管(100KD, Millipore公司产品),7.0 T micro-MR成像仪(德国Bruker公司),冰冻切片机(CMI950,Leica),SP免疫组化试剂盒 (北京中杉金桥生物技术有限公司),DAB显色剂(福建迈新公司),倒置相差显微镜(日本Nikon公司)。
1.2 方法
1.2.1 探针构建及特征检测
取1mg PEG包被的USPIO溶于PH9的硼酸/硼酸钠缓冲溶液(500 μl)中,然后加入EDC 1 mg及sulfa-NHS 0.5 mg混匀,室温下震荡20 min后,加入antioxLDL抗体 200 μg,室温下轻轻摇动3h。反应结束后,使用超滤离心管离心除去未结合的游离抗体。纯化好的anti-oxLDL-USPIO靶向探针重新悬浮于PBS中,4 ℃保存,浓度为1 mg Fe/ml。非特异性IgG-USPIO制备方法同上。采用透射电镜检测磁性纳米颗粒的形貌,动态光散射检测磁性纳米颗粒的水合粒径及探针稳定性,采用酶联免疫吸附间接法(ELISA)检测免疫磁性纳米颗粒的活性,纳米探针的T2及T1弛豫时间采用7.0 T micro-MRI进行检测。
1.2.2 ApoE-/-小鼠套管法颈动脉粥样硬化模型建立
SPF级apoE-/-小鼠(18只,8~10周龄,20.4±0.76 g)购自北京大学动物实验中心。ApoE-/-小鼠予高脂饮食(脂肪10%,胆固醇2%,南京协同医药生物工程公司)喂养2周后, 腹腔注射10% 水合氯醛溶液(0.35 ml/100 g)麻醉后手术切开暴露左侧颈总动脉, 在颈动脉距离颈动脉分叉约0.5 mm处放置套管(内径0.38 mm,外径0.5 mm,长约2 mm),并用2层丝线固定[10]。所有操作均在10倍体视显微镜下进行。术后待小鼠苏醒后将其放回笼中,维持环境温度在20~25 ℃,灯光保持开闭各12 h。所有小鼠继续高脂饮食3周,然后行MR成像。本实验得到东南大学医学院实验伦理委员会批准。
1.2.3 实验分组
实验动物分为anti-oxLDL-USPIO组(6只),非特异性IgG-USPIO组(4只),单纯USPIO组(4只),竞争性抑制组,(1 mg anti-oxLDL-USPIO与1 mg antioxLDL-Abs混合后使用,4只),分别经尾静脉注入anti-oxLDL-USPIO、非特异性IgG-USPIO,单纯USPIO以及anti-oxLDL-USPIO/anti-oxLDL-Abs混合物, 剂量为30 mg Fe/kg,并于注药前、注药后8 h及24 h进行MRI成像。
1.2.4 MR成像
采用德国Bruker 7.0 T micro-MR成像系统,水平扫描架内径16 cm,使用38 mm大鼠头线圈。使用4 %异氟烷麻醉后把小鼠置于有机玻璃扫描床内,利用牙套及耳杆固定鼠脑。以1.5%异氟烷:空气混合气体维持麻醉状态,并监护心率、呼吸。为了使不同时间点的MR图像可以进行匹配,MR成像以小鼠主动脉弓上缘作为起点向上进行连续扫描。扫描采用轴位T2-PD双回波MSME(multi slices multi echo)自旋回波序列,扫描参数:TR 3058 ms,TE 65 ms/13 ms; 层厚0.5 mm,层间距 0,层数 25层,FOV 2.5 cm×2.5 cm,采集次数 3, 矩阵 256×256,空间最小分辨率98 μm×98 μm,扫描时间约为30 min。
1.2.5 MR数据分析
所有MR图像放大300%后,由两位独立的放射科医生目测匹配层面小鼠颈动脉血管信号改变并确定不同时间点(注入药物前、注入药物后8 h和24 h)匹配的MR图像组。通过比较匹配的MR图像上注入探针前、后颈动脉粥样硬化斑块信号的改变,画出感兴趣区(ROI)。采用Bruker 7.0 T自带的paravision 5.0软件测量不同时间点相同层面血管斑块信号改变区的MR信号强度(SIplaque),并与相邻肌肉的MR信号强度(SImuscle)进行比较,计算相对信号强度(relative signal intensity, rSI)[3,11]。采用相对信号强度改变率(relative signal intensity changes, rSIC)评估注药后不同时间点颈动脉粥样硬化斑块ROI区相对信号强度的改变率。

表1 不同USPIO探针的物理特征Table 1 The physical properties of various USPIO nanoparticles
计算公式为:
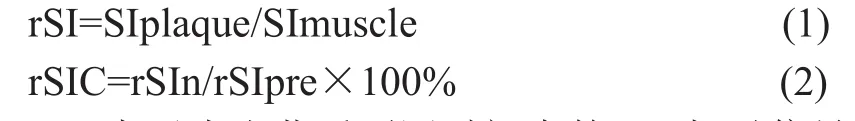
rSIn表示为注药后不同时间点的ROI相对信号强度,rSIpre为注药前ROI的相对信号强度。
1.2.6 颈动脉标本的处理与测定
MR扫描结束后,小鼠腹腔过量麻醉。非直视下心脏取血后,开胸,充分暴露心脏,左心室灌注PBS 50~100 ml后,中性福尔马林原位固定10~15 min。体视显微镜下取出左侧颈动脉,取材长度为左侧颈动脉分叉水平到套管下方5 mm处,小心剥离颈动脉外套管后,OCT包埋,冰冻切片机切片,厚度约6 μm。以颈动脉分叉为起点,每个颈动脉切10~12层,每层间隔500 μm,与MR图像进行匹配,常规HE染色。
1.2.7 免疫组化分析
使用CD68(1:100, Biolegend)检测斑块内巨噬细胞分布,使用anti-oxLDL-Abs (1∶100, Bioss)检测斑块内oxLDL分布,染色步骤按试剂盒说明进行,以PBS代替一抗作为阴性对照。
1.2.8 普鲁士蓝染色
将冰冻切片用PBS洗涤3次,用4%多聚甲醛固定20 min,普鲁士蓝反应液(等体积10%盐酸水溶液与10%亚铁氰化钾临时混合)孵育10 min,蒸馏水洗涤3次,0.5%核固红复染3 min,再蒸馏水洗涤3次,置正置相差显微镜下观察铁染色情况。
1.2.9 数据分析
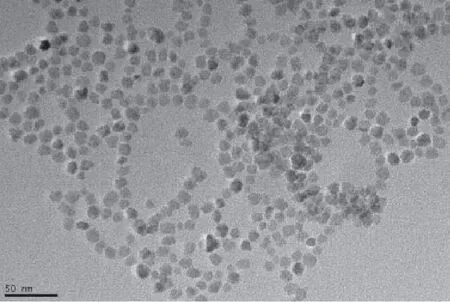
图1 anti-oxLDL-USPIO透射电镜图像Fig 1 TEM photograph of anti-oxLDL-USPIO nanoparticle.
2 结果
2.1 探针特征
磁性纳米探针的物理特性见表1。合成好的antioxLDL-USPIO呈淡黄色,澄清,无明显沉淀,透射扫描电镜显示anti-oxLDL-USPIO靶向磁性纳米颗粒呈细颗粒状外观,大小均一,粒径大小为11.8±1.5 nm,散在分布(图1);ELISA结果显示,anti-oxLDLUSPIO OD450值与单纯anti-oxLDL抗体接近; antioxLDL-USPIO煮沸后及单纯USPIO的OD450值明显降低,与单纯anti-oxLDL-USPIO比较有统计学差异,P<0.05(图2)。
2.2 MR成像
尾静脉分别注入anti-oxLDL-USPIO、IgGUSPIO、单纯USPIO及anti-oxLDL-USPIO/antioxLDL-Abs混合物前、注入后8 h、24 h行MR成像,所有动物生存质量良好,未见明显毒性作用。共获得66组(198副)不同时间点匹配的MR图像进入信号强度分析,每只动物提供3~6个可用的MR图像组。注入探针前,各组动物颈动脉粥样硬化斑块在MR T2WI图像上显示为管壁信号不均匀增高,管壁增厚,管腔狭窄,平均相对信号强度分别为
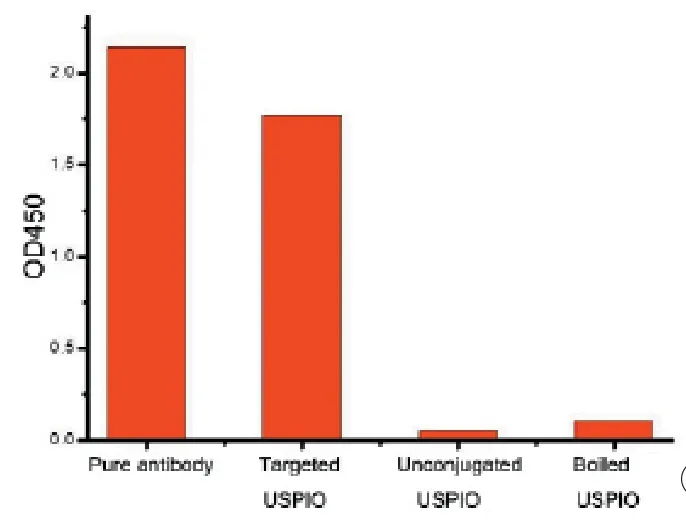
图2 ELISA结果显示靶向探针的生物学活性Fig 2 ELISA results showed the activity of pure antibody, anti-oxLDL-USPIOs, unconjugated USPIOs and boiled anti-oxLDL-USPIOs on OD450 values.
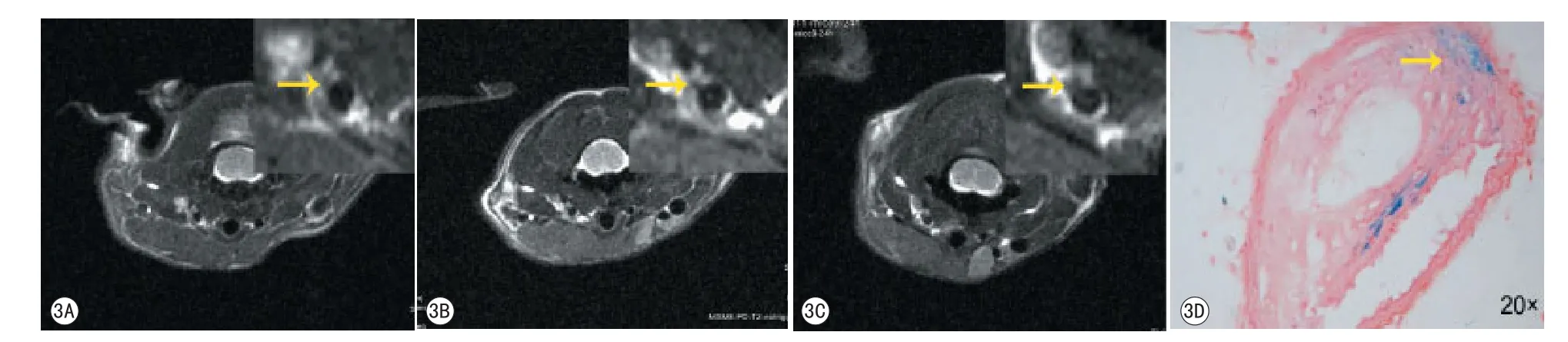
图3 不同时间点ApoE-/-鼠颈动粥样硬化斑块T2WI图像。3A~3C分别为注入anti-oxLDL-USPIO前、注入后8 h、24 h MR T2WI图像。3D为病理图片(普鲁士蓝染色)显示斑块内见铁沉积Fig 3 T2-weighted images at pre-, 8 h and 24 h post injection of anti-oxLDL-USPIO (A-C).The Prussian blue stain (D) showed the USPIO was deposited in the plaque.
2 2.14±0.55 (n=24)、2.63±0.69 (n=16)、2.49±0.69(n=16) 和1.97±0.87 (n=10), 各组间比较无显著性差异,P>0.05。注入anti-oxLDL-USPIO后8 h及24 h后,与注药前比较,信号改变率达-30.4±16%、-34.7±19%,与注药前比较P值均小于0.01,普鲁士蓝染色显示颈动脉斑块信号减低区有大量铁颗粒沉积(图3);非特异性IgG-USPIO组8 h及24 h颈动脉粥样硬化斑块相对信号改变率分别为4.2±17.4%和-4.8±15.8%,与注药前比较,P值分别为0.495和0.121;单纯USPIO组8 h及24 h颈动脉粥样硬化斑块相对信号改变率分别为-0.01±27.6%、1.39±19.0%,与注药前比较,P值分别为0.775和0.812;竞争性抑制组8 h及24 h颈动脉粥样硬化斑块相对信号改变率分别为-6.9±17.5% 和-8.2±16.1%,与注药前比较,P值分别为0.595和0.12。普鲁士蓝染色显示颈动脉粥样硬化斑块内仅见少量的点状铁颗粒沉积,各时间点与anti-oxLDL-USPIO组比较均有统计学差异,P<0.05(图4)。
2.3 病理及免疫组化分析
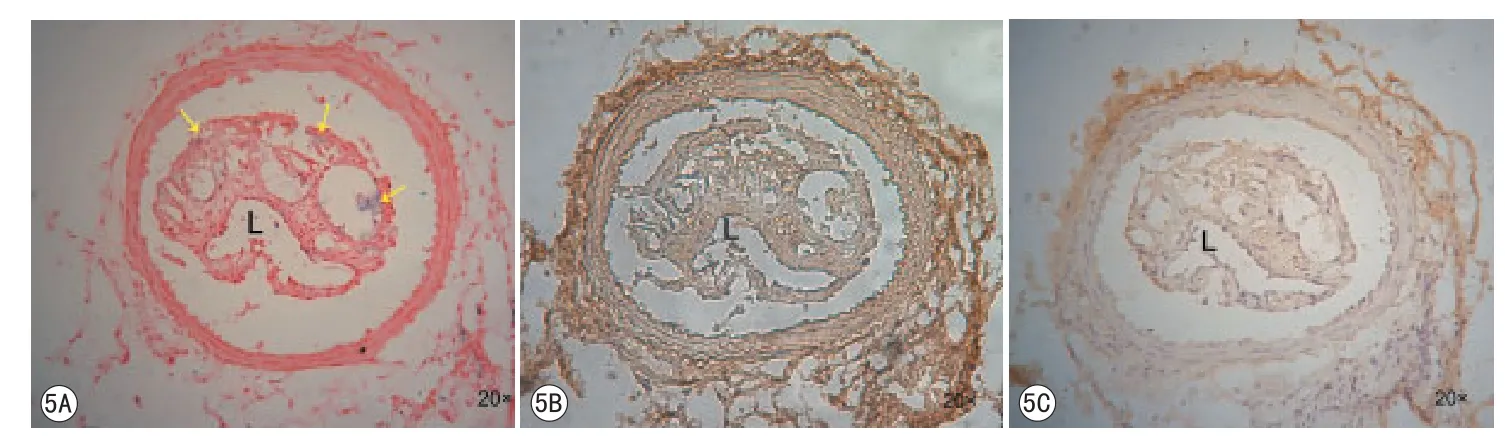
图5 颈动脉粥样硬化斑块病理及免疫组化染色。5A~5C分别为普鲁士蓝染色,oxLDL及CD68免疫组化染色,黄色箭头显示经动脉粥样硬化斑块内的铁沉积。L显示为颈动脉内腔Fig 5 History and immunohistochemistry of carotid atherosclerosis lesions.Prussian blue stain(A) and Immunohistochemistry stain of oxLDL (B) and CD68 (C), yellow arrows show the iron deposition.L indicates the lumen of carotid.
Anti-oxLDL-USPIO探针组小鼠颈动脉粥样硬化斑块相同层面分别行普鲁士蓝染色、oxLDL 及CD68免疫组化染色,结果显示,普鲁士蓝染色片上蓝染颗粒与oxLDL、CD68棕色颗粒分布基本一致(图5)。
3 讨论
本研究以聚乙二醇(PEG)包被的USPIO纳米颗粒作为成像载体,通过EDC/sulfa-NHS方法,构建antioxLDL-USPIO靶向探针,其水合粒径约为30 nm,在PBS溶液中具有良好的稳定性及生物学活性。与巨噬细胞被动靶向的葡聚糖包被的USPIO比较[12,13],本实验中所用的PEG包被的USPIO具有能够降低血浆蛋白结合率,减少网状内皮系统清除率,增加循环时间的优点,因而更适用于动脉粥样硬化斑块的分子影像学研究[14]。小鼠活体MRI显示,注入anti-oxLDLUSPIO探针后8 h,apoE-/-小鼠颈动脉粥样硬化斑块局部信号即可看到减低,24 h后信号减低更为明显,普鲁士蓝染色证实信号减低区内有大量USPIO颗粒沉积,与oxLDL及CD68免疫组化阳性区域一致;在竞争性抑制组,小鼠颈动脉粥样硬化斑块信号在8 h及24 h仅轻度降低,与靶向探针组比较差异有统计学意义,P<0.05,其原因与游离的anti-oxLDL抗体可能与靶向探针竞争性结合特定作用位点有关;注入非特异性IgG-USPIO及单纯USPIO后,小鼠颈动脉粥样硬化斑块信号轻度减低;病理及免疫组化结果显示anti-oxLDL-USPIO主要在oxLDL含量丰富的巨噬细胞内沉积。小鼠体内研究结果及免疫组化证实,anti-oxLDL-USPIO可以作为oxLDL 特异性靶向分子影像成像载体,可以无创、活体检测动脉粥样硬化斑块内oxLDL及巨噬细胞的分布。
OxLDL在动脉粥样硬化斑块的发生、发展中起主要作用,是导致不稳定斑块发生的重要因素[15,16]。OxLDL可以导致斑块内的巨噬细胞和平滑肌细胞转化为泡沫细胞,促进血管平滑肌细胞的增生与移行,引起内皮细胞凋亡,启动瀑布效应,促进血栓形成。在分子水平,oxLDL可以促进多种粘附分子、热休克蛋白的表达上调,抑制NO和前列腺环素的产生,并诱导多种促炎症细胞因子和生长因子的表达。OxLDL是一种复杂抗原,其组成成分如载脂蛋白(apoB100)、磷脂、脂肪酸等均可以发生氧化反应,这些氧化位点可以产生多种单克隆抗体,如MDA2[17]、IK17[18]、E06等。Torzewski等[19]使用I125-MDA2抗体检测兔主动脉粥样硬化斑块内的oxLDL的分布,研究进一步显示,使用他汀类药物干预后,斑块内的I125-MDA2核素浓聚明显减低;Briley-Saebo等[20]使用E06、MDA2和IK17抗体接载钆剂微球构建oxLDL氧化特异性表位的MR分子探针,研究结果表明,主动脉粥样硬化apoE-/-小鼠尾静脉注入MDA2-钆剂微球、E06钆剂微球、IK17钆剂微球后24~72 h后,主动脉粥样硬化斑块信号明显增加,72h最为明显,其强化率达到125%、137%和231%;使用游离的MDA2抗体与MDA2-钆剂微球竞争oxLDL氧化特异性表位后,其血管信号强化明显减低;非特异性IgG-钆剂微球未见明显信号改变。随后,Briley-Saebo等[21]又使用E06、MDA2和IK17抗体接在脂质体包裹的USPIO上,构建抗体-USPIO靶向探针,研究发现,apoE-/-小鼠经过眼眶静脉注入抗体-USPIO靶向探针后24 h,主动脉粥样硬化斑块T2值减少,以E06-USPIO组T2值减少最为明显,与钆剂微球实验结果相仿。这两个实验表明,尽管都是用oxLDL靶向单克隆抗体,但是MDA2、IK17靶向探针与E06靶向探针在动脉粥样硬化斑块的显示效果存在一定差别,提示oxLDL单克隆抗体不能充分反映斑块内的oxLDL分布的状况。本实验以oxLDL多克隆抗体作为斑块内的oxLDL识别抗体,在8 h即可以看到斑块信号的降低,使用过量的游离anti-oxLDL抗体进行竞争性抑制后,斑块信号降低程度明显减弱。针对oxLDL这样一种复杂抗原,本研究为oxLDL靶向分子影像提供了新的研究策略。
本研究也存在一些问题。首先,各组的动物数量相对较少,大样本的动物实验研究更具有说服力。其次,本实验中使用的USPIO的剂量相对过高。对探针进行改良,使其保持探针特异性的同时并能改善其药物代谢动力学特征是本实验下一步研究的方向。最后,本实验所用的纳米材料的生物安全性还有待进一步评估。
总之,本研究合成了oxLDL靶向的USPIO纳米探针,可在活体MR上检测测apoE-/-小鼠颈动脉粥样硬化斑块内的oxLDL分布,其分布区与斑块内oxLDL表达区及巨噬细胞浸润区呈正相关。AntioxLDL-USPIO可以在24 h内特异性显示颈动脉粥样硬化斑块内的oxLDL分布,有助于不稳定粥样硬化斑块的早期检测及药物疗效评估。
[1]Roger VL, Go AS, Lloyd-Jones DM, et al.Heart disease and stroke statistics--2011 update: a report from the American Heart Association.Circulation, 2011, 123(4):e18-e209.
[2]Fuster V, Moreno PR, Fayad ZA, et al.Atherothrombosis and high-risk plaque: part I: evolving concepts.J Am Coll Cardiol, 2005, 46(6): 937-954.
[3]Tang T, Howarth SP, Miller SR, et al.Assessment of inflammatory burden contralateral to the symptomatic carotid stenosis using high-resolution ultrasmall,superparamagnetic iron oxide-enhanced MRI.Stroke,2006, 7(9): 2266-2270.
[4]Fayad ZA, Fuster V.The human high-risk plaque and its detection by magnetic resonance imaging.Am J Cardiol,2001, 88(2): 42-45.
[5]Fayad ZA.The assessment of the vulnerable atherosclerotic plaque using MR imaging: a brief review.Int J Cardiovasc Imaging, 2001, 17(3): 165-177.
[6]Taylor J, Butcher M, Zeadin M, et al.Oxidized lowdensity lipoprotein promotes osteoblast differentiation in primary cultures of vascular smooth muscle cells by up-regulating Osterix expression in an Msx2-dependent manner.J Cell Biochem, 2011, 112(2): 581-588.
[7]Zettler ME, Prociuk MA, Austria JA, et al.OxLDL stimulates cell proliferation through a general induction of cell cycle proteins.Am J Physiol Heart Circ Physiol,2003, 284(2): 644-653.
[8]Zhen L, Gao MY, Lei H.One-pot reaction to synthesize biocompatible magnetite nanoparticles.Adv mater, 2005,17(8): 1001-1005.
[9]Hu FQ, Zhou Z, Yu L, et al.Preparation of biocompatible magnetite nanocrystals for in vivo magnetic resonance detection of cancer.Adv mater, 2006, 18(19): 2553-2556.
[10]von der Thusen JH, van Berkel TJ, Biessen EA.Induction of rapid atherogenesis by perivascular carotid collar placement in apolipoprotein E-defi cient and low-density lipoprotein receptor-deficient mice.Circulation, 2001,103(8): 1164-1170.
[11]Trivedi RA, Mallawarachi C, JM UK-I, et al.Identifying infl amed carotid plaques using in vivo USPIO-enhanced MR imaging to label plaque macrophages.Arterioscler Thromb Vasc Biol, 2006, 26(7): 1601-1606.
[12]Trivedi RA, JM UK-I, Graves MJ, et al.In vivo detection of macrophages in human carotid atheroma: temporal dependence of ultrasmall superparamagnetic particles of iron oxide-enhanced MRI.Stroke, 2004, 35(7): 1631-1635.
[13]Tang TY, Patterson AJ, Miller SR, et al.Temporal dependence of in vivo USPIO-enhanced MRI signal changes in human carotid atheromatous plaques.Neuroradiology, 2009, 51(7): 457-465.
[14]Taratula O, Garbuzenko O, Savla R, et al.Multifunctional nanomedicine platform for cancer specific delivery of siRNA by superparamagnetic iron oxide nanoparticlesdendrimer complexes.Curr Drug Deliv, 2011, 8(1): 59-69.
[15]Matsuura E, Hughes GR, Khamashta MA.Oxidation of LDL and its clinical implication.Autoimmun Rev, 2008,7(7): 558-566.
[16]Ishigaki Y, Katagiri H, Gao J, et al.Impact of plasma oxidized low-density lipoprotein removal on atherosclerosis.Circulation, 2008, 118(1): 75-83.
[17]Tsimikas S, Shortal BP, Witztum JL, et al.In vivo uptake of radiolabeled MDA2, an oxidation-specifi c monoclonal antibody, provides an accurate measure of atherosclerotic lesions rich in oxidized LDL and is highly sensitive to their regression.Arterioscler Thromb Vasc Biol, 2000,20(3): 689-697.
[18]Shaw PX, Horkko S, Tsimikas S, et al.Humanderived anti-oxidized LDL autoantibody blocks uptake of oxidized LDL by macrophages and localizes to atherosclerotic lesions in vivo.Arterioscler Thromb Vasc Biol, 2001, 21(8): 1333-1339.
[19]Torzewski M, Shaw PX, Han KR, et al.Reduced in vivo aortic uptake of radiolabeled oxidation-specifi c antibodies reflects changes in plaque composition consistent with plaque stabilization.Arterioscler Thromb Vasc Biol,2004, 24(12): 2307-2312.
[20]Briley-Saebo KC, Shaw PX, Mulder WJ, et al.Targeted molecular probes for imaging atherosclerotic lesions with magnetic resonance using antibodies that recognize oxidation-specific epitopes.Circulation, 2008, 117(25):3206-3215.
[21]Briley-Saebo KC, Cho YS, Shaw PX, et al.Targeted iron oxide particles for in vivo magnetic resonance detection of atherosclerotic lesions with antibodies directed to oxidation-specific epitopes.J Am Coll Cardiol, 2011,57(3): 337-347.

