siRNA沉默CD147基因对肝癌细胞的影响
赵先胜,任志群
(1.浙江省宁波市传染病医院,浙江 宁波 315010; 2.西安交通大学医学院第一附属医院肝病科,陕西 西安 710061)
肿瘤的侵袭生长是一个多因素、多步骤的过程,细胞外基质(主要是Ⅳ型胶原蛋白)不仅是肿瘤细胞赖以生存的场所,还是肿瘤细胞迁徙的天然屏障。CD147又被称为促细胞外基质金属蛋白酶因子(extracellular matrix metalloproteinase inducer,EMMPRIN)或basigin,在肿瘤细胞表面高度表达,刺激肿瘤细胞周围的成纤维细胞分泌基质金属蛋白酶(MMP)。研究发现,CD147在多种肿瘤中高表达,同时MMP活性增加,与肿瘤的浸润和转移密切相关。笔者通过下调CD147基因表达来观察肝癌细胞增殖及凋亡的改变,报道如下。
1 材料与方法
1.1 材料
含有人 U6启动子的 pSilencerTM4.1-CMV neo质粒(美国Ambion公司);大肠杆菌DH5α(大连宝生物工程有限公司);限制性内切酶(Bam HⅠ,HindⅢ)、T4 DNA连接酶(美国 NEB公司);DNA marker(大连宝生物工程有限公司);质粒小量抽提试剂盒(天为时代公司);胶回收试剂盒(广州美津生物公司);Lipofectamine 2000转染试剂盒、G418(美国 Invitrogen公司);内参 β-actin、CD147单克隆抗体(美国R&D公司)。
1.2 方法
1.2.1 siRNA的制备
根据美国基因序列数据库中报道的CD147基因核苷酸序列(NM_198589),输入Ambion公司的在线siRNA设计软件,软件将自动分析和显示候选siRNA。根据文献[3-4]报道的siRNA设计原则和经验,进一步在候选siRNA中筛选最佳者。设计的siRNA由上海吉凯基因化学技术有限公司合成,引物序列见正义链:5'-AGCTTAAGACCTTGGCTCCAAGATACTCTCTTGAAGTATCTTGGAGCCAAGGTCG-3';反义链:5'-GATCCGACCTTGGCTCCAAGATACTCAAGAGAGTATCTTGGAGCCAAGGTCTTA - 3'。
1.2.2 CD147/siRNA表达载体的构建及鉴定
参照Ambion公司说明书,将合成的siRNA连接至pSilencerTM4.1-CMV neo质粒,转化至DH5α感受态细胞,挑选阳性克隆,用质粒小量抽提试剂盒小量提取质粒后,载体CD147/siRNA经BamHⅠ和HindⅢ双酶切,12%聚丙烯酰胺凝胶电泳鉴定,样本送检行DNA测序。
1.2.3 细胞转染与筛选
细胞培养条件为10%胎牛血清、100 g/L青霉素和100 g/L链霉素的RPMI 1640培养基于37℃和5%CO2条件下培养。转染前24 h用2.5 g/L胰蛋白酶消化人HepG2细胞,具体操作按Invitrogen公司转染试剂盒Lipofectamin2000操作说明书进行。
1.2.4 蛋白印记试验检测CD147基因表达
用蛋白裂解液RIPA裂解HepG2细胞,测定蛋白浓度,行10%聚丙烯酰胺凝胶电泳,然后将蛋白转印至硝酸纤维素膜,10%BSA血清封闭液中封闭1 h,然后鼠抗人-CD147单克隆抗体(1∶500)4℃孵育过夜,TBST液清洗3次,每次10 min,而后再与辣根过氧化物酶标记的羊抗鼠抗体(1∶5 000)室温孵育2 h,在暗室中,采用化学发光反应试剂盒进行发光,暗室曝光。
1.2.5 MTT 法测定细胞活性
取对数生长的稳定转染细胞的各组细胞,每孔按浓度为5×103个/mL接种于96孔培养板上,接种后48 h,用MTT法分别测定每孔光密度,各组细胞均设6个复孔,取平均值计算细胞活性。
1.2.6 流式细胞仪检测细胞凋亡
转染后的肝癌细胞加入培养缓冲液,按Immuno-tech公司的说明书进行,1×106个/mL细胞用冰PBS液洗2次,调整细胞浓度为 1×106个 /mL,加 5 μL Annexin V 液(1∶10稀释)和 5 μL 碘化丙锭(250 μg/mL 于 490 μL 细胞悬液中,冰浴放置 10 min,用流式细胞仪分析细胞凋亡情况。
1.3 统计学处理
2 结果
2.1 重组载体的鉴定
结果见图1。采用HindⅢ和BamHⅠ双酶切重组载体,12%聚丙烯酰胺凝胶垂直电泳,可见55 bp处有明显条带(图1 A),相应部位测序后证实碱基序列和设计序列一致(图1 B),表明载体构建正确。
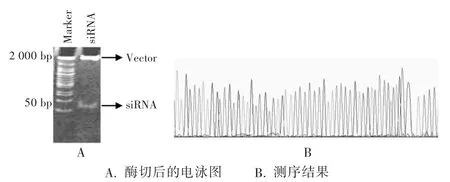
图1 限制性内切酶鉴定CD147/siRNA重组表达载体及重组质粒测序
2.2 siRNA对CD147蛋白表达的影响
结果见图2。稳定转染后,siRNA组表达量明显下降,但未处理的HepG2组及转化的空质粒组表达量无明显变化。

图2 各位细胞中CD147蛋白表达情况
2.3 MTT法检测各组细胞活性
结果见图3。siRNA组细胞生长受到明显影响 (P<0.05),空白对照组及空质粒之间细胞增殖情况无显著性差异(P >0.05)。
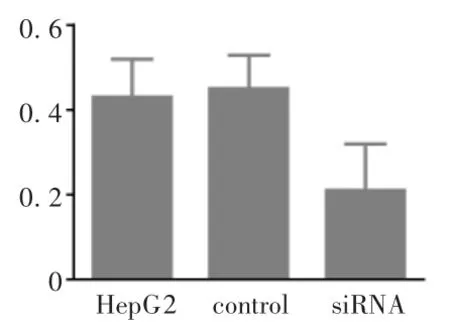
图3 MTT法检测48 h后各组细胞活性
2.4 细胞凋亡检测结果
转染siRNA组的细胞的凋亡率显著增加(14.85 ±1.35)%,与未转组(4.51±0.36)%、转染空 siRNA 载体组(6.13% ±0.71)%比较,差异有显著性(P<0.05),说明沉默CD147基因表达可增加细胞的凋亡。
3 讨论
RNA干扰(RNA interference,RNAi)是由双链RNA(double stranded RNA,dsRNA)所引起的序列特异性基因沉默,siRNA是21-23 nt小片段双链RNA,可以特异性和互补靶基因mRNA序列结合,诱导其降解,产生强大的RNA干扰效应[1-2]。siRNA与靶序列之间严格的碱基配对,具有很强的特异性,它可以在染色质水平、转录水平、转录后水平和翻译水平中参与基因表达的调节。尽管RNAi的效果看似和靶序列与siRNA的结合性有关,但目前并没有可靠的方法来预判或鉴别RNAi的理想靶序列[3]。有报道指出,化学合成和载体介导的siRNA在哺乳动物细胞,包括恶性肿瘤细胞中都能成功地沉默特定的基因[4]。
Biswas等[5]将CD147分子纯化后,发现CD147能体外诱导成纤维细胞合成 MMP-1,MMP-2,MMP-3。随后对 CD147研究发现,在骨巨细胞瘤、泌尿系肿瘤、肺癌、乳腺癌、结直肠癌、口腔鳞状细胞癌、神经胶质瘤、成釉细胞癌、子宫内膜癌、骨髓癌、皮肤基底细胞癌、黑色素瘤、皮肤鳞状细胞癌等肿瘤细胞中均发现CD147表达升高,同时MMP活性增加,且与肿瘤的浸润和转移相关[6]。在后续的一些研究中,人们发现CD147分子亦可作为评价多种恶性肿瘤预后的一个指标[6],其高表达往往提示肿瘤的预后不良。
肝癌因其恶性程度高、预后差,一直受到人们的关注,其药物治疗已经有了很大的进展[7]。中医药也已有一定作用,但总体效果欠佳[8]。笔者根据美国基因序列数据库中报道的CD147基因核苷酸序列,参考siRNA设计原则设计出了两条针对CD147基因表达的RNAi序列,并成功克隆至载体CD147/siRNA,试验证明它能下调肝癌细胞CD147蛋白的表达,抑制肿瘤细胞的增殖,诱导肝癌细胞的凋亡。提示抑制CD147基因表达,是肝癌治疗的一个靶点,为肝癌的基因治疗提供了可能。
[1]Lopes RB,Gangeswaran R,McNeish IA,et al.Expression of the IAP protein family is dysregulated in pancreatic cancer cells and is important for resistance to chemotherapy[J].Int J Cancer,2007,120(11):2 344-2 352.
[2]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double - stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6 669):806 -811.
[3]Wang J,Barr MM.RNA interference in Caenorhabditis elegans[J].MethodsEnzymol,2005,392(23):36 - 55.
[4]McManus MT,Sharp PA.Gene silencing in mammals by small interfering RNAs[J].Nat Rev Genet,2002,3(10):737 - 747.
[5]Biswas C,Zhang Y,DeCastro R,et al.The human tumor cell- derived collagenase stimulatory factor(renamed EMMPRIN)is a member of the immunoglobulin superfamily[J].Cancer Res,1995,55(2):434 - 439.
[6]Nabeshima K,Iwasaki H,Koga K,et al.Emmprin (basigin/CD147):matrix metalloproteinase modulator and multifunctional cell recognition molecule that plays a critical role in cancer progression[J].Pathol Int,2006,56(7):359 -367.
[7]田学禄.肝癌治疗药物的研究新进展[J].中国药业,2009,18(24):64.
[8]戴德银,李宏斌,彭海波,等.中成药在肝癌放、化疗后的临床应用[J].中国药业,2007,16(13):61 -62.

