肿瘤纳米磁感应治疗技术发展现状
阳兵 张晓冬 唐劲天 、2(审校)
1 福州浩联医疗科技有限公司北京研发中心(北京100085)
2 清华大学工物系医学物理与工程研究所 ( 北京 100084)
0.引言
目前肿瘤的治疗方法主要是手术、放疗和化疗,经过多年的临床应用和技术发展,这三种治疗方法已非常成熟,但其也很难再进一步提高肿瘤治疗的有效率,从根本上改变肿瘤治疗现状,肿瘤治疗技术亟需新的突破。
肿瘤纳米磁感应治疗技术是一种新的肿瘤治疗方法,其基本原理是:以磁性纳米材料做为介质,通过微创手术将其导入肿瘤组织,或通过静脉注射方式进入体内,特异性地与肿瘤细胞结合,磁性纳米材料在交变磁场下升温,从而达到杀伤肿瘤的目的,它具有靶向性高、副作用小、激发免疫、便于联合治疗等优势,有望达到根治肿瘤的效果;美国卫生及人类服务部(HHS)、国立卫生研究院(NIH)、国家癌症中心(NCI) 甚至将肿瘤纳米技术视作“从根本上改变人类诊断、治疗和预防癌症的策略”。
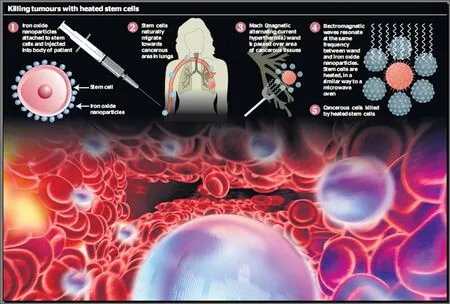
肿瘤纳米磁感应治疗技术的巨大发展潜力得到了世界上几乎所有主要国家的关注,美国、德国、日本、英国、以色列、法国、意大利、俄罗斯和印度等国在此领域进行了大量的研究,取得了很多成果,大大推动了该技术的发展;目前,德国、日本、美国在肿瘤纳米磁感应治疗技术的研究和应用方面走在世界的最前列。
1.德国
德国的肿瘤纳米磁感应治疗技术临床应用走在世界的前列,其最具代表性的就是Magforce公司。德国洪堡大学在1987年开始从事肿瘤纳米磁感应热疗的研究,经过10年的基础研究,1997年成立Magforce公司,专门进行肿瘤纳米磁感应热疗相关技术和产品的开发。Magforce公司采用氨基硅烷修饰的纳米磁流体作为磁感应介质,其具有生物相容性好、便于功能化等优点,下一代磁感应介质-载药纳米磁流体正在研发之中。2003年Magforce公司的纳米磁流体磁感应治疗开始进入临床试验,2009年对脑胶质瘤的临床试验已经完成,即将正式用于临床,目前对前列腺癌[1]的第二部分临床有效性试验正在进行;Magforce公司的肿瘤磁感应治疗系统已获得欧洲药监部门的批准,其股票于2007年在法兰克福正式上市。2010年11月,Magforce公司凭借肿瘤纳米磁感应治疗系统获得了STEP奖。
2.日本
日本是最早进行磁感应治疗临床试验的国家,1990年日本就进行了热籽介导的磁感应治疗恶性胶质瘤一期临床试验。近年来,日本加快了肿瘤磁感应治疗技术的发展,有多家单位先后开展了临床试验,如:2006年进行的食道支架磁感应热疗的临床试验,2007年在日本信州大学进行磁流体热疗临床试验,同年在日本北海道医学院进行磁流体热疗临床试验。在基础研究方面,热与免疫激发一直是日本研究的特色,自发现热的免疫激发效应以来,日本在此领域进行了大量机制研究[2],近年已取得了许多局部性的成果,但还未能全面系统地阐述热激发免疫的机制;此外,日本在功能化介质方面也取得了很大的进展,通过对磁纳米粒子表面进行功能化修饰[3]和电荷改变[4]达到靶向的目的,合成磁纳米复合介质如载药磁性脂质体[5]以进行联合治疗[6]等。
3.美国
美国是实力雄厚的工业国家,在肿瘤磁感应治疗领域也处于领先地位,在1992年就进行了热籽磁感应治疗的临床试验。热籽磁感应治疗联合放化疗是美国磁感应治疗发展的特色,近年随着纳米技术的兴起,纳米磁感应治疗技术在美国也得到极大发展。美国堪萨斯大学将多巴胺甘油醇修饰的纳米四氧化三铁[7]作为介质用于恶心黑色素瘤的治疗,取得了较好的前期结果;此外,美国还对肿瘤磁感应治疗临床应用进行了较为系统的分析,论证了磁感应治疗将会解决许多肿瘤治疗目前存在的问题[8]。2008年,美国Oncologic公司和Triton Bio- -Systems公司合并组成了Aduro BioTech公司,专门从事纳米磁感应治疗技术的研发,期望能在实体瘤治疗技术方面取得突破,但目前还未见其临床试验报道。2010年,达特茅斯大学癌症纳米研究中心获得美国国家癌症中心(NCI)1280万美元的资助,专门用于肿瘤纳米磁感应治疗技术的研发,预期在5年内取得阶段性的成果。
4.英国
有鉴于在过去的30年里,肺癌的存活率并未得到提高,伦敦大学癌症研究中心正致力于开发肿瘤纳米磁感应治疗技术,使之能用于放化疗无效后的肺癌的治疗。由于氧化铁纳米颗粒极易排除体外,英国国家卫生服务机构已经批准将其用于人体,设计采用抗体或骨髓肝细胞与磁性纳米粒子结合以增强磁性纳米粒子与肺癌细胞的亲和性,并采用外部磁靶向技术进一步提高其在肺癌细胞中的聚集程度,在外部交变磁场下使肺癌组织温度上升至42~43℃,从而杀死肺癌细胞。英国研究理事会已经通过给予该项目160万英镑的资助,保障其在3年内完成系统的动物实验,然后进入临床试验,泰晤士报2009年对该项目进行了报道,对其在肺癌治疗中发挥重大作用寄予厚望。
5.以色列
2008年,以色列特拉维夫大学Iddo M.Gescheit等提出了利用磁性纳米粒子对肿瘤进行检测和治疗的研究计划,计划提出采用肿瘤抗体修饰的磁性纳米粒子,采用瘤内直接注射或静脉注射的方法,使之在体内能特异性地与肿瘤细胞结合,在交变磁场下磁性纳米粒子产热,一方面可以通过热成像来确定肿瘤的位置,一方面利用磁性纳米粒子产生的热杀伤肿瘤细胞,达到治疗的目的(Iddo M. Gescheit,Moshe Ben-David, Israel Gannot et al.A Proposed Method for Thermal Specific Bioimaging and Therapy Technique for Diagnosis and Treatment of Malignant Tumors by Using Magnetic Nanoparticles. Advances in Optical Technologies Volume 2008 (2008), Article ID 275080。 7 pages doi:10.1155/2008/ 275080)。该复合磁性纳米粒子已获得美国FDA认可,而且,该复合纳米粒子可根据肿瘤类型的不同改变抗体种类,从理论上适用于所有肿瘤的治疗。目前,该技术正在进行体内实验,有望在2年内进行临床试验,其研究团队认为该技术将成为未来肿瘤治疗的主要手段!
6.中国
我国清华大学、东南大学、上海交大等也正在积极地进行功能化磁纳米粒子的研究。清华大学研制出以叶酸作为靶向基团,磁共振成像及磁感应热疗介质功能为一体的功能磁纳米粒子,并在磁纳米材料的生物安全性、靶向性和疗效等方面做了大量的系统研究。目前,清华大学的磁性纳米材料已进入临床前研究阶段,且清华大学已经研发出了系统的磁感应治疗设备,其第一步以热籽作为介质,以软组织肿瘤作为适应证的磁感应治疗临床试验正在进行,预计下一步将开始以靶向磁流体为介质的肿瘤磁感应治疗临床试验。
在目前肿瘤治疗新技术领域,纳米技术被很多研究者认为是未来攻克癌症难题的希望,肿瘤纳米磁感应治疗率先将纳米技术应用到临床,展现了巨大的潜力。因此,在目前的肿瘤磁感应技术的发展中,纳米介质的研发是各国发展的重点,意大利合成了澡酸盐磁性载药磁性纳米粒子[9],具有生物相容性好、可降解的特点,可用于磁感应热化疗;西班牙合成磁性载药脂质体[10],研究其磁靶向药物传递,局部磁感应热疗和磁共振成像方面的应用。纳米介质的研发朝着生物相容性好,功能化(靶向、成像等[11、12]),自控温[13、14]方向发展。此外,法国和英国[15~17]还发现纳米介质可以进入肿瘤细胞内部,产生细胞内热疗的效果,可在进一步增强疗效的同时降低对正常细胞和组织的损伤,从而降低副作用。新型磁性纳米介质不断出现[18~20],其具有更好的磁学性能和分散性,为肿瘤磁感应技术的进一步发展奠定了基础[21]。可以预见,在不远的未来,纳米磁感应技术将给肿瘤治疗带来革命性的变化[22]。
7.结语
医疗器械产业是一个科技含量高、附加值 高,具有可持续发展潜力的行业,它的发展水平直接反映了一个国家的科技水平,但长期以来,欧美发达国家依靠先发优势几乎垄断了我国乃至世界的高端医疗设备市场,我国的医疗器械行业发展长期在低水平徘徊。肿瘤纳米磁感应治疗是一种全新的肿瘤技术,有望成为未来肿瘤治疗的主流方法,清华大学自主研发的、具有世界先进水平的肿瘤磁感应治疗系统在2010年进入了临床试验,其有可能成为我国医疗器械行业赶超发达国家的一个契机。
[1]Johannsen M, Thiesen B, Wust P et al.Magnetic nanoparticle hyperthermia for prostate cancer. Int J Hyperthermia. 2010 Jul 23. [Epub ahead of print]
[2]Sato A, Tamura Y, Sato N et al.Melanoma-targeted chemo-thermo-immuno (CTI)-therapy using N-propionyl-4-S-cysteaminylphenol-magnetite nanoparticles elicits CTL response via heat shock protein-peptide complex release. Cancer Sci. 2010 May 19. [Epub ahead of print]
[3]Kikumori T, Kobayashi T, Sawaki M et al.Anti-cancer effect of hyperthermia on breast cancer by magnetite nanoparticle-loaded anti-HER2 immunoliposomes. Breast Cancer Res Treat. 2009 Feb;113(3):435-41. Epub 2008 Mar 2.
[4]Kawai N, Futakuchi M, Yoshida T et al.Effect of heat therapy using magnetic nanoparticles conjugated with cationic liposomes on prostate tumor in bone. Prostate. 2008 May 15;68(7):784-92.
[5]Shido Y, Nishida Y, Suzuki Y et al. Targeted hyperthermia using magnetite cationic liposomes and an alternating magnetic f i eld in a mouse osteosarcoma model. J Bone Joint Surg Br. 2010 Apr;92(4):580-5.
[6]Yoshida M, Watanabe Y, Sato M et al.Feasibility of chemohyperthermia with docetaxel-embedded magnetoliposomes as minimally invasive local treatment for cancer. Int J Cancer. 2010 Apr 15;126(8):1955-65.
[7]Balivada S, Rachakatla RS, Wang H et al.A/C magnetic hyperthermia of melanoma mediated by iron(0)/iron oxide core/shell magnetic nanoparticles: a mouse study. BMC Cancer. 2010 Mar 30;10:119.
[8]Salloum M, Ma R, Zhu L.Enhancement in treatment planning for magnetic nanoparticle hyperthermia: optimization of the heat absorption pattern. Int J Hyperthermia. 2009 Jun;25(4):309-21.
[9]Ciofani G, Riggio C, Raffa V et al.A bi-modal approach against cancer: magnetic alginate nanoparticles for combined chemotherapy and hyperthermia. Med Hypotheses. 2009 Jul;73(1):80-2. Epub 2009 Mar 9.
[10] Sabaté R, Barnadas-Rodríguez R, Callejas-Fernández J et al.Preparation and characterization of extruded magnetoliposomes. Int J Pharm. 2008 Jan 22;347(1-2):156-62. Epub 2007 Jul 4.
[11] Xu C, Sun S.Superparamagnetic nanoparticles as targeted probes for diagnostic and therapeutic applications. Dalton Trans. 2009 Aug 7;(29):5583-91. Epub 2009 May 1.
[12] Lacroix LM, Ho D, Sun S.Magnetic nanoparticles as both imaging probes and therapeutic agents. Curr Top Med Chem.2010;10(12):1184-97.
[13] Kaman O, Pollert E, Veverka P et al.Silica encapsulated manganese perovskite nanoparticles for magnetically induced hyperthermia without the risk of overheating. Nanotechnology. 2009 Jul 8;20(27):275610. Epub 2009 Jun 17.
[14] Atsarkin VA, Levkin LV, Posvyanskiy VS et al.Solution to the bioheat equation for hyperthermia with La(1-x)Ag(y)MnO(3-delta) nanoparticles: the effect of temperature autostabilization. Int J Hyperthermia. 2009 May;25(3):240-7.
[15] Wen D. Intracellular hyperthermia: Nanobubbles and their biomedical applications. Int J Hyperthermia. 2009 Nov;25(7):533-41.
[16] Fortin JP, Gazeau F, Wilhelm C.Intracellular heating of living cells through Néel relaxation of magnetic nanoparticles.Eur Biophys J. 2008 Feb;37(2):223-8. Epub 2007 Jul 20.
[17] Wilhelm C, Fortin JP, Gazeau F.Tumour cell toxicity of intracellular hyperthermia mediated by magnetic nanoparticles.J Nanosci Nanotechnol. 2007 Aug;7(8):2933-7.
[18] Martín-Saavedra FM, Ruíz-Hernández E, Boré A et al.Magnetic mesoporous silica spheres for hyperthermia therapy.Acta Biomater. 2010 Jun 30. [Epub ahead of print]
[19] Aguiló-Aguayo N, Inestrosa-Izurieta MJ, García-Céspedes J et al. Morphological and magnetic properties of superparamagnetic carbon-coated Fe nanoparticles produced by arc discharge. J Nanosci Nanotechnol. 2010 Apr;10(4):2646-9.
[20] Li Z, Kawashita M, Araki N et al.Preparation of Magnetic Iron Oxide Nanoparticles for Hyperthermia of Cancer in a FeCl2-NaNO3-NaOH Aqueous System. J Biomater Appl. 2010 Mar 5. [Epub ahead of print]
[21] Lin MM, Kim do K, El Haj AJ et al.Development of superparamagnetic iron oxide nanoparticles (SPIONS) for translation to clinical applications. EEE Trans Nanobioscience. 2008 Dec;7(4):298-305.
[22] Alexiou C, Tietze R, Schreiber E et al.Nanomedicine: Magnetic nanoparticles for drug delivery and hyperthermia - new chances for cancer therapy. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2010 Aug;53(8):839-45

