Ad-VEGF165转基因成纤维细胞修饰的再生丝素膜诱导血管形成效应及其分子机制研究
钱丽娟,刘铁连,张晓峰,谢宇锋,盛伟华,缪竞成,韩亚丽,杨吉成
再生丝素膜是由丝素蛋白经物理或化学方法处理后制成的新型医用生物学材料,其生物安全性好,无细胞毒性[1],对种子细胞遗传学特性无影响[2],对细胞周期和凋亡没有不良影响[3],对机体也不引起炎症反应[4],不引起溶血[5];另外再生丝素膜具有卓越的生物学功能,细胞在丝素材料上能很好的粘附、扩增和增殖[6],利于内皮化形成血管样组织[7],在体内试验中能修复骨缺损[8]和愈合皮肤创伤[9]。机体损伤修复的过程中首先表现为血管形成相关基因的表达,加速微血管的新生,这样才能利于向损伤部位输入所需的各种细胞和营养成分,然后再通过调控组织损伤修复相关基因的表达,促进损伤组织的修复。在血管新生中,血管内皮生长因子(VEGF)及其受体表达被认为是作用最强、特异性最高的关键调控因子[10]。我们课题组前期已经研究了再生丝素膜对pcDNA3.0-VEGF165转染的L929细胞VEGF的表达[11],现又进一步开展了再生丝素膜对 Ad-VEGF165转基因成纤维细胞基因转录表达和鸡胚绒毛尿囊膜(CAM)血管形成实验及诱导兔眼角膜新生血管试验,为试图改良出具有诱导血管生成作用的丝素蛋白材料进行应用基础研究。
1 材料与方法
1.1 材料 WI-38人胚肺成纤维细胞(简称WI-38细胞)、Ad-VEGF165重组腺病毒和Ad-GFP空载体腺病毒由苏州大学提供。再生丝素膜由苏州大学材料工程学院提供,人 VEGF、碱性成纤维生长因子(FGF2)、血小板衍化生长因子(PDGF)ELISA检测试剂盒购自晶美公司,血管生成素-1(Ang-1)ELISA检测试剂盒购自武汉博士德公司。8 d鸡胚购自苏州市孵化场;平阳霉素(PYM)由苏州大学附属第一医院惠赠。新西兰大白兔12只,由苏州大学实验动物中心提供,体重2.0 kg,雌雄不限,眼部无异常。
1.2 方法
1.2.1 Ad-VEGF165感染再生丝素膜上生长的WI-38细胞后形态学观察及目的基因表达的检测 将处于对数生长期的WI-38细胞消化至细胞浓度1×108/L,以1 ml/孔接种于铺有再生丝素膜(SF)的24孔细胞培养板上(SFC组),同时设无丝素膜的细胞对照组(PBS组),于37℃,5%CO2条件下进行细胞培养。24 h后用50 MOI的带绿色荧光蛋白(GFP)基因的重组的腺病毒Ad-VEGF165(Ad-VEGF165组/SFCV组)和空载体腺病毒Ad-GFP腺病毒(Ad-GFP组/SFCG组)分别感染WI-38细胞,每组设3个复孔;未进行感染腺病毒的WI-38细胞作为对照组。细胞培养48 h后,在倒置显微镜及荧光显微镜下观察细胞形态变化并拍照。同时收取各组上清液,按ELISA检测试剂盒说明检测目的基因VEGF165的表达量。
1.2.2 Ad-VEGF165转基因细胞修饰的再生丝素膜的鸡胚绒毛尿囊膜(CAM)血管形成 将孵育8 d的生长状态良好的鸡胚按1.2.1中分组的方法,随机分成Ad-VEGF165组(SFCV组)、Ad-GFP组(SFCG组)、SFC对照组(SFC组),并加设平阳霉素浸泡处理丝素膜的平阳霉素阴性对照组(PYM组),平阳霉素用PBS配置,浓度为10 mg/L,一并进行CAM微血管形成实验。实验时,先用碘酒棉球擦拭鸡胚的气室端蛋壳,并用无菌镊子扎一小孔和撕掉内壳膜,暴露CAM。将上述各组再生丝素膜置于CAM表面的中央,继续孵育3 d后,剪取经丙酮固定的CAM,将其平铺于载玻片上摄像,对血管进行分类,主干血管定为一级血管(class1 BV),主干血管的分支血管定为二级血管(class2 BV),二级血管以下的分支定为三级血管(class3 BV),在丝素膜周围5 mm范围内计算血管数,分析Ad-VEGF165促CAM微血管形成的活性。
1.2.3 兔角膜层间植入转基因细胞修饰的再生丝素膜诱导角膜新生血管形成
1.2.3.1 兔角膜层间植入转基因细胞修饰的再生丝素膜 大白兔肌肉注射苯巴比妥8 mg/kg和氯丙嗪12.5 mg/kg全身麻醉,兔眼周擦拭安尔碘消毒,每只眼滴1~2滴倍诺喜表面麻醉,置开睑器,用庆大霉素注射液冲洗双眼结膜囊。在角膜缘“L”形切开5 mm×4 mm,1/2角膜厚度,将4 mm×3 mm植入物埋入角膜层间,将新西兰大白兔按1.2.1中分组的方法分为 Ad-VEGF165组(SFCV组)、Ad-GFP组(SFCG组)、SFC对照组(SFC组),及再生丝素膜组空白对照组(SF组),每组为3只动物,每只动物双眼均植入上述再生丝素膜,角膜切口缝合3针,术毕涂红霉素眼膏抗感染1次,不进行任何药物治疗。
1.2.3.2 角膜新生血管测量 兔角膜层间植入再生丝素膜后第1周、2周和4周分别照相记录角膜新生血管形成情况。角膜新生血管生长面积计算按Robert电脑数学模型公式计算:C/12×3.1416[r2-(r-l)2]。其中C为发生新生血管的角膜圆周钟点数,r为角膜半径,l为血管长度。
1.2.4 再生丝素膜上Ad-VEGF165转基因WI-38细胞的细胞因子分泌水平 收获培养48 h的上述各组细胞培养的上清液,按ELISA检测试剂盒说明测定 Ang-1、FGF2、PDGF 的含量。
1.3 统计学处理 用SAS软件对所有实验数据进行统计学处理,所有数据用均数±标准差表示,多组间均数比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 再生丝素膜上WI-38细胞形态学观察及目的基因检测 SFC组和PBS组WI-38细胞贴壁生长情况均为良好(图1)。SFC组及PBS组感染腺病毒Ad-VEGF165、Ad-GFP的WI-38细胞在荧光显微镜下可见GFP表达的绿色强荧光,而两组中未感染腺病毒的对照细胞则无荧光。再生丝素膜对腺病毒载体转基因细胞生长未见不良作用。
ELISA法测定各组细胞培养上清液中的VEGF含量。对照组与Ad-GFP组(SFCG组)中WI-38细胞能自分泌低水平的VEGF因子,但Ad-VEGF165组(SFCV组)中WI-38细胞VEGF因子表达水平较对照组和Ad-GFP组显著增高(P<0.05);而且SFC组与PBS组一样均可高水平表达VEGF细胞因子,因此Ad-VEGF165感染WI-38细胞后,能使目的基因VEGF获得了高水平表达(图2)。
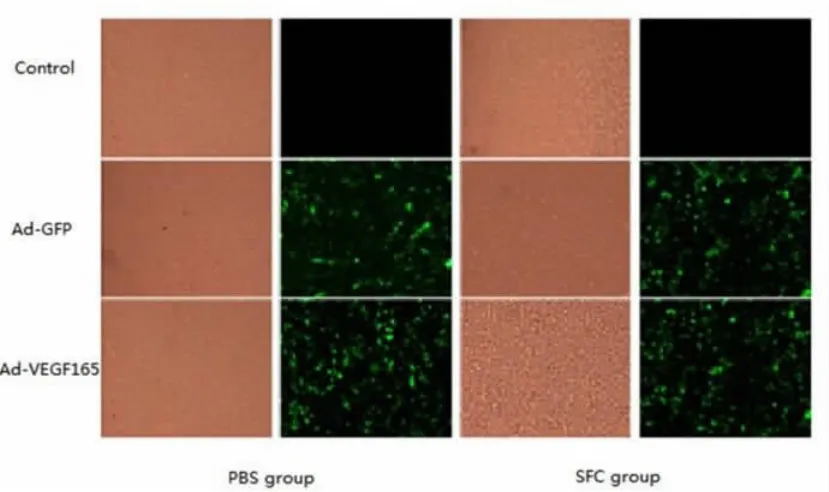
图1 Ad-VEGF165感染WI-38细胞光镜和荧光照片
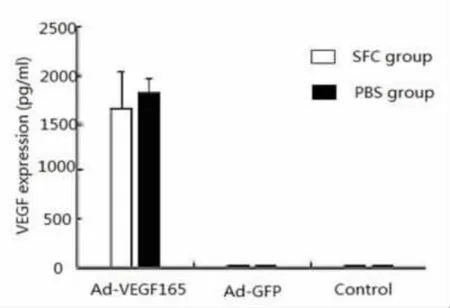
图2 Ad-VEGF165感染WI-38细胞后目的基因VEGF表达水平
2.2 Ad-VEGF165转基因WI-38细胞修饰的再生丝素膜促CAM血管形成活性 经Ad-VEGF165转基因WI-38细胞修饰的再生丝素膜的SCFV组较SFCG组和SFC组CAM毛细血管生长更旺盛、更丰富,呈弥漫状、放射状血管形成,尤以3级血管形成数更为显著(P<0.05)。而PYM组血管形成受到了抑制;SFCG组与SFC组比较无差别。用VEGF165基因重组腺病毒转基因WI-38细胞修饰的再生丝素膜可显著促进CAM毛细血管形成(图3)。
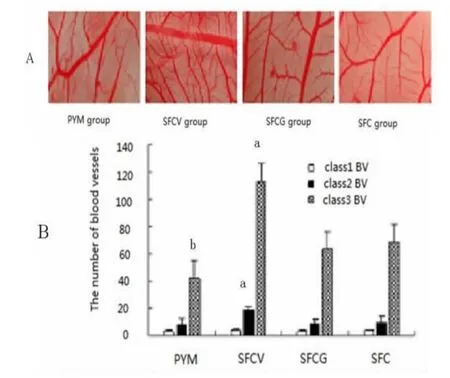
图3 转基因WI-38细胞修饰的再生丝素膜促CAM血管形成活性(A:Ad-VEGF165转基因WI-38细胞修饰的再生丝素膜对CAM血管的影响;B:Ad-VEGF165转基因WI-38细胞修饰的再生丝素膜的CAM血管形成数;SFCV组的CAM血管形成数与SFC组,SFG组,PYM组比较,aP<0.05;PYM组分别与SFCV组,SFC组,SFCG组比较,bP<0.05;Class1 BV:1级血管;Class2 BV:2级血管;Class3 BV:3级血管)
2.3 转基因细胞修饰的再生丝素膜兔角膜层间植入诱导角膜新生血管试验 兔角膜层间植入丝素膜SF组1 w后结膜充血,2 w后结膜充血减轻,4 w后结膜充血完全消退,未见长入角膜内的新生血管;SFC组和SFG组植入1 w后角膜缘附近结膜充血、血管怒张,可见毛刷样新生血管长入角膜内,新生血管短小、稀疏;2 w后结膜充血减轻,可见角膜新生血管已延伸至瞳孔缘,4 w后结膜充血消退,角膜新生血管变细,缩短;SFCV组血管粗乱、密集成堆,不易分辨,尤以第2 w新生血管大量增多,且角膜水肿重,4 w后角膜新生血管同样变细,缩短(图4)。由此可见转VEGF基因细胞修饰的再生丝素膜具有诱导角膜血管形成活性,并且不引起严重的眼内炎症反应,对角膜无破坏性,角膜新生血管会逐渐消退。
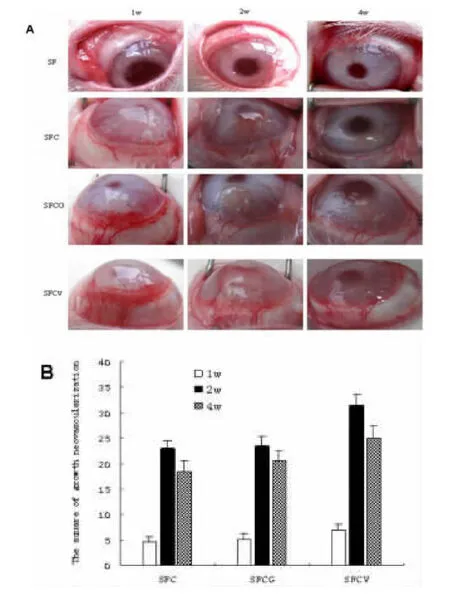
图4 兔角膜层间植入转基因细胞修饰的再生丝素膜诱导角膜新生血管试验(A:兔角膜层间植入转基因细胞修饰的再生丝素膜后诱导角膜新生血管照片;B:兔角膜层间植入转基因细胞修饰的再生丝素膜后角膜新生血管面积)
2.4 再生丝素膜上转基因WI-38细胞Ang-1、FGF2、PDGF细胞因子自分泌水平 病毒感染WI-38成纤维细胞48 h后,取各组上清,用ELISA法测定各组细胞培养上清中Ang-1、FGF2、PDGF的含量。对照组与Ad-GFP(SFCG组)组WI-38细胞虽能自分泌较高水平的Ang-1细胞因子,但导入VEGF165基因的WI-38细胞的Ad-VEGF165组各组细胞培养上清中Ang-1细胞因子表达水平比对照组和Ad-GFP(SFC组)组均有更明显的增高(P<0.05)(图5A)。Ad-VEGF165组与对照组、Ad-GFP组一样WI-38细胞均可以自分泌较高水平的FGF2、PDGF细胞因子,并且再生丝素膜对维持各组 WI-38细胞 FGF2、PDGF细胞因子的稳定表达无抑制作用(图5B、5C)。再生丝素膜不仅可以促进细胞自身Ang-1基因的表达和分泌,而且也有利于WI-38细胞自分泌的与血管生成相关和组织损伤恢复相关的FGF2、PDGF细胞因子基因的稳定表达。
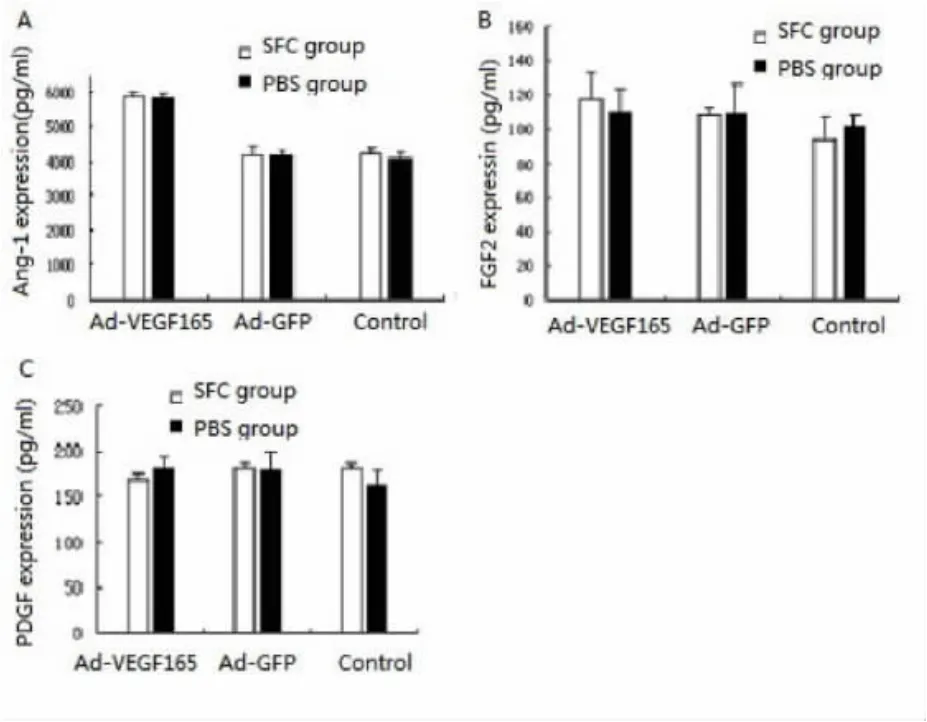
图5 再生丝素膜上腺病毒感染WI-38细胞后Ang-1、FGF2、PDGF的分泌水平(A:再生丝素膜上Ad-VEGF165转基因WI-38细胞的Ang-1的表达水平:分别与对照组、Ad-GFP组比较,aP<0.05;B:再生丝素膜上Ad-VEGF165转基因WI-38细胞的FGF2的表达水平;C:再生丝素膜上Ad-VEGF165转基因WI-38细胞的PDGF的表达水平)
3 讨论
再生丝素膜是一种生物相容性很好的新型医用生物材料,具有无毒性、无刺激性、透湿性好等许多优异性能,因而具有广阔的应用前景,可以用作伤口敷料,也可用作组织修复的支架材料,甚至可以开发成人工皮肤。国内外有大量文献报道证明用丝素蛋白作为添加剂能促进表皮细胞和成纤维细胞的生长,用骨形成蛋白-2(BMP-2)蛋白共价连接到丝素蛋白上能有效地促进骨髓基质细胞向成骨细胞分化等[14]。
本研究表明Ad-VEGF165转基因细胞修饰的再生丝素膜对CAM微血管生成具有明显的促进作用,兔角膜层间植入实验进一步证明Ad-VEGF165转基因细胞修饰的丝素材料具有诱导角膜组织血管生成的功能,这一功能将十分有利于创伤组织的修复。角膜透明,无角化层,无血管,细胞无色素,保证外界光线的透入,因此我们将兔角膜层间植入上述各组再生丝素膜易于观察其血管诱导性。实验结果可见角膜新生血管沿着植入物长入,新生血管的范围可控,不引起严重的眼内炎症反应,不引起角膜穿孔,不引起睑球粘连,稳定、可靠、直观、观察方便,可作为组织工程材料诱导新生血管的动物模型。可以转染特定基因,以表达特定细胞因子的形式调控血管形成,开展新生血管形成的分子机制研究。
皮肤创面修复是一复杂而有序的生理过程。大量研究证明创伤愈合的各个阶段都有细胞生长因子的参与和调控。尤以VEGF、Ang-1、FGF、PDGF对伤口肉芽组织形成、血管增生和胶原纤维合成具有重要作用,是伤口炎症晚期和修复增生期的主要作用因子。肉芽组织是组织修复的中心。而在血管新生中,VEGF及其受体表达被认为是作用最强、特异性最高的关键调控因子。VEGF是血管内皮细胞的特异性有丝分裂原,能刺激血管内皮细胞的分裂增殖和趋化作用,在体外可促进内皮细胞的生长,在体内可以诱导血管发生[15],但单独VEGF作用下往往会导致易渗漏的、不成熟的、不稳定的血管生成。而Ang-1的表达可通过血管改建、塑形,促进形成成熟且有空间结构的血管网[16],本实验发现再生丝素膜利于腺病毒介导的VEGF基因表达并能促进成纤维细胞VEGF和Ang-1的表达,因此VEGF和Ang-1的高表达既有利于相互协调共同促进血管的形成,又可使新生血管获得持久稳定的结构。FGF2是成纤维细胞生长因子,不仅利于损伤组织中成纤维细胞的再生,而且还可以促进新生血管形成,促进血管平滑肌细胞、内皮细胞增生,参与炎症反应和损伤修复。Nissen等[17]收集手术后创口渗液的实验分析表明,FGF2具有内皮细胞趋化性和和促血管发生的能力,由此可见FGF2也是一种血管发生的始动介质。周志钢等[18]在家兔背部皮管模型的组织内分别应用FGF2(实验组)及生理盐水(对照组)对损伤进行组织恢复试验,结果在电镜下观察到实验组皮管内有大量毛细血管呈芽突状生长,显示新生的血管数量明显增多,血管直径明显增大。PDGF能促进成纤维细胞和血管内皮细胞的增殖,导致胶原聚集、大量的毛细血管生成和肉芽组织的产生,对炎性细胞具有强烈的趋化作用。本研究表明再生丝素膜对VEGF转基因的成纤维细胞能维持自身分泌的FGF2、PDGF细胞因子的稳定表达,这对创伤组织的修复是极其有利的。
本课题组通过采用腺病毒为载体的VEGF转基因细胞对丝素蛋白材料进行修饰,将有望研制和开发出利于皮肤创伤恢复和诱导血管形成的基因工程化丝素蛋白材料,同时也为缺血性心血管疾病的临床治疗提供了新的途径及可选择的方法。
[1]盛伟华,龚爱华,李明忠,等.几种丝素材料细胞毒性的实验研究[J]. 中国生物医学工程学报,2005,24(3):277-281.
[2]龚爱华,李明忠,盛伟华,等.再生丝素膜对鼠胚真皮层成纤维细胞遗传特性的影响[J].中国生物医学工程学报,2005,24(1):38-42.
[3]黄泉,杨吉成,缪竞诚,等.再生丝素膜生物相容性的实验研究[J]. 苏州大学学报(工科版),2007,27(2):1-4.
[4]Lorenz M,Sandra H,Vassilis K,et al.The inflammatory responses to silk films in vitro and in vivo[J].Biomaterials,2005,26(2):147-155.
[5]Jinwei G,Xinlin Y,Hesun Z.Surface sulfonation of silk fibroin film by plasma treatment and in vitro antithrombogenicity study[J].Materials Science and Engineering C,2002,20(1-2):199-202.
[6]Byung MM,Lim J,Young SN,et al.Formation of silk fibroin matrices with different texture and its cellular response to normal human keratinocytes[J].Int J Biol Macromol,2004,34(5):281-288.
[7]Ilaria DP,Giuliano F,Jasminka M,et al.De novo engineering of reticular connective tissue in vivo by silk fibroin nonwoven materials[J].Biomaterials,2005,26(14):1987-1999.
[8]Fini M,Motta A,Torricelli P,et al.The healing of confined critical size cancellous defects in the presence of silk fibroin hydrogel[J].Biomaterials,2005,26(17):3527-3536.
[9]Sugihara A,Sugiura K,Morita H,et al.Promotive effects of a silk film on epidermal recovery from full-thickness skin wounds[J].Proc Soc Exp Biol Med,2000,225(1):58-64.
[10]Neufeld G,Cohen T,Gengrinovitch S,et al.Vascular endothelial growth factor(VEGF)and its receptors[J].FASEB J,1999,13(1):9-22.
[11]黄泉,杨吉成,缪竞诚,等.再生丝素膜对VEGF基因转录表达影响的实验研究[J].生物医学工程学杂志,2009,26(1):110-115.
[12]刘铁连,谢宇锋,杨吉成,等.人血管生成素1和血管内皮生长因子165重组腺病毒载体构建及目的基因表达[J].中国组织工程研究与临床康复,2008,12(41):8103-8106.
[13]Michael WP.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res,2001,29(9):2002-2007.
[14]Karageorgiou V,Meind L,Hofmaim S,et al.Bone morphogenetic protein-2 decordted sick fibroin films induce osteogenic differentiation of human bone marrow stromal cells[J].Journal of Biomedical Materials Research,2004,71A(3):528-537.
[15]Olofsson B,Jeltsch M,Eriksson U,et al.Current biology of VEGFB and VEGF-C[J].Curr Opin Biotechnol,1999,10(6):528-535.
[16]Augustin HG,Breier G.Angiogenesis:molecular mechanisms and functional interactions-2nd Kloster Seeon Meeting of the German Priority Research Grant“Angiogenesis”[C].Thromb Haemost,2003,89(1):190-197.
[17]Nissen NN,Polverini PJ,Koch A E,et al.Vascular endothelial growth factor mediates angiogenic activity during the proliferative phase of wound healing[J].AM J Pathol,1998,152(6):1445-1452.
[18]周志钢,何清濂,张文奎,等.碱性成纤维细胞生长因子(bFGF)促进组织血管形成的研究[J].武警医学,2001,12(1):15-19.
- 中国循证心血管医学杂志的其它文章
- 主动脉内球囊反搏术在急性心肌梗死相关动脉近端病变患者中的应用效果

