幽门螺杆菌抗原基因ureB在乳酸菌中的克隆表达与免疫反应性研究
张小娟,张荣光,段广才,范青堂
2.郑州大学河南省分子医学重点学科开放实验室,郑州450001
幽门螺杆菌抗原基因ureB在乳酸菌中的克隆表达与免疫反应性研究
张小娟1,张荣光2,段广才2,范青堂2
目的 为了开发幽门螺杆菌(Helicobacterpylori,Hp)口服疫苗,将Hp尿素酶B(UreB)在食品级乳酸乳球菌NZ3900菌株中进行表达,并研究其免疫反应性。方法 PCR扩增HpMEL-HP27菌株ureB基因(基因号:FJ436980),将其克隆入大肠杆菌-乳酸乳球菌穿梭质粒pNZ8110中并转化乳酸乳球菌NZ3900;采用正交试验确定目的蛋白表达的适宜条件;应用western-blot鉴定其免疫反应性。结果 成功扩增了HpMEL-HP27菌株ureB基因,构建了ureB基因的乳酸菌NICE(Nisin-controlled expression)原核表达系统;UreB蛋白适宜的表达条件为:在ureB重组菌生长至对数生长前期(OD600≈0.3~0.4)加入终浓度为40ng/mL的nisin,诱导表达5h,可溶性UreB蛋白表达量最高,可达27.26μg/mL培养基。可溶性UreB蛋白的表达占上清蛋白的比例最高可达20.19%;Western-blot结果显示乳酸乳球菌表达的UreB抗原蛋白具有良好的免疫反应性。结论 结果提示应用乳酸乳球菌构建幽门螺杆菌食品级疫苗可能具有较好前景。
幽门螺杆菌;乳酸乳球菌;NICE;UreB
2.郑州大学河南省分子医学重点学科开放实验室,郑州450001
幽门螺杆菌(Helicobacterpylori,Hp)是一种革兰氏阴性螺旋杆菌,能够导致胃炎、胃和十二指肠溃疡、胃黏膜相关淋巴瘤和胃癌[1-3]。1994年,Hp被世界卫生组织(WHO)列为Ⅰ类致癌原。此外,Hp还与糖尿病、冠心病、血小板减少性紫癜等一些肠道外疾病有重要关系[4-6]。目前Hp感染的主要治疗方案是联合应用质子泵抑制剂、铋剂和抗生素的三联疗法,杀灭细菌效率超过90%。但是,这种治疗方案仍存在以下问题:药物疗法副作用较多,如口腔异味、腹痛、恶心、呕吐等;抗生素耐药菌株的不断增多;对于发展中国家感染人群来说治疗费用相对昂贵等[7-8]。免疫接种有望成为预防Hp感染最有效最经济的方法。
乳酸乳球菌(Lactococcuslactis,L.lactis)是一种革兰氏阳性非致病性食品级细菌,通常被认为是安全的(Generallyrecognizedassafe,GRAS),已经在乳制品发酵工业方面应用上千年。由于其基因可获得性和易操作性,乳酸乳球菌已经被广泛用作外源蛋白表达的活菌载体。多个研究小组报告了用乳酸乳球菌表达细菌或病毒抗原基因,如:布鲁氏杆菌L7/L12抗原,破伤风毒素C片段,白细胞介素2等[9-11]。为了开发幽门螺杆菌的食品级口服疫苗,本实验PCR扩增了HpMEL-HP27ureB基因。有文献报道,翻译融合表达较转录融合表达具有更高的表达活性[12]。为构建ureB基因的翻译融合表达系统,利用nisA启动子NcoⅠ酶切位点上的ATG作为起始密码子,使插入的目的基因与启动子nisA的SD(核糖体结合位点)区构成翻译融合,为进一步的抗原基因高效表达奠定基础,故在引物设计中在上游引物中引入6个碱基atgggc。将经过菌液PCR和质粒双酶切鉴定后的ureB基因克隆入乳酸乳球菌NZ3900菌株构建工程菌株NZ3900/pNZ8110-ureB,诱导重组蛋白表达,并鉴定其免疫反应性。
1 材料和方法
1.1 菌株和质粒 MEL-HP27菌株为本教研室保存,分离自郑州慢性浅表型萎缩性胃炎病人。乳酸乳球菌NZ3900菌株和质粒pNZ8110购自荷兰NIZO食品研究所。重组工程菌株TB1/pMAL-c2X-ureB为代丽萍博士构建。大肠杆菌 MC1061为中国疾病预防控制传染病所阚彪博士惠赠。
1.2 菌株生长条件 乳酸乳球菌NZ3900生长在添加0.5% 葡萄糖的M17培养基中,30℃静止培养。大肠杆菌MC1061生长在LB培养基中,37℃震荡培养。
1.3 主要仪器和试剂 台式高速离心机(德国Heraeus公司);U-2001型紫外可见分光光度计(日本HITACHI公司);温度梯度基因扩增仪(德国Biomtre公司);凝胶图像分析仪(美国Syngene公司);超纯水系统(美国 Millipore公司)。PrimeStarTM HS DNA polymerase、T4DNA连接酶及核酸限制性内切酶购自Takara公司;凝胶回收试剂盒购自Axygen生物技术有限公司;M17培养基购自美国Difco公司;其余试剂均为国产或进口分析纯试剂。
1.4 PCR扩增ureB基因 基因扩增引物由北京赛百 盛 公 司 合 成,上 游 引 物 (P1):5’-catgccatgggcatgaaaaagattagcag-3’(NcoI);下游引物(P2):5’-cgctctagactagaaaatgctaaagag-3’(XbaI)。引 物中下划线部分为酶切位点,预期扩增产物长度为1716bp。PCR 循环条件:95℃ 5min;94℃ 1min,55℃1min,72℃3min,共30个循环;72℃10min。1.5 构建 NZ3900/pNZ8110-ureB重组子ureB基因PCR扩增产物经NcoI和与XbaI双酶切后与经过同样双酶切的pNZ8110进行过夜连接,然后用氯化钙法转化大肠杆菌MC1061,转化后的菌液涂于含有10μg/mL氯霉素的LB平板上,37℃恒温箱中培养约40h,挑取单菌落液体培养后进行菌液PCR和质粒双酶切鉴定,同时进行测序鉴定。经过鉴定后的pNZ8110-ureB重组质粒用电转化法转化乳酸菌NZ3900。
1.6 正交试验法优化表达UreB 应用诱导剂Nisin诱导UreB蛋白在乳酸菌重组子中的表达。正交试验采用L25(56)正交表,取 A(诱导剂浓度)、B(诱导时机)、C(诱导时间)3个因素。A因素取20ng/mL、40ng/mL、60ng/mL、80ng/mL、100ng/mL共5个水平,B因素取菌液OD600约0.10~0.15、0.15~0.20、0.20~0.30、0.30~0.40、0.40~0.60共5个水平,C因素取诱导1h、2h、3h、4h、5h共5个水平,对UreB蛋白在乳酸菌重组子中的表达条件进行优化。
1.7 小鼠抗血清制备 取活化的TB1/pMAL-c2X-ureB工程菌种子,以1%比例接种于200mL含100μg/mL氨苄青霉素的LB液体培养基中,37℃、220r/min振荡培养2h至 OD600约为0.40~0.50时,加入诱导剂IPTG终浓度至0.3mmol/L,继续振荡培养4h。超声破碎离心取上清,直链淀粉树脂亲和层析柱分离纯化MBP-UreB融合蛋白。调整纯化 MBP-UreB融合蛋白浓度为0.2μg/μL后与等体积弗氏完全佐剂混匀进行超声乳化制备初次免疫抗原,于第1周对昆明小鼠进行初次免疫,每只小鼠两只后腿和腹腔注射200μL初次免疫抗原。将浓度为0.2μg/μL的纯化 MBP-UreB融合蛋白与等体积的弗氏不完全佐剂混匀进行超声乳化制备加强免疫抗原,于第2周、第3周、第4周以同样的方式注射加强免疫抗原各1次。最后1次免疫后1周,摘眼球取血,分离血清,-20℃保存备用。抗体滴度应用间接酶联免疫吸附法(ELISA)测定。
1.8 乳酸乳球菌工程菌表达的UreB蛋白免疫反应性研究 经诱导表达UreB蛋白的乳酸乳球菌工程菌超声破碎后取上清进行12%SDS-PAGE凝胶电泳,用Bio-Rad半干式电转印仪转膜,电压20V,电转40min。封闭后将NC膜置于用封闭液1∶100稀释的小鼠抗血清中,37℃轻摇孵育1~2h。PBS和TBST各洗3次后将膜置于用含5% (W/V)脱脂奶粉的TBS稀释的第二抗体中,37℃作用1~2h,TBST洗3次,每次10min。然后将膜放入平皿中,加入1mL新鲜配置的增强型辣根过氧化物酶标记的DAB显色液,轻轻振摇,直至显色充分,用去离水漂洗,终止显色,将膜转入PBS中,照相保存。
2 结 果
2.1ureB基因的PCR扩增结果 提取 MELHP27菌株的染色体DNA后,应用高保真DNA聚合酶PCR扩增ureB基因片段,PCR产物行1%琼脂糖凝胶电泳,结果显示扩增出长度为1 716bp的ureB特异性片段(图1)。
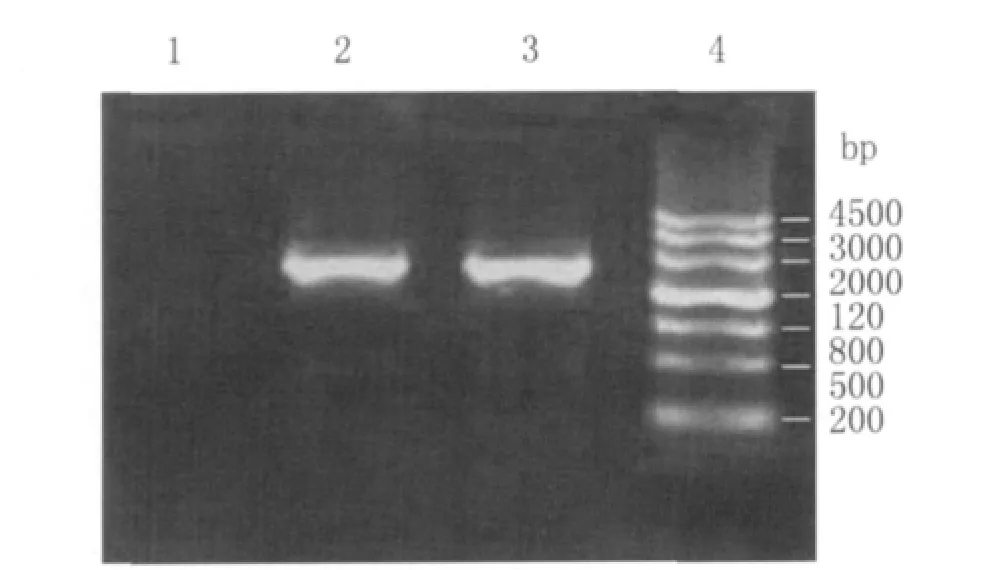
图1 PCR扩增ureB基因产物琼脂糖凝胶电泳分析Fig.1 Polymerase chain reaction (PCR)products of the MEL-Hp27ureB gene.
2.2ureB基因的序列测定结果ureB基因的序列测定结果经过与GenBank上公布的Hp-MEL27ureB基因进行BLAST比对,除了添加的的atgggc 6个碱基(加下划线部分)外,基因序列完全一致,进一步证实pMD19-T-ureB重组克隆质粒构建成功,见图2。
2.3 菌液PCR鉴定 MC1061/pNZ8110-ureB重组子 从转化板上挑取单菌落过夜摇菌后,50μL PCR反应体系取5μL菌液为模板,以P1、P2引物做特异PCR鉴定,扩增出1 716bp片段,与预期结果一致(图3)。
2.4 质粒双酶切鉴定 MC1061/pNZ8110-ureB重组子 取经过菌液PCR鉴定为阳性的MC1061/pNZ8110-ureB重组子单菌落增菌液,碱裂解法抽提质粒,用XbaⅠ单酶切和NcoⅠ、XbaⅠ双酶切进行酶切鉴定。酶切产物行1%琼脂糖电泳。结果显示:单酶切产物片段长度和双酶切产物片段长度均与预期结果一致,证实 MC1061/pNZ8110-ureB重组子构建成功(图4)。

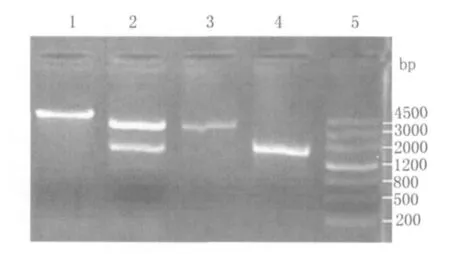
图4 质粒双酶切鉴定MC1061/pNZ8110-ureB重组子Fig.4 Identification of the recombinant MC1061/pNZ8110-ureBby restriction enzyme digestion.
2.5 正交试验法优化UreB表达 经过对诱导剂浓度、诱导时机、诱导时间3个因素及其5个不同水平进行蛋白诱导表达条件优化,得出了UreB蛋白适宜的表达条件:在ureB重组菌生长至对数生长前期(OD600≈0.3~0.4)加入终浓度为40ng/mL的nisin,诱导表达5h,可溶性 UreB蛋白最高可达27.26μg/mL培养基。可溶性UreB蛋白的表达占上清蛋白的比例最高可达20.19%。
2.6 小鼠抗血清滴度ELISA测定结果 鼠抗UreB免疫血清以1∶50,1∶100,1∶200,1∶400,1∶800,1∶1600,1∶3200,1∶6400稀释后,与稀释至20μg/mL的MBP-UreB融合蛋白进行抗体效价的测定,并以正常小鼠血清作为阴性对照,结果血清抗体效价为1∶800,说明制备的小鼠抗UreB免疫血清具有良好的免疫反应性。
2.7 乳酸菌表达UreB蛋白免疫反应性研究 经诱导的 NZ3900/pNZ8110-ureB工程菌超声破碎后,离心取上清行SDS-PAGE电泳,转膜后 Western-blot鉴定乳酸菌表达UreB蛋白的免疫反应性。结果显示:诱导表达工程菌各孔均出现预期蛋白分子量大小为61.859kD条带,而对照空菌NZ3900无对应条带(图5)。
3 讨 论
Hp是流行最广泛的人类病原体,全世界约有半数人口感染。由于疫苗被认为是防止Hp感染最经济有效的方法,尤其是在发展中国家,因此近年来Hp疫苗的研究成为热点。
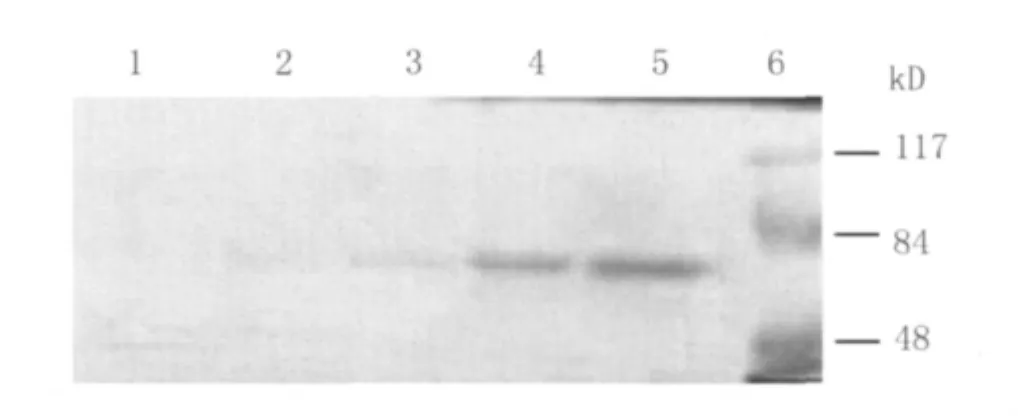
图5 乳酸菌表达UreB蛋白免疫反应性Western-blot鉴定结果Fig.5 Western blot analysis of UreB expressed by Lactococcus lactis transformant with polyclonal anti-UreB serum.
乳酸菌是一种革兰氏阳性食品级细菌,长期以来广泛应用于食品工业以生产发酵乳制品。由于乳酸菌是食品级微生物,其细胞组分或产生的酶可以部分纯化或不需纯化,而直接使用其天然的细胞提取物。以乳酸菌作为活菌疫苗载体在Hp的疫苗研制方面也有应用。孙振璐[13]等在乳酸菌中表达幽门螺杆菌(Hp)黏附素alpA基因,并口服免疫小鼠后检测其免疫原性。结果显示:表达alpA蛋白的乳酸菌口服免疫小鼠后,能够刺激小鼠产生特异的IgG和IgA,可作为幽门螺杆菌口服疫苗候选抗原,为乳酸菌作为抗原递送载体的研究和Hp口服疫苗的开发提供一定的实验基础。Gong[14]等应用乳酸菌MG1363作为疫苗载体表达HspA,并进行了动物实验以研究其免疫预防作用。将hspA基因克隆入pMG36e质粒转化MG1363,表达的相对分子量为13kD的HspA蛋白可以被HspA抗体血清识别。Kim[15]等应用乳酸菌 MG1363作为疫苗载体表达HpCag12外膜蛋白以研究其口服免疫诱导系统抗Cag12免疫反应。动物实验结果显示:口服免疫表达Cag12外膜蛋白的转化乳酸菌MG1363可以诱导系统的抗Cag12体液免疫反应,这提示表达Cag12外膜蛋白的重组乳酸菌有可能通过口服免疫有效诱导抗Hp的保护性免疫反应。
因此,本研究选用乳酸乳球菌NZ3900与原核表达质粒pNZ8110组成NICE高效诱导表达系统来进行目的蛋白的表达。为了得到较大量的目的蛋白,本研究构建了ureB基因的翻译融合表达系统,将ureB基因插入pNZ8110质粒启动子nisA的SD下游,利用启动子上NcoⅠ酶切位点上的起始密码子作为翻译起始密码子。并进一步采用正交试验对工程菌株NZ3900/pNZ8110-ureB的诱导表达条件进行了初步优化,确定了目的蛋白表达的适宜条件为:在乳酸乳球菌工程菌NZ3900/pNZ8110-ureB生长至OD600为0.3~0.4时加入40ng/mL的nisin诱导5h,可得到 UreB蛋白27.26μg/mL,较之以往报道外源蛋白在乳酸菌中的表达量有明显提高[9,16]。Western-blot结果显示乳酸菌表达的 UreB可被小鼠抗UreB免疫血清识别,说明乳酸菌表达的目的蛋白具有良好的免疫反应性,为进一步的动物学免疫保护性研究的开展奠定了实验基础。
[1]Trajkov D,Stardelova K,Dimitrova M,et al.Helicobacterpyloriand gastric carcinoma[J].Prilozi,2007,28(2):25-38.
[2]Misra V,Misra SP,Singh MK,et al.Prevalence ofH.pyloriin patients with gastric cancer[J].Indian J Pathol Microbiol,2007,50(4):702-707.
[3]Pietroiusti A,Luzzi I,Gomez MJ,et al.Helicobacterpyloriduodenal colonization is a strong risk factor for the development of duodenal ulcer [J].Aliment Pharmacol Ther,2005,21(7):909-915.
[4]Pietroiusti A,Giuliano M,Magrini A,et al.Cytotoxin-associated gene A strains ofHelicobacterpylorirepresent a risk factor for the development of microalbuminuria in type 2diabetes[J].Diabetes Care,2006,29(6):1399-1401.
[5]Aceti A,Are R,Sabino G,et al.Helicobacterpyloriactive infection in patients with acute coronary heart disease[J].J Infect,2004,49(1):8-12.
[6]Wu KS,Hsiao CC,Yu HR,et al.Helicobacterpyloriinfection and childhood idiopathic thrombocytopenic purpura[J].Acta Paediatr Taiwan,2007,48(5):263-266.
[7]Aboderin OA,Abdu AR,Odetoyin B,et al.Antibiotic resistance ofHelicobacterpylorifrom patients in Ile-Ife,South-west,Nigeria[J].Afr Health Sci,2007,7(3):143-147.
[8]Vakil N,Megraud F.Eradication therapy forHelicobacterpylori[J].Gastroenterology,2007,133(3):985-1001.
[9]Ribeiro LA,Azevedo V,Le Loir Y,et al.Production and targe-ting of the Brucella abortus antigen L7/L12inLactococcuslactis:a first step towards food-grade live vaccines against brucellosis[J].Appl Environ Microbiol,2002,68(2):910-916.
[10]Norton PM,Wells JM,Brown HW,et al.Protection against tetanus toxin in mice nasally immunized with recombinantLactococcuslactisexpressing tetanus toxin fragment C[J].Vaccine,1997,15(6-7):616-619.
[11]Fernandez A,Rodriguez JM,Bongaerts RJ,et al.Nisin-con trolled extracellular production of interleukin-2inLactococcus lactisstrains,without the requirement for a signal peptide sequence[J].Appl Environ Microbiol,2007,73(23):7781-7784.
[12]Kato M,Asaka M,Shimizu Y,et al.Relationship betweenHelicobacterpyloriinfection and the prevalence,site and histological type of gastric cancer[J].Aliment Pharmacol Ther,2004,20(Suppl 1):85-89.
[13]孙振璐,毕研伟,白彩明,等.幽门螺杆菌alpA基因在乳酸菌中的表达及免疫原性分析[J].细胞与分子免疫学杂志,2010,3:203-206.
[14]Gong Fang-Hong,He Song,Zhang De-Chun,et al.Expression and antigenicity analysis of hspA gene fromHelicobacter pyloriin Lacto-coccus lactis.[J]Chin J Microecol,2010,22(2):106-109.
[15]Kim SJ,Jun DY,Yang CH,et al.Expression ofHelicobacter pyloricag12gene in Lactococcus lactis MG1363and its oral administration to induce systemic anti-Cag12immune response in mice[J].Applied Microbiology and Biotechnology,2006,72(3):462-470.
[16]Zhou XX,Wang YB,Pan YJ,et al.Nisin-controlled extracellular production of apidaecin in Lactococcus lactis[J].Applied microbiology and biotechnology,2008,78(6):947-953.
Expression ofHelicobacterpyloriureBgene inLactococcuslactisNZ3900and its immunoreactivity
ZHANG Xiao-juan,ZHANG Rong-guang,DUAN Guang-cai,FAN Qing-tang
(PathogenBiologyStaffRoom,HenanUniversityofScienceandTechnology,Luoyang471003,China)
To lay a foundation for the further study ofHplive oral vaccine,Hpurease subunit B(UreB)was expressed in a food-grade delivery vehicle,andLactococcuslactisNZ3900and its immunoreactivity was studied.The UreB gene was amplified from genome DNA ofH.pyloriMEL-Hp27(GenBank accession no.FJ436980)and then cloned into theE.coli-L.lactisshuttle vector pNZ8110and transformed intoE.coliMC1061.The positive recombinant plasmid was electro-transformed intoL.lactisNZ3900.The conditions of UreB expression in theL.lactistransformant were optimized by orthogonal experiment.Western blot was adopted to confirm whether the UreB expressed byL.lactistransformant had immunoreactivity.As a result,the recombinant engineering bacteria has been successfully constructed through DNA recombinant technique,which were identified by specific PCR and restriction enzyme digestion of recombinant plasmids.The 40ng/mL nisin was added into the medium and induced for 5hwhen the recombinant engineering bacteria grew to logarithmic growth phase(OD600≈0.3-0.4).The maximum yield ofUreB was 27.26μg/ml of medium,and the maximum percentage ofUreBin cell extracts of theL.lactistransformant reached its peak at 20.19%.Western blot analysis showed that theUreB protein expressed byL.lactistransformant has favorable immunoreactivity.All these results make an appealing case for construction of the food-grade vaccine forHp.
Helicobacterpylori;Lactococcuslactis;NICE;UreB
R378
A
1002-2694(2011)10-0925-04
段广才,Email:gcduan@public.zz.ha.cn
1.河南科技大学病原生物学教研室,洛阳 471003;
2010-11-12;
2011-03-08

