西瓜化感作用及其化感物质成分分析
郑阳霞 唐海东 李焕秀 贺忠群 秦耀国
(四川农业大学园艺学院,四川雅安 625014)
西瓜〔Citrullus lanatus(Thunb.)Matsum. et Nakai〕是一种严忌重茬的蔬菜,极易发生连作障碍。其原因除了土传病害和土壤理化性状劣变外,自毒作用也是重要的因素之一(喻景权和杜尧舜,2000)。而且自毒作用可协同土传病害发生,导致连作障碍严重发生(喻景权和杜尧舜,2000)。自毒作用是指植物向环境释放某些化学物质而影响自身的生长和发育的化学生态现象和化感作用的表现形式(Singh et al.,1999)。化感物质主要是通过植物地上部的淋溶和挥发、根系的分泌以及植株残体的分解等途径向农业系统中释放,从而影响周围和后茬植物的生长发育(章家恩,2007;覃逸明 等,2009)。目前有关西瓜连作障碍中的自毒作用已有一些报道。王倩(2002)、耿广东等(2005)、杨广超等(2005)证实西瓜根、茎叶残体的水浸提液对西瓜的生长有一定的毒害作用。化感物质广泛存在于植物的各个组织,而且各组织中分布不同。但有关西瓜根、茎叶浸提液以及根系分泌物中化感物质的检测还未见报道,因此有必要深入研究西瓜的化感作用。本试验研究了不同浓度的西瓜根、茎叶水浸提液和根系分泌物对西瓜种子发芽和幼苗生长的影响,并应用气相色谱-质谱仪(GC-MS)检测化学物质,探讨西瓜化感作用的机理,比较西瓜根、茎叶水浸提液及其根系分泌物化感作用的差异,分析其化感物质的种类,为解决生产实践中的西瓜连作障碍提供科学依据。
1 材料与方法
1.1 试验材料
供试西瓜品种为早佳84-24,新疆葡萄瓜果研究开发中心选育。
1.2 试验方法
1.2.1 供试材料的培养 试验在四川农业大学蔬菜基地进行。2010年5月3日播种西瓜,待幼苗长至3~4片叶时移入内径为20 cm的塑料钵中,基质为珍珠岩。每钵定植2株,共15钵。每7 d浇1次Hoagland营养液培养。
1.2.2 根、茎叶水浸提液母液的制备 6月15日将西瓜的根和茎叶用清水洗干净,放在85 ℃的烘箱中杀酶30 min,再在65 ℃下烘干粉碎。分别称取20 g干样放入三角瓶中,加去离子水200 mL,放入超声波振荡仪中提取4 h,滤纸过滤即得浓度为100 g·L-1的水浸提液母液。
1.2.3 根、茎叶化感作用的生物检测 分别将西瓜根和茎叶水浸提液母液用去离子水稀释成2.5、5.0、10.0、20.0 g·L-1进行西瓜种子发芽试验。在直径12 cm的培养皿内铺两层定性滤纸,放入经55 ℃温水浸种的西瓜种子25粒。分别取上述稀释液7 mL加入培养皿中,以加入7 mL去离子水为对照,3次重复。然后置于(25±2)℃人工气候箱中培养。每天补充适量的水分以保持滤纸湿度。每天观察、记录发芽数,连续观察5 d,计算发芽指数(GI)。第5天测定总发芽率。同时各处理随机取样10株,用直尺测量株高、根长,用电子天平称量冠鲜质量、根鲜质量。

式中Gt为第t天的发芽数,Dt为相应的发芽天数。
化感效应分析参照 Willamson和 Richardson(1988)的化感效应指数(RI)进行。当 T≥C时,RI=1-C/T;当T<C时,RI=T/C-1,其中T为测定值,C为对照值。RI值>0时,为促进作用;RI值<0时,为抑制作用,绝对值的大小与作用强度一致。均以 RI作为原始数据,采用DPS软件进行方差分析。
1.2.4 根、茎叶中化学物质的鉴定 分别取西瓜的根和茎叶研碎后的粉末20 g,加入正己烷100 mL,放入超声波振荡仪提取4 h。然后用定量滤纸过滤2次,再用0.45 pm微孔滤膜过滤,收集提取液。最后将提取液在旋转蒸发仪上40 ℃浓缩到2 mL,放入4 ℃冰箱中保存。
应用气相色谱-质谱仪(GC-MS)检测根和茎叶中的化学成分。气相色谱仪:Agilent 6890N;质量选择检测器:Agilent Technologies 5973;分析软件:Agilent Chemstation;色谱柱:30 m×0.25 mm×0.25 μm,HP-5MS毛细管柱。柱箱升温程序:90 ℃(1 min),以10 ℃·min-1升温至240 ℃。载气流速:1.0 mL·min-1(He),进样量为1 μL。离子源:EI;离子源温度:230 ℃;电极电压:1 000 V;四极杆温度:150 ℃,全扫描范围30~600 m·Z-1。通过Agilent Chemstation化学工作站检索Nist标准质谱图库,确定化合物。采用归一法计算各种成分的相对含量。
1.2.5 根系分泌物的收集、浓缩 6月15日将西瓜植株从基质中取出,先后用自来水和去离子水充分清洗附着在根系上的基质。然后将根系放在装有Hoagland营养液的黑色塑料桶中,每桶定植5株。连续通气培养10 d,收集10株。10 d后将西瓜植株小心地从营养液中取出,用定性滤纸过滤营养液,再将营养液以25 mL·min-1的流速经过XAD-4吸附树脂,然后用柱床10倍体积的去离子水多次冲洗柱床(除去营养液成分),再用200 mL正己烷洗脱根系分泌物。最后将正己烷洗脱液在旋转蒸发仪上40 ℃浓缩至1 mL,置于4 ℃冰箱保存备用。
1.2.6 根系分泌物化感作用的生物检测 将西瓜根系分泌物浓缩液分别稀释成2.5、5.0、10.0、20.0 μL·L-1进行生物检测。准确吸取不同浓度的稀释液7 mL,加入铺有滤纸的培养皿中。将培养皿放在50 ℃的烘箱中烘至正己烷完全挥发后加入7 mL去离子水做种子发芽试验。方法同1.2.3。
1.2.7 根系分泌物中化学物质的鉴定 方法同1.2.4。
2 结果与分析
2.1 西瓜根、茎叶水浸提液对西瓜种子发芽和幼苗生长的影响
西瓜根、茎叶水浸提液对西瓜种子发芽和幼苗生长有较大的影响(表1)。与对照相比,西瓜根、茎叶水浸提液的浓度为2.5 g·L-1时,发芽率、发芽指数、株高、根长、冠鲜质量和根鲜质量的化感效应指数(RI)均为正值。当浓度为5.0 g·L-1时,RI值为负值。随着浓度的增加,RI值逐渐降低。根、茎叶水浸提液浓度在20.0 g·L-1时,对西瓜种子发芽和幼苗生长的抑制作用最强,说明西瓜根、茎叶水浸提液对西瓜种子发芽和幼苗生长表现为低浓度促进、高浓度抑制的双重效应。且同一浓度时,多表现为西瓜茎叶水浸提液对西瓜种子发芽和幼苗生长的抑制作用显著大于根系。

表1 西瓜根、茎叶水浸提液对西瓜种子发芽和幼苗生长的影响
2.2 西瓜根系分泌物对西瓜种子发芽和幼苗生长的影响
西瓜根系分泌物对西瓜种子发芽和幼苗生长的影响因浓度而异(表2)。当根系分泌物浓度为2.5 μL·L-1时,对西瓜种子发芽和幼苗生长均表现为促进作用。根系分泌物浓度为5.0 μL·L-1时,开始抑制西瓜种子的发芽和幼苗的生长;随着浓度的升高,抑制程度加大,而且不同浓度之间差异显著。同浓度时,西瓜根系分泌物对西瓜幼苗根部的影响比地上部明显。
2.3 西瓜根、茎叶和根系分泌物中化学物质的鉴定
在西瓜根、茎叶和根系分泌物中共检测出32种化学物质(表3),且以酯类化学物质最多,有14种,推测酯类化学物质可能是西瓜主要的自毒物质。在西瓜根中检测到14种化学物质,茎叶中检测到19种,根系分泌物种检测到22种;而且同种化学物质在西瓜根、茎叶和根系分泌物中的相对含量也不相同。说明西瓜根、茎叶和根系分泌物中化学物质的种类和含量存在差异。
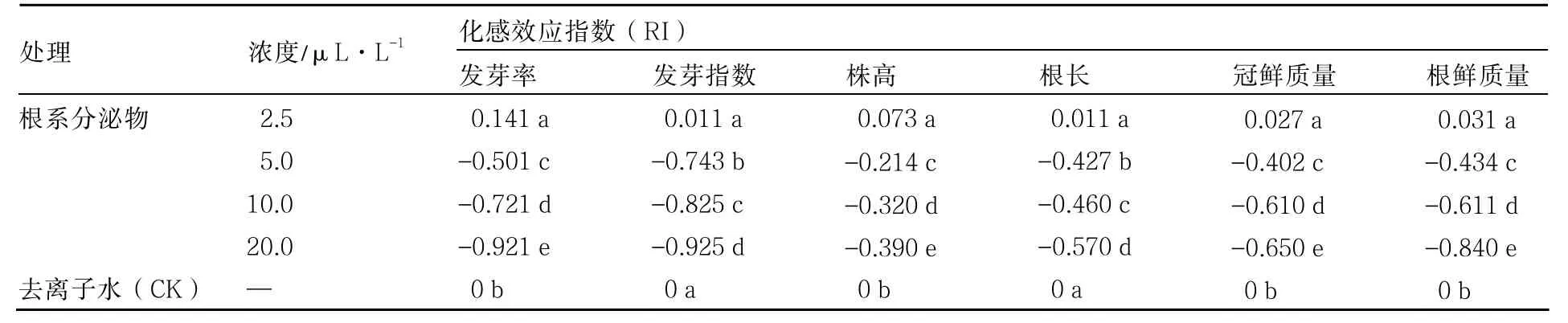
表2 西瓜根系分泌物对西瓜种子发芽和幼苗生长的影响

表3 西瓜根、茎叶和根系分泌中化学物质鉴定结果
3 结论与讨论
3.1 西瓜根、茎叶和根系分泌物的化感效应
本试验结果表明,西瓜根、茎叶水浸提液和根系分泌物对西瓜种子发芽和幼苗生长有较大的影响。低浓度时,促进西瓜种子萌发和幼苗生长;高浓度时,抑制种子萌发和幼苗生长。这与前人的研究结果一致(王倩,2002;耿广东 等,2005;杨广超 等,2005)。西瓜根、茎叶水浸提液浓度在2.5 g·L-1时,促进西瓜种子发芽和幼苗生长;浓度为5.0 g·L-1时,开始表现为抑制作用;且随着浓度增大,抑制作用增强。根系分泌物浓度为 5.0 μL·L-1时,西瓜种子的发芽和幼苗的生长也开始受到抑制。说明西瓜根、茎叶和根系分泌物中存在抑制西瓜种子萌发和幼苗生长的化学物质,具有较强的化感抑制作用。
虽然植物体内含有大量的化感物质,但由于化感物质在植物组织中分布不均衡,导致了各组织化感作用强度不同。苜蓿的根、茎叶、花、种皮均具有化感作用,但以叶片的化感作用最强(Miller,1983;Chung et al.,2000)。辣椒、茄子和棉花的叶片化感效应也大于根系(张启发等,2007;李彦斌 等,2008;王广印 等,2009)。本试验也得出相似的结论,西瓜茎叶的化感作用大于根系。这可能与其根系、茎叶中化感物质组成不同有关。
3.2 西瓜根、茎叶和根系分泌物中的化感物质
植物根、茎叶和根系分泌物中含有许多化学物质,既有化感抑制物质(自毒物质),也有化感促进物质。迄今为止,在西瓜、番茄、黄瓜、辣椒、茄子等蔬菜作物根系分泌物和植物残体中已经分离出苯甲酸、肉桂酸、水杨酸、香草醛等多种自毒物质(Kim,1989;Yu & Matsui,1994;王茹华 等,2006)。本试验从西瓜根、茎叶和根系分泌物中共检测出32种化学物质,其中酯类化学物质最多,有14种;在西瓜根中检测到14种化学物质,茎叶中检测到19种,根系分泌物中检测到22种,其中一些曾被报道为化感物质(韩丽梅 等,2000;何海斌 等,2005;廖薇 等,2006;刘娜 等,2008;耿广东 等,2009)。
近几年有研究证明,脂肪酸酯是一类潜在的化感物质,如邻苯二甲酸二乙酯以及邻苯二甲酸衍生物等(Macias,1995;何海斌 等,2005)。Rumex janonicus是亚热带地区多年生草药,能够分泌邻苯二甲酸二乙酯,对周围植物产生化感作用(Keire et al.,2001)。柴强和冯福学(2007)报道,玉米根系分泌物中的邻苯二甲酸是一种自毒作用较强的化感物质。本试验在西瓜的根、茎叶和根系分泌物中均检测到邻苯二甲酸二辛酯、邻苯二甲酸二异丁酯。至于哪些化感物质是西瓜的主要自毒物质及其作用机理还需进一步探讨。
研究中还发现,西瓜的化感抑制作用存在浓度效应。在同一块土地上,连续种植西瓜,由于其化感物质积累的过多,抑制西瓜生长,造成连作障碍。因此西瓜栽培应避免连作,采用轮作。轮作后土壤微生物活性得到改善,化感物质在较长的时间内挥发、分解或被土壤吸附固定,使自毒物质浓度降低,减轻自毒作用。另外,增施有机肥,可以改善根系分泌物种类,提高土壤微生物活性,促进化感物质的分解。同时建议在西瓜生产中,应及时将西瓜的残株、落叶清理掉,避免其通过淋溶或腐解的形式进入土壤,以减轻化感抑制作用。
柴强,冯福学.2007.玉米根系分泌物的分离鉴定及典型分泌物的化感效应.甘肃农业大学学报,42(5):43-48.
耿广东,程智慧,孟焕文,张素勤,曹红星,赵会芳.2005.西瓜化感作用及其机理研究.果树学报,22(3):247-251.
耿广东,张素勤,程智慧.2009.不同化感物质对番茄根系吸收矿质元素的影响.中国蔬菜,(4):48-51.
韩丽梅,阎飞,王树起,鞠会艳,杨振明,阎吉昌.2000.重迎茬大豆根际土壤有机化合物的初步鉴定及对大豆种子萌发的化感作用.应用生态学报,11(4):582-586.
何海斌,陈祥旭,林瑞余,林文雄,何华勤,贾小丽,熊君,沈荔花,梁义元.2005.化感水稻 PI312777苗期根系分泌物中化学成分分析.应用生态学报,16(12):2383-2388.
李彦斌,刘建国,李凤,刘淑娟,耿伟.2008.棉花植株水浸提液化感效应的研究.中国生态农业学报,16(6):1489-1494.
廖薇,张健,杨婉身,邹平,王晗光.2006.青花椒根际土壤化感物质成分分析.四川农业大学学报,24(1):47-50.
刘娜,周宝利,李轶修,郝晶,付亚文.2008.茄子/番茄嫁接植株根系分泌物对茄子黄萎病菌的化感作用.园艺学报,35(9):1297-1304.
覃逸明,黄雨清,聂刘旺,王千,刘欣,周科.2009.凤丹种胚组培苗的自毒作用研究.核农学报,23(1):75-79.
王广印,韩世栋,谢玉会,孙晓娜,周秀梅.2009.辣椒植株水浸液对辣椒和番茄种子萌发的自毒作用.华北农学报,24(3):123-127.
王倩.2002.西瓜连作障碍中自毒作用及酚酸类物质作用机理的研究〔博士论文〕.北京:中国农业大学.
王茹华,周宝利,张启发,廉华,付亚文.2006.茄子根系分泌物中香草醛和肉桂酸对黄萎病的化感效应.生态学报,26(9):3152-3155.
杨广超,吕卫光,朱静,张春兰.2005.西瓜根、茎、叶浸提液对西瓜种子萌发及幼苗中酶活性的影响.西北农业学报,14(1):46-51.
喻景权,杜尧舜.2000.蔬菜设施栽培可持续发展中的连作障碍问题.沈阳农业大学学报,31(1):124-126.
章家恩.2007.生态学常用试验研究方法与技术.北京:化学工业出版社.
张启发,王茹华,范明珠.2007.茄子自毒作用及控制途径的初步研究.黑龙江八一农垦大学学报,19(5):12-15.
Chung I M,Seigler D,Miller D A,Kyung S H.2000.Autotoxic compounds from fresh alfalfa leaf extracts:identification and biological activity.Journal of Chemical Ecology,26(1):315-327.
Keire D A,Anton P,Faull K F,Ruth E,Walsh J H,Chew P,Quisimoro D,Territo M,Reeve J R.2001.Diethyl phthalate,a chemotactic factor secreted byHelicobacter pylori.The Journal of Biological Chemistry,276:48847-48853.
Kim Y S.1989.Identification and growth inhibition of phytotoxic substances from tomato plant.Korean Joumal of Botany,32(1):41-45.
Macias F A.1995.Allelopathy in search for natural herbicide model.ACS Symposium Series,582:310-329.
Miller D A.1983.Allelopathic effects of alfalfa.Journal of Chemical Ecology,9:1059-1072.
Singh H P,Batish D R,Kohli R K.1999.Autotoxicity:concept,organisms,and ecological significance.Critical Reviews in Plant Sciences,18(6):757-772.
Willamson G B,Richardson D.1988.Bioassays for allelopathy:measuring treatment responses with independent controls.Journal of Chemical Ecology,14(1):181-187.
Yu J Q,Matsui Y.1994.Phytotoxic substances in root exudates of cucumber(Cucumis sativusL.).J Chem Ecol,20(1):21-31.
——以渤海S油田为例

