用于回收废旧锂离子电池中Co(Ⅱ)的2种新型螯合剂的制备及其性能
湛雪辉,周随安,曹芬,李侠,李飞
(长沙理工大学 化学与生物工程学院,湖南 长沙,410076)
废旧锂离子电池的处理问题日益引起研究者的关注。废旧锂离子电池中含有大量的有毒物质,正极中的钴属于稀缺资源,且对水体、生物系统有巨大危害[1−2]。目前,对于废旧离子电池中钴的回收处理方法主要有如下5种:浮选法、沉淀法、螯合法、电还原法以及有机溶剂萃取法[3−6]。以上方法中,螯合法获得了广泛关注。诸多活性官能团因为含有O,N,S和P等官能团,都含有孤对电子能与过渡金属的外层空轨道相结合,形成四配位体或者八配位体而达到络合的效果[7−10]。由于硫原子的特殊结构,一系列含硫原子的螯合剂被用于吸附过渡金属[11]。Atia等[12]使用乙二胺与二硫化碳改性缩水甘油醇−甲基丙烯酸树脂并将其制成钠盐,该树脂对Zn2+,Cd2+和Hg2+显示出良好的吸附性能。本文以对甲基苯硫酚为原料,经过一系列反应合成了4-甲基-2羟基硫酚,并通过正交试验讨论最佳影响因素,考察其对于废旧离子电池浸出液处理效果。对聚苯乙烯在同样的最佳影响因素下进行改性,并用来处理废旧锂离子浸出液中的Co2+。
1 试验方法
1.1 试验药品及仪器
试验仪器为:红外光谱(Nicolet 6700,美国产);原子吸收光谱(岛津AA-6800,日本产);pHS-3C实验室pH计(上海理达仪器厂制造)。
实验药品为:对甲基苯硫酚(购于苏州亚科化学试剂有限公司);聚苯乙烯(购于天津光复精细化工有限公司)。其他化学试剂均购于湖南汇虹试剂有限公司;Co2+浸出液来自于废旧锂离子电池的正极(深圳金积嘉电子工业有限公司生产)。
1.2 废旧锂离子电池中钴的浸出
使用手工方法将废旧锂离子电池破碎,去除塑料与铁皮。之后,使用剪刀将正极切成每块0.6 g,而后量取15 mL二甲基乙酰胺(DMAc)溶解0.6 g正极中的黏结剂,以达到去除Al3+和Cu2+在后续操作过程中的干扰作用。 过滤,使用蒸馏水洗涤沉淀,在60 ℃下真空干燥6 h。用3 mol/L H2SO4与2.4 mol/L H2O2混合溶液浸出钴锂膜,过滤,使用蒸馏水将浸出液稀释至100 mL,待用。
1.3 螯合剂的制备
1.3.1 4-甲基-2-硝基硫酚的合成
将0.62 g对甲基苯硫酚溶于15 mL二氯甲烷、10 mL乙醇混合溶剂,冰浴控制温度为15 ℃左右,在1 h内滴加5 mL浓硫酸与1.92 mL浓硝酸组成混酸并保持温度为15 ℃,继续反应3 h。反应完毕后,将反应液倒入冰水中,分液得到下层黄绿色溶液。减压蒸馏除去二氯甲烷,使用乙醇与水的混合溶液(V(乙醇)/V(水)=1:3)重结晶 2次,得到黄色晶体 4-甲基-2-硝基硫酚。
1.3.2 4-甲基-2-氨基硫酚的合成
在100 mL三口烧瓶中加入9 mL无水乙醇、6 mL蒸馏水的混合溶剂,称取0.62 g锌粉、0.1 g氯化铵置于其中,而后量取0.7 mL冰醋酸与溶液混合。在70 ℃下预蚀1 h,加入0.4 g硝基化合物,升温到80 ℃反应3 h。冷却至室温向溶液中加入1 mol/L的盐酸10 mL得到白色沉淀,过滤。于−40 ℃下冷冻干燥1 h,得到白色产物4-甲基-2-氨基硫酚。
1.3.3 4-甲基-2-羟基硫酚的合成
加入一定量的NaOH于少量水中,而后取0.28 g 4-甲基-2-氨基硫酚置于其中,微热使其充分溶解,最后将不同质量的亚硝酸钠溶于10 mL蒸馏水与溶液混合置于三口烧瓶中,冰浴控温为0~5 ℃。缓慢滴加一定体积的浓度为1 mol/L盐酸,控温在0~5 ℃,继续反应2 h。反应完毕后滴加少量尿素,分解未反应完全的亚硝酸钠。
量取15 mL水置于圆底烧瓶,缓慢滴加3 mL浓硫酸,将溶液加热至沸腾,而后分批加入重氮盐溶液,保持反应液沸腾。将残留的重氮盐晶体缓慢倒入硫酸溶液,控制加入速度,以防止氮气释放速度过快。将反应液倒入盛满冰水的烧杯中,充分搅拌,液体表面有黄色晶体出现。过滤,将所得黄色固体在30 ℃下真空干燥24 h。
1.4 螯合树脂的制备
在三颈烧瓶中,将8 mL氯磺酸溶于15 mL氯仿,而后加入1 g聚苯乙烯,在室温下反应2 h。反应完毕之后,将溶液倒入40 mL丙酮溶液中去除未反应的氯磺酸,过滤,用丙酮溶液洗涤3次沉淀,制得磺酰氯聚苯乙烯。将上一步制得产物置于15 mL三氯甲烷,而后分批加入0.6 g锌粉、2.4 mL DMAc,将溶液加热至60 ℃,而后加入3.6 mL一氯三甲基硅烷,继续反应 4 h。冷却后,将溶液过滤,用蒸馏水洗涤沉淀 3次,于40 ℃真空干燥24 h。
1.5 螯合性能研究
1.5.1 4-甲基-2-羟基硫酚的螯合
称取0.30 g产物置于烧杯中,加入少量蒸馏水,而后称量稍稍过量的氢氧化钠溶于水中,加热搅拌使产物溶于其中。使用稀盐酸和稀氢氧化钠溶液将pH 调节至中性,而后加入5 mL钴离子质量浓度为1 194 mg/L的金属离子溶液,搅拌1 h。过滤,取少部分滤液于西林瓶中,待测。所吸附的钴离子质量根据质量守恒定律进行计算。采用1 mol/L HCl溶液进行解吸附。
1.5.2 螯合树脂的可循环使用
将不同质量的螯合树脂都像 4-甲基-2-羟基硫酚一样制成钠盐,在同样条件下考察其螯合性能以及其可循环使用能力。
2 结果与讨论
2.1 产物的表征
2.1.1 4-甲基-2-羟基硫酚的表征
图1所示为原料对甲基苯硫酚的红外谱图,图2所示为4-甲基-2-羟基苯硫酚的红外谱图。对比图1和图2可看出:在 3 444 cm−1处存在的峰为芳香环上—OH的对称振动峰[13],表明已成功将羟基连接在苯环上。
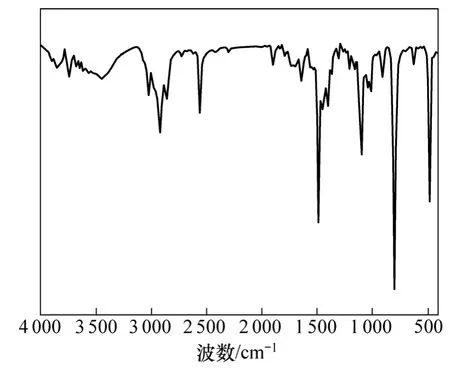
图1 对甲基苯硫酚红外谱图Fig.1 Infrared spectra of P-thiophenol
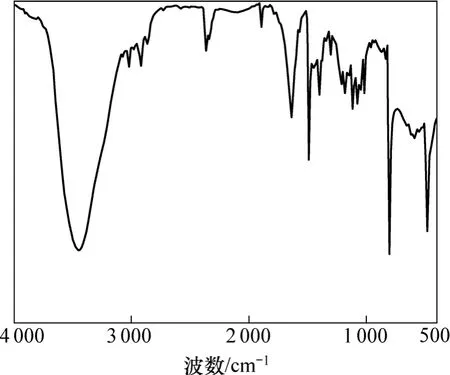
图2 4-甲基-2-羟基苯硫酚红外谱图Fig.2 Infrared spectra of 4-methyl-2-hydroxy-thiophenol
2.1.2 螯合树脂的表征
图3所示为螯合树脂各步反应的红外谱图。从图3可见:聚苯乙烯氯磺化之后,在1 326与1 170 cm−1处出现2个明显的不对称振动峰,并且在还原之后该2处峰都明显地消失[14]。硝化反应将硝基引入树脂,在1 644 cm−1处出现明显的不对称振动峰,在1 170 cm−1处出现明显的对称振动峰,并且在硝基还原之后,该2处峰消失,而在3 439 cm−1处出现明显的NH2的特征峰;重氮化反应之后,该处峰依然很强,而在739 cm−1处C—N特征峰消失,表明羟基以及成功引入至树脂中。
2.2 重氮化实验过程
2.2.1 重氮化正交试验
经过多次实验,发现在重氮化过程中,NaNO2与4-甲基-2-氨基硫酚的物质的量比、重氮化时硫酸的浓度、反应温度是影响重氮化产率的3个因素。通过正交实验L9(33)选出适宜的参数(表1)。
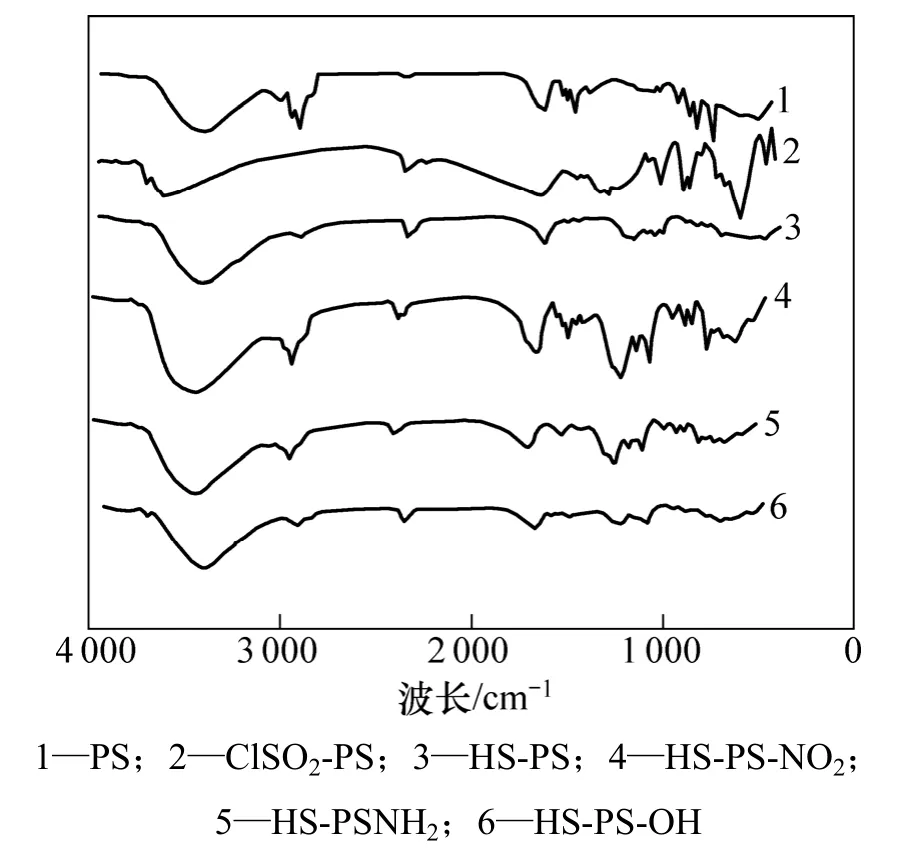
图3 螯合树脂各步反应红外谱图Fig.3 FT-IR of each step of chelating resin
重氮盐水解时,选择4 mol/L的硫酸,将硫酸溶液煮沸,保持温度为15 min,考察重氮化过程,实验结果见表2。
正交化实验结果表明最佳工艺条件如下:NaNO2与4-甲基-2-氨基硫酚的物质的量比为2.10:1,重氮化时硫酸浓度为3.0 mol/L,反应温度为3 ℃。根据极差水平分析可知:重氮化反应时,硫酸浓度的影响最大,其次为温度,NaNO2与4-甲基-2-氨基硫酚的物质的量比影响最小。
游离的氨基化合物、亚硝酸的含量对于重氮化反应影响很大,游离的氨基化合物受酸度影响,易于酸结合成盐,亚硝酸不稳定,易于分解,因此,在重氮化反应中,酸度影响最大;温度可以控制反应活性,增加反应物质间的碰撞概率,同时,温度升高促进新生成的亚硝酸分解。

表1 重氮化L9(33)正交实验因素水平Table1 The level and factor L9(33)of diazo orthogonal experiement
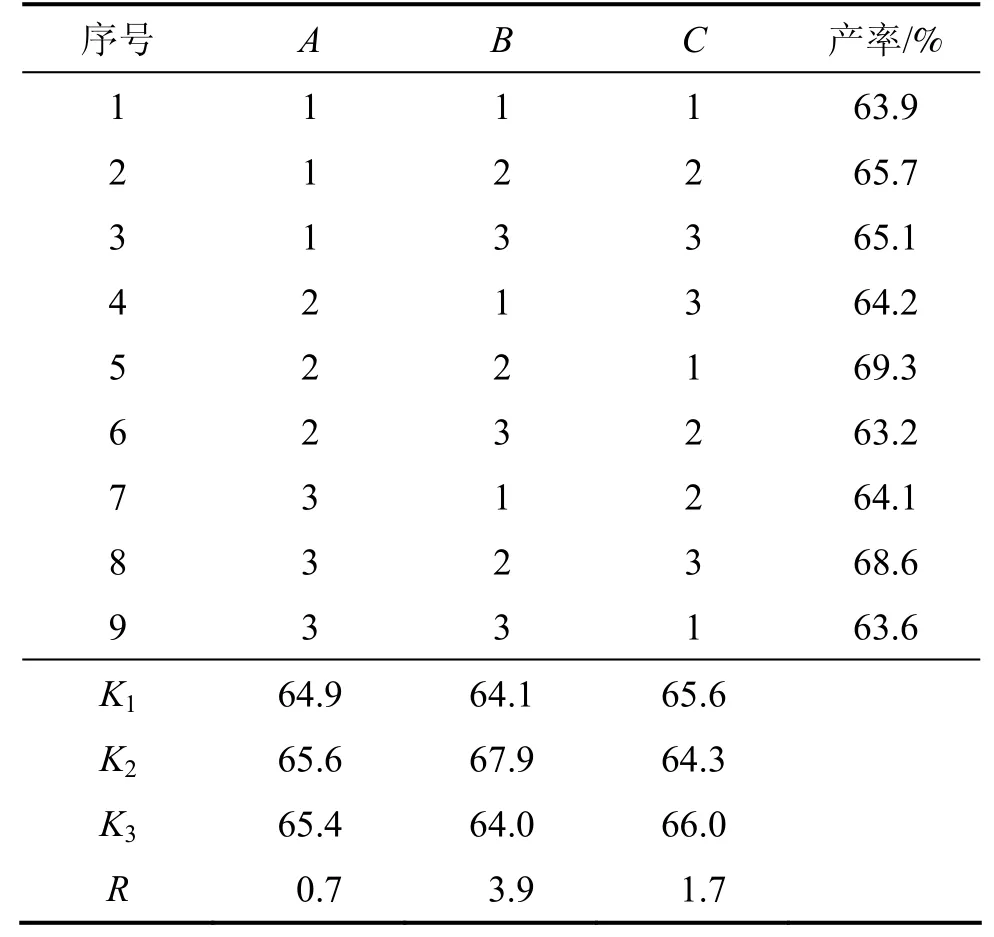
表2 重氮化L9(33)正交实验结果Table1 Result of diazo orthogonal experiment
2.2.2 NaNO2与 4-甲基-2-氨基硫酚的物质的量比对重氮化的影响
为进一步了解 NaNO2与 4-甲基-2-氨基硫酚的物质的量比对重氮化过程的影响,在硫酸浓度、反应温度和水解条件不变的情况下进行实验,结果如图4所示。
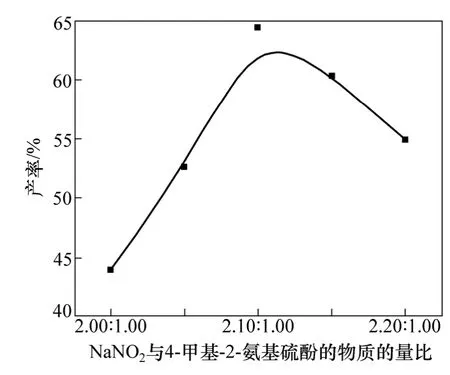
图4 NaNO2与4-甲基-2-氨基硫酚的物质的量比对于产率的影响Fig.4 Influence of proportion of 4-methyl-2-hydroxy-thiophenol on yield
在本实验中由于巯基易与新生成的亚硝酸反应,生成亚硝酰巯基酯[15],此为其中主要的副反应,因此,选择大于2倍氨基化合物的亚硝酸钠反应,考察其对产率的影响。如图4可知:在 NaNO2与 4-甲基-2-氨基硫酚的物质的量比为2.00:1~2.10:1时,随着物质的量比的逐渐增大,产率不断增加;当NaNO2与4-甲基-2-氨基硫酚的物质的量比为2.10:1.00时,产率最大,为 68.4%;继续增加反应物物质的量比,产率下降。这可能是体系中存在大量的亚硝酸,导致副反应的发生。
2.3 水解时硫酸浓度的影响
选择 NaNO2与 4-甲基-2-氨基硫酚的物质的量比为2.10:1.00,硫酸浓度为3 mol/L,反应温度为3 ℃,进行重氮化反应,考察不同浓度的硫酸对水解过程的影响,结果如图5所示。
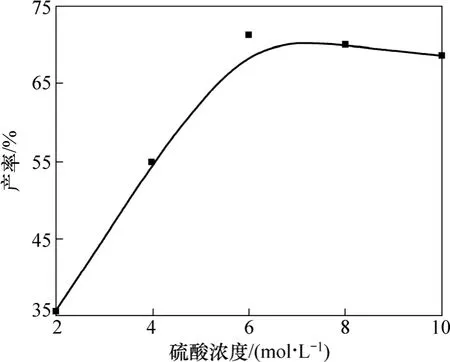
图5 硫酸浓度对水解反应的影响Fig.5 Influence of H2SO4 concentration on hydroxyl
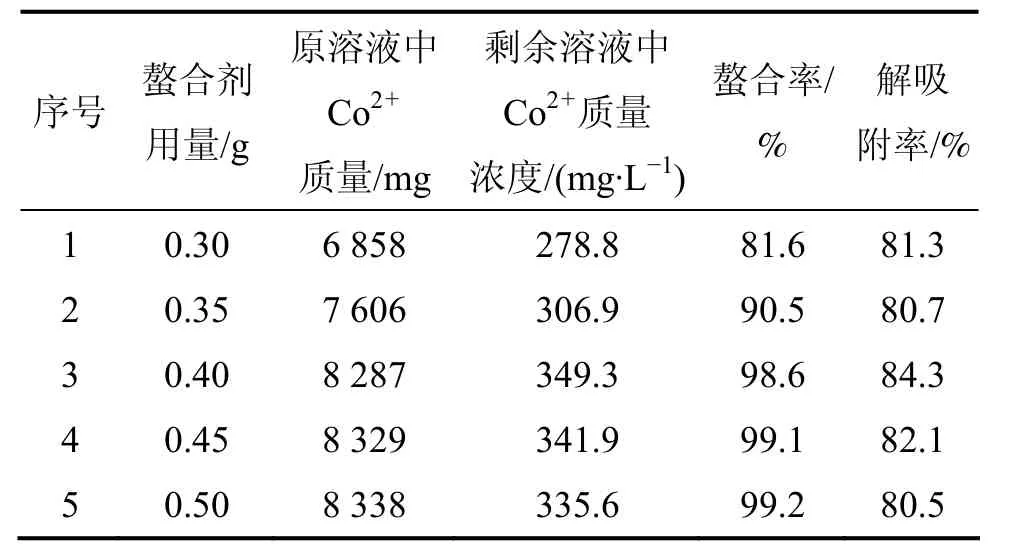
表3 螯合数据Table3 Chelating data
由图5可知:在硫酸浓度为2~4 mol/L时,随着硫酸浓度的增加,产率不断增加;在硫酸浓度为 6 mol/L时,产率最大,为71.2%;继续增加硫酸浓度,产率稍有下降。这是因为重氮盐水解时,重氮正离子是一个弱的亲核试剂,易与活泼的芳香族化合物如酚、芳胺进行反应,发生亲电取代反应生成相应的偶氮化合物。而在强酸溶液中该反应不易发生。
2.4 4-甲基-2-羟基硫酚的性能
选择5 mL质量浓度为1 681 mg/L的钴离子溶液进行吸附,考察不同质量的螯合剂对吸附性能的影响,结果如表3所示。
由表3可知:随着螯合剂的增加,能有效地增加螯合率,Co2+与4-甲基-2-羟基硫酚螯合并且沉淀;当螯合剂质量为0.40 g时,吸附已经趋于平衡,继续增加螯合剂的质量没有太大意义。
使用1 mol/L的盐酸20 mL对螯合物进行解吸附,在室温下搅拌4 h,最大解吸附率达到84.3%。由此可知,由于螯合剂与钴离子弱的键合作用,使用盐酸能够达到较高的解吸附率,回收钴离子的效果最佳。
2.5 树脂的再生
螯合树脂与浸出液中的Co2+作用后,使用7 mol/L的HCl溶液能有效地使螯合树脂再生。将螯合树脂置于其中于室温下搅拌2 h。经过吸附−解吸附循环5次试验后,螯合树脂仍具有最初始的螯合效率。经过10次循环试验后,螯合树脂的螯合率仍超过95%。这表明螯合树脂拥有较强的循环使用能力以及在酸性条件下有很强的稳定性。
3 结论
(1)使用简便方法合成了4-甲基-2-羟基硫酚。最佳反应条件如下:NaNO2与4-甲基-2-氨基硫酚的物质的量比为2.10:1,重氮化时硫酸浓度为3.0 mol/L,反应温度为3 ℃。在此最佳条件下,产率达到69.3%。水解反应时,硫酸浓度为6 mol/L。
(2)通过氯磺化、还原以及以上的最佳影响因素,合成了含有邻羟基硫酚的螯合树脂。
(3)螯合实验在5 mL含有1 681 mg/L的Co2+浸出液中进行。使用0.25 g 4-甲基-2-羟基硫酚可达到吸附平衡,使用 1 mol/L的 HCl溶液能有效地解吸附Co2+。
(4)螯合树脂具有良好的吸附性能。在循环作用10次之后螯合率在95%以上,这为废旧离子电池中贵重金属的回收提供了有效途径。
[1]孙欣, 魏进平, 王晓宇, 等.失效锂离子蓄电池的回收[J].电源技术, 2004, 28(12): 794−797.SUN Xin, WEI Jin-ping, WANG Xiao-yu, et al.Recycling of the used rechargeable lithium ion battery[J].Journal of Power Source, 2004, 28(12): 794−797.
[2]席国喜, 焦玉字, 路迈西.废旧锂离子电池资源化研究现状[J].再生资源与循环经济, 2008, 1(1): 38−41.XI Guo-xi, JIAO Yu-zi, LU Mai-xi.Current study on the recycling methods of spent lithium-ion battery[J].Renewable Re-sources and Recycling Economy, 2008, 1(1): 38−41.
[3]金泳勋.用浮选法从废锂离子电池中回收锂钴氧化物[J].国外金属矿选矿, 2003, 7(9): 32−37.JIN Yong-xun.Recycling of lithium cobalt oxide from spent li-ion batteries by flotation[J].Metallic Ore Dressing Abroad,2003, 7(9): 32−37.
[4]柳建设, 夏海波, 王兆慧.硫化沉淀−混凝法处理氧化钴生产废水[J].中南大学学报: 自然科学版, 2004, 35(4): 941−944.LIU Jian-she, XIA Hai-bo, WANG Zhao-hui.Treatment of waste water from powder blue production with sulphur precipitation-coagulation[J].Journal of Central South University:Science and Technology, 2004, 35(4): 941−944.
[5]Garcia E M, Santos J S, Pereira E C, et al.Electrodeposition of cobalt from spent Li-ion battery cathodes by the electrochemistry quartz crystal microbalance technique[J].Journal of Power Sources, 2008, 185(1): 549−553.
[6]Xiao S J, Liu F Q, Yang X, et al.Adsorption performances and mechanisms of the newly synthesized N,N’-di(carboxymethyl)dithiocarbamate chelating resin toward divalent heavy metal ions from aqueous media[J].Journal of Hazardous Materials, 2009,167: 589−596.
[7]Chanda M, Rempel G L.Polyethyleneimine gel-coat on silica.High uranium capacity and fast kinetics of gel-coated resin[J].Reactive Polymers, 1995, 25(1): 25−36.
[8]WANG Fei, WANG Lian-jun, LI Jian-sheng, et al.Synthesis of modified D401 chelating resin and its adsorption properties of Pb2+[J].J Cent South Univ Technol, 2009, 16: 575−580.
[9]Chen C Y, Chiang C L, Chen C R.Removal of heavy metalions by a chelating resin containing glycine as chelating groups[J].Sep Purif Technol, 2007, 54: 396−403.
[10]Syamal A, Singh M M, Kumar D.Syntheses and characterization of a chelating resin containing ONNO donor quadridentate Schiff base and its coordination complexes with copper(Ⅱ),nickel(Ⅱ), cobalt(Ⅱ), iron(Ⅲ),zinc(Ⅱ), cadmium(Ⅱ),molybdenum(Ⅵ)and uranium(Ⅵ)[J].React Func Polym Sci,1999(39): 27−35.
[11]Rahangdale S S, Zzade A B, Gumule W B.Terpolymer resin Ⅱ:synthesis, characterization, and ion-exchange properties of 2,4-dihydroxyacetophenone−dithiooxamide−formaldehyde terpolymers[J].Journal of Applied Polymer Science, 2008, 108:747−756.
[12]Atia A A, Donia A M, Yousif A M.Synthesis of amine and thio chelating resins and study of their interaction with zinc(II),cadmium(II)and mercury(II)ions in their aqueous solutions[J].Reactive and Functional Polymers, 2003, 56(1): 75−82.
[13]Pretsch E, Buhlamann P, Badertscher M.Structure determination of organic compounds[M].Berlin: Springer, 2009: 288.
[14]Wu E, Carlson R M.Thiolsulfonate functionalized polystyrene resin: Preparation and application in the isolation and identification of electrophilic mutagens[J].Journal of Environment Sciences, 2007(19): 1520−1527.
[15]DONG Xue-chang, ZHANGG Shu-gui, LIU Xiao-fang, et al.Synthesis of new chelating resin containing o-aminobenzoic acid[J].Journal of Yunnan Institute of the Nationalities, 1998,7(1): 39−42.

