PPAR-γ功能的研究进展
徐世文,樱 桃,李 术
(东北农业大学动物医学学院,哈尔滨 150030)
过氧化物酶体增殖物激活受体-γ(Peroxisome proliferator activated receptors-γ,PPAR-γ)是具有多种功能的细胞器,如参与脂肪酸的氧化等。过氧化物酶体功能缺陷可以引起多种疾病。过氧化物酶体能在许多结构不同的化学物质作用下增生,这些物质被称为过氧化物酶体增殖剂(Peroxisome proliferators,PPs)[1]。过氧化物酶体增殖因子活化受体是由Isseman和Green于1990年首先在老鼠身上发现的[2]。PPAR-γ属Ⅱ型核受体超家族成员,主要表达在棕色和白色脂肪组织及小肠组织中,是参与调节糖、脂质代谢的重要因子,具有调控细胞分化、脂肪的储存和调节胰岛素的作用[3],参与炎症、细胞凋亡等病理过程[5]。还有试验显示T、B淋巴细胞中表达PPAR-γ mRNA、PPAR-γ及其相关配体在免疫中起重要作用[6]。此外,研究表明PPAR-γ还跟肿瘤的治疗有关[4]。
1 PPAR-γ的分子结构及其配基
人PPAR-γ基因位于第3号染色体3p25位,鼠PPAR-γ位于第6号染色体E3F1位。人与小鼠PPAR-γ基因全长均大于100 kb,由于启动子和外显子A1、A2及B1拼接方式不同,PPAR-γ mRNA存在4种亚型,即PPAR-γ、PPAR-γ2、PPAR-γ3和PPAR-γ4。其中PPAR-γ1、3、4 mRNA生成相同的产物PPAR-γ;PPAR-γ2 mRNA生成一个NH2端有个28个氨基酸的蛋白质。人PPAR-γ1由477个氨基酸组成,鼠则只有475个,人PPAR-γ1 mRNA的外显子A2与共同外显子1之间拼接,会在相当于其他种属上游6个核苷酸位置,即共同外显子1的起始处产生一个AUG翻译起始密码子,从而导致PPAR-γ1蛋白质的N末端比鼠多两个氨基酸。人PPAR-γ2氨基末端比PPAR-γ1多28个氨基酸,由505个氨基酸组成。鼠PPAR-γ2氨基末端比PPAR-γ1多30个氨基酸。人PPAR-γ3与PPAR-γ1一样由477个氨基酸组成[7]。
PPAR-γ存在多种配体,分为天然配体和合成配体两大类。天然配体主要以多不饱和脂肪酸及其衍生物为代表,如15-脱氧前列腺素J2(15d-PGJ2)及白三烯,来源于饮食及机体的代谢产物。15d-PGJ2是PGJ2的代谢产物,是最先报道的PPAR-γ的配体。研究表明,它是PPAR-γ亲和力最强的内源性配体,它具有抗炎症和抗肿瘤活性的作用。在探寻天然的PPAR-γ配体过程中,发现了合成配体主要有治疗糖尿病的噻唑烷酮类化合物(Thiazolidinediones,TZDs),又称格列酮类,包括罗格列酮、曲格列酮、吡格列酮等。一些非甾体抗炎药物如消炎痛、芬布芬、布洛芬等也能作为配体与PPAR-γ相结合[8]。
2 PPAR-γ的组织分布
在成年动物PPAR-γ在脂肪组织、大肠中表达量较高,肝、心、肾为中等量表达。PPAR-γ1是PPAR-γ的主要形式,PPAR-γ1表达范围相对广泛,PPAR-γ2表达范围较窄,主要在脂肪组织中表达,有研究显示爪蟾PPAR2γ呈限制性表达,与此相似啮齿动物脂肪组织是PPAR-γ主要表达区,肠粘膜(盲肠和结肠)有较高表达,在淋巴组织如脾中含量也很多[9-10]。另外PPAR2γ也低量表达于视网膜和骨骼肌。人类hPPAR-γ1和hPPAR-γ2在脂肪组织表达较高,在骨骼肌表达较低,在肝脏和心脏中也有hPPAR-γ1的表达[11-12]。PPAR-γ3仅在巨噬细胞和大肠中表达[13]。
近几年来,一些学者开始开展了对畜禽PPARs基因在组织中表达情况的研究。在禽类研究表明,PPAR-γ基因几乎在鸡的所有组织中都有表达,如脂肪、脑、肾脏、脾脏、心脏、肺脏、食道、胃(肌胃与腺胃)、肠道(小肠与大肠)、肝脏、骨骼肌及卵巢[14-16],但研究结果并不一致。Sato等研究表明[14],在鸡肝脏与骨骼肌中存在PPAR-γ基因的表达,但Meng等的研究却证实PPAR-γ基因在肝脏与骨骼肌内并不表达[15]。Wang等证实PPAR-γ在鸡脾脏、法氏囊和胸腺均表达[18]。Sundvold等对猪10种组织PPARs的Northern blot检测发现PPAR-γ限制性表达于脂肪组织和脾[17]。
3 不同物种之间PPAR-γ基因编码区核苷酸序列比对分析
利用DNAMAN和DNASTAR软件分析GenBank上人(NM_001172698.1)、熊猫(XM_002921267.1)、牛(NM_181024.2)、兔(U84893.1)、爪蟾(XM_002936698.1)、小鼠 (NM_001127330.1)、野猪(NM_214379.1)、绵羊 (NM_001100921.1)、雁(AF481798.1)和原鸡(AF163811.1)PPAR-γ基因编码区核苷酸序列(见表1)。结果表明,不同物种间PPAR-γ基因编码区相似性百分数有所差异,尤其是爪蟾和其他物种间的差异性很大,在和9个物种比对结果中,与牛的同源性最大,但同源性只有49.3%。其他9个物种差异范围为81.0%~98.4%。其中牛和绵羊的相似性百分数最高为98.4%,其次是雁和原鸡的相似性百分数达97.4%,同源性较高;人与其他8个物种(除爪蟾)间相似性百分数均较高,为85.4%~93.6%。六个哺乳动物物种小鼠、人、猪、绵羊、牛、兔、熊猫之间的CDS区比较结果表明,同源性都在89%以上,而与雁、鸡对比,同源性分别为82.9%和81%。
4 不同物种PPAR-γ氨基酸序列
用DNAMAN对除爪蟾外的9个物种氨基酸序列进行比较,结果(见图1)显示同源性为89.68%。在第162~314位氨基酸同源性最高。在此区域内兔子的第174位为丝氨酸,其他物种的第174位氨基酸都是甘氨酸;雁的第235位氨基酸为脯氨酸而其他物种的均为丝氨酸,除了这两个氨基酸以外其他氨基酸同源性为100%。从结果可推测出这一区域亲水性比较高,有可能存在抗原表位。由图2可知,牛和绵羊PPAR-γ氨基酸同源性高达99.8%;雁和鸡的同源性为98.5%;人和鼠的同源性大98.3%。这表明PPAR-γ基因CDS区是高度保守的序列。
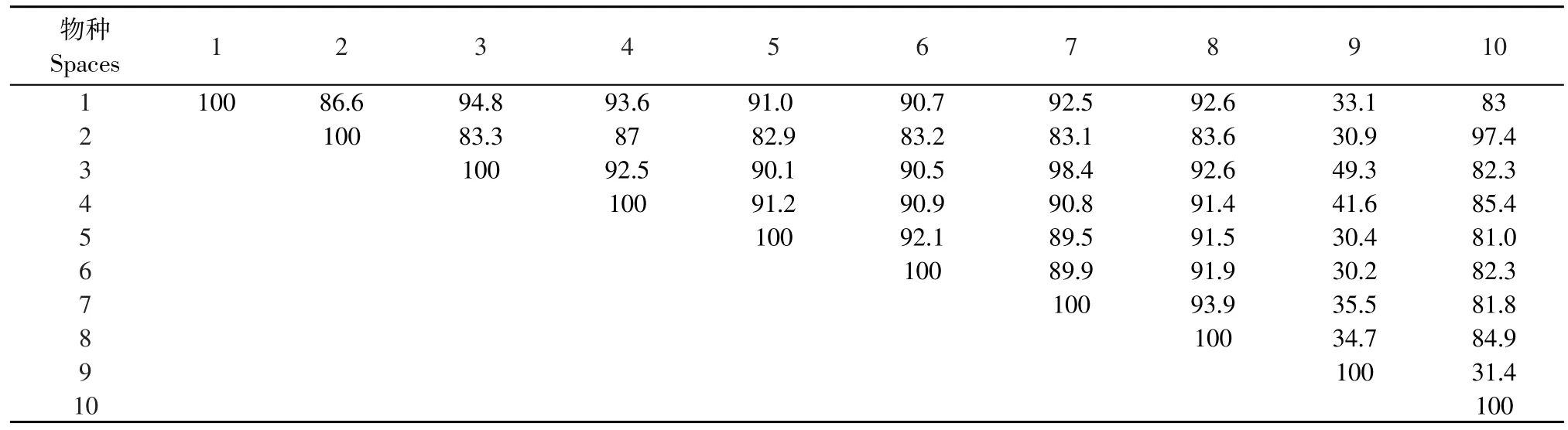
表1 10个物种核苷酸序列的同源性Table 1 Homology of nucleotide sequence among ten species(%)
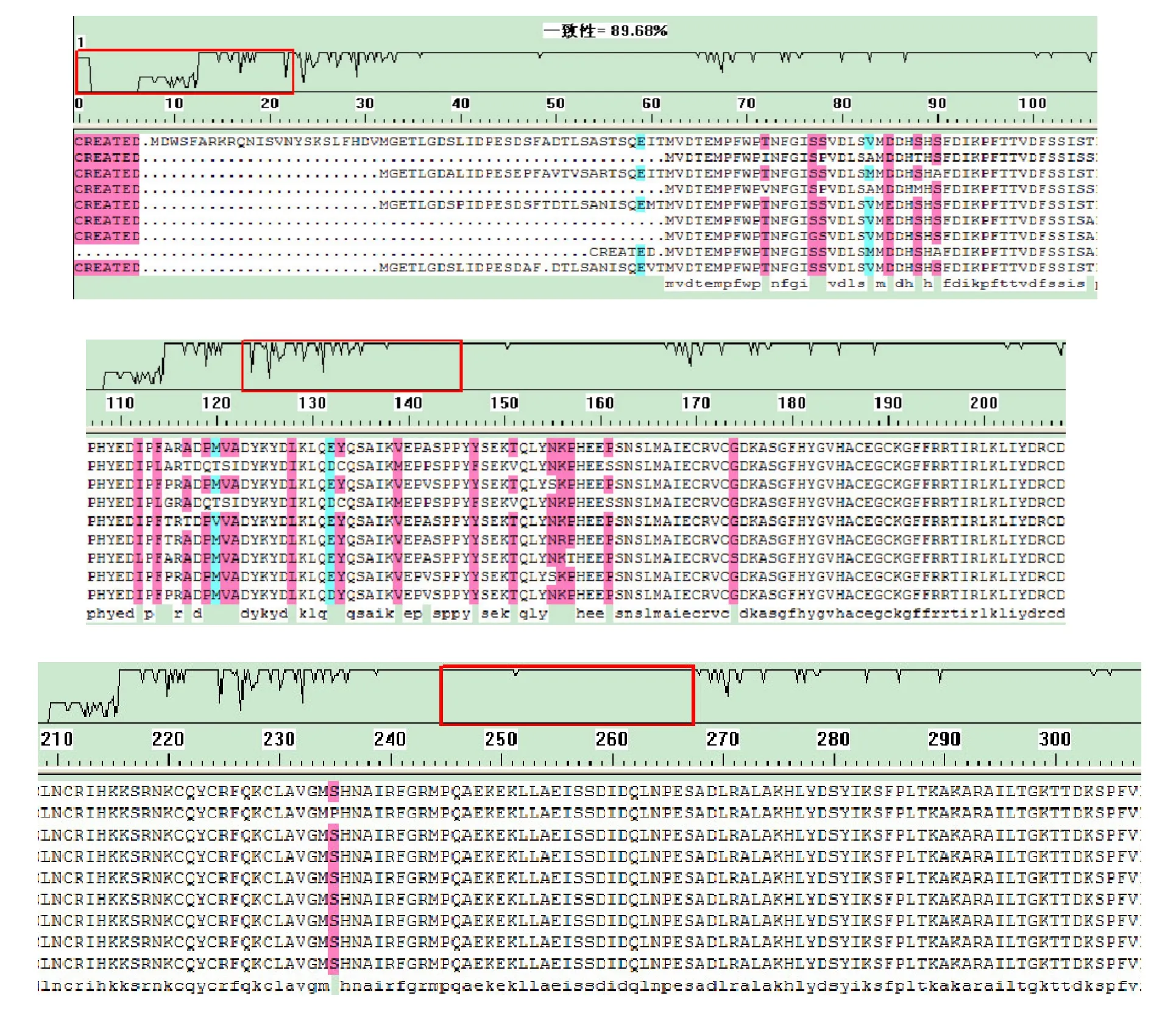

图1 9种动物PPAR-γ基因氨基酸序列比对结果Fig.1 Homology of amino acid sequence among nine species
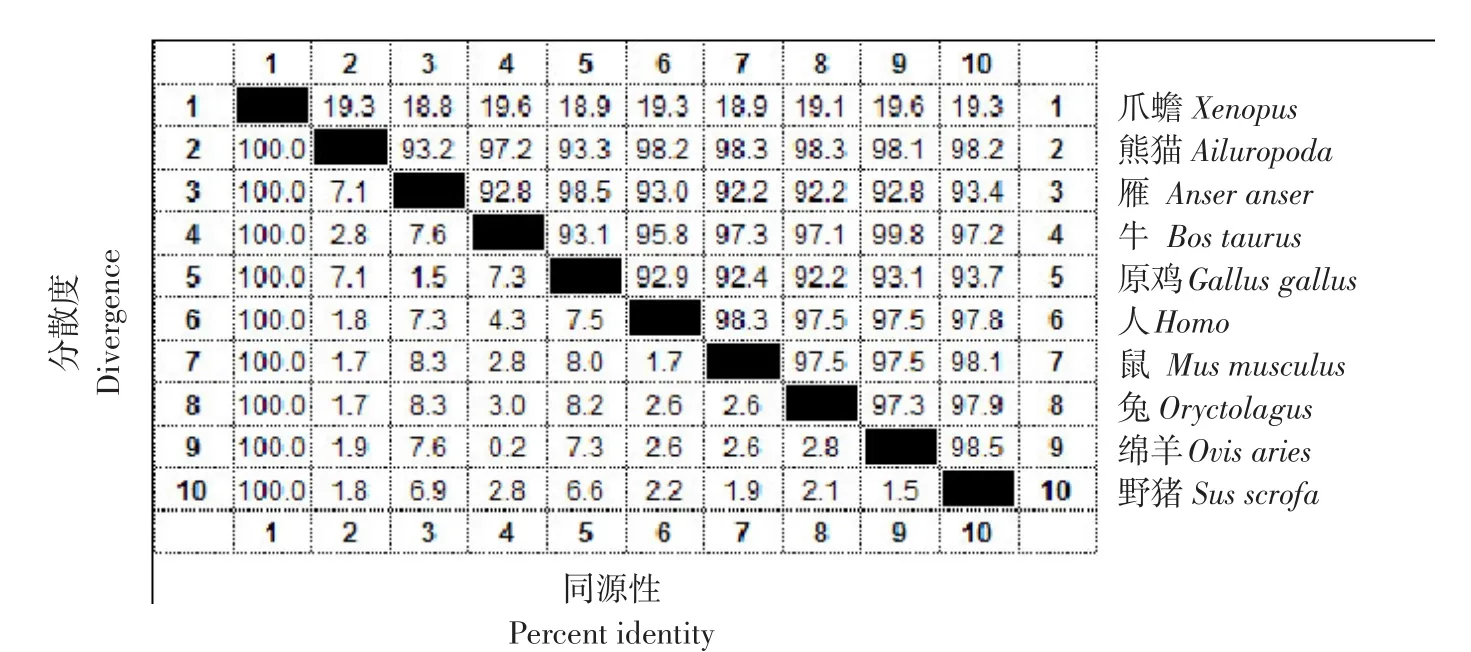
图2 10种动物的PPAR-γ基因氨基酸序列相似性百分数Fig.2 Homology of amino acid sequence among ten species
5 PPAR-γ的功能
5.1 PPAR-γ在炎症反应中的作用
PPAR-γ在许多动物炎症模型中能缓解炎症反应,因而研究提出了PPAR-γ及其配体可能对缓解对炎症反应有一定作用的推论。赖长华等试验结果表明[19],LPS刺激在导致断奶仔猪IL-1、IL-6和TNF-α mRNA表达水平升高的同时,也使PPAR-γmRNA表达量升高。Leininger等以猪为动物模型的试验显示[20],PPAR-γ在外周血白细胞中有表达,且PPAR-γ1异构体比PPAR-γ2多。PPAR-γ激动剂亦可诱导B细胞凋亡,抑制B细胞活性和增殖反应,抑制巨噬细胞活化并下调TNF-α、IL-1、IL-6等多种炎症细胞因子的表达。Gilroy等在大鼠胸膜炎模型上证实[21],PGD2与15d-PGJ2作为COX-2的抑制剂,具有抗炎作用。进一步研究发现,用15d-PGJ2或噻唑烷二酮药物治疗可抑制许多炎症介质(包括明胶酶B、IL-6、TNF-α与IL-1β)。从这些研究结果能推测出,PPAR-γ在炎症反应中可能起到重要的调控作用。
5.2 PPAR-γ在免疫调节中的作用
在免疫调节方面,Vast等研究证实PPAR-γ在巨噬细胞的分化上具有重要的作用[22]。Szatmari在人与鼠上的研究还表明,PPAR-γ可以调节树突状细胞的成熟与功能,该细胞是一种与巨噬细胞有着密切关联的抗原呈递细胞[23]。Gosset,Faveeuw等对于PPAR-γ功能的研究也表明,PPAR-γ信号影响着吞噬作用、细胞因子的生成及抗原呈递[24-25]。对于PPAR配体活化的人树突状细胞表达的分析表明,PPAR-γ对树突状细胞发育与功能的影响是直接通过脂类代谢完成的,而不是通过反式阻抑作用[26]。Bensinger and Tontonoz等证实了,哺乳动物PPAR-γ同时参与脂质代谢与免疫调节[27]。Wang等研究了冷应激对雏鸡脾脏、胸腺、法氏囊及血液淋巴细胞内PPAR-γ基因表达的影响[18],结果证实了PPAR-γ基因可能在雏鸡免疫系统的能量代谢与免疫调节上发挥着重要作用。这些研究结果表明,PPAR-γ信号是重要的免疫调节途径。
5.3 PPAR-γ在脂类代谢中的作用
PPAR-γ是脂肪组织发育的中心调控剂,其信号通路影响细胞和组织脂肪代谢。Tontonoz等首次证明PPAR-γ在脂肪生成中的作用[28]。目前对PPAR的靶基因的研究和鉴定主要集中在肝细胞和脂肪细胞,肝脏能够调控与脂类代谢紧密相关的脂肪酸、甘油三脂和酮体,通过调控脂肪酸的吸收、酯化满足机体需要[29]。脂肪组织是机体能量储存以及利用的重要场所,主要维持机体的能量代谢平衡和糖类、脂类代谢的稳定。PPAR-γ调控多种在脂类代谢不同途径的基因表达[30],包括脂肪酸转运、细胞吸收、细胞内脂肪酸结合以及分解(β氧化和ω氧化)和贮存;参与脂肪细胞的生成和转化在调节肝脏脂肪生成和肝外脂肪沉积中起重要作用。Beatrice等报道[31],PPAR可增加脂肪酸转运蛋白和脂肪酸转运酶的表达,刺激细胞对脂肪酸的摄入和向脂酰CoA的转化。PPAR是调控肝脏脂肪酸氧化酶基因表达的转录因子。
此外,有研究发现PPAR-γ是动物表皮形成、胎盘正常分化的必要因素。PPAR-γ能参与众多疾病的发展过程。在肿瘤、胰腺炎、肺炎风湿性关节炎、肝脏损伤、肾脏疾病中PPAR-γ起着举足轻重的作用。也有报道证实PPAR-γ有神经保护作用。
6 结果与展望
自PPAR-γ被发现到现在,人们对其进行了大量的研究,而且合成了多种该受体的激动剂,有一些已经应用于临床治疗。许多研究者进行体内和体外试验,均观察到PPAR-γ受体激动剂对很多疾病有良好的治疗作用。另外,PPAR-γ在免疫调节、炎症反应中的作用也是最近研究的热点。目前对PPAR-γ的研究大部分都集中在人类医学领域。在畜禽方面的研究较少,若能全面地揭示PPAR-γ功能,将其应用到畜禽病的研究当中是以后探索的目标和重点。还有PPAR-γ基因在不同物种组织中的分布情况还有待于完善。
[1] 元立峰,许梓荣.过氧化物酶体增殖剂受体与脂质代谢调控[J].中国兽药杂志,2003,37(7):33-35.
[2] Isseman I,Green S.Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J].Nature,1990,347:645-650.
[3] Vosper H,Khoudo L G,Graham T,et al.Peroxisome proliferator activated receptor agonists,hyperlipidaemia,and atherosclerosis[J].Pharmacol Ther,2002,95(1):47-62.
[4] Xu C,Wang L I,Cao Y L,et al.PPARs:Target for lipid metabolism disorder and insulin resistance therapy[J].Chin Pharmacol Bull,2004,20(3):24l-244.
[5] Berger J,Moller D E.The mechanisms of action of PPARS[J].Annu Rev Med,2002,53:409-435.
[6] Clark R B.The role of PPARs in inflammation and immunity[J].J LeukocBiol,2002,71(3):388-400.
[7] Desvergne B,Wahli W.Peroxisome proliferator activated receptors:Nuclear control of metabolism[J].Endocrine Review,1999,20(5):649-689.
[8] Olefsky J M.Treatment of insulin resistance with peroxisome proliferator activated receptor agonists[J].J Cl in Invest,2000,106(4):467-472.
[9] Vamecq J,Latruffe N.Medical significance of peroxisome proliferator activated receptors[J].Lancet,1999,354(10):141-148.
[10] Mansen A,Diaz H,Rafter J,et al.Expression of the peroxisome proliferator-activated receptor(PPAR)in the mouse colonic mucosa[J].Biochem Biophys Res Commun,1996,222:844-851.
[11] Vidal-Puig A J,Considine R V,Jimenez-Linan M,et al.Peroxisome proliferator-activated receptor gene expression in human tissues effects of obesity,weight loss and regulation by insulin and glucocorticoids[J].Clin Invest,1997,99:2416-2422.
[12] Mukherjee R,Jow L,Croston G E,et al.Identification,characterization and tissue distribution of human peroxisome proliferator activated receptor(PPAR)isoforms PPARg2 versus PPARg1 and activation with retinoid X receptor agonists and an-tagonists[J].Biol Che,1997,272:8071-8076.
[13] Kliewer S A,Forman B M,Ong E S,et al.Differential expression and activation of a family of murine peroxisome proliferator activated receptors[J].Proc Natl Acad Sci USA,1994,91:735-7359.
[14] Sato K,Fukao K,Seki Y,et al.Expression of the chicken peroxisome proliferatoractivated receptors-gamma gene is influnced by aging,nutrition and agonist administration[J].Poult Sci,2004,83(8):1342-1347.
[15] Meng H,Li H,Zhao J G,et al.Diffrential expression of peroxisome proliferator activated receptors-alpha and gamma gene in various chicken tissues[J].Domest Anim Endocrinol,2005,28(1):105-110.
[16] Hojo M,Takada I,Kimura W,et al.Expression patterns of the chicken peroxisome proliferator activated receptors during the development of the digestive organs[J]Gene Expr Patterns,2006,6(2):171-179.
[17] Sundvold H,Grindflek E,Klungland H,et al.Characterization of porcine peroxisome proliferator-activated receptorγ1 andγ2:detection of breed and age difference in gene expression[J].Bio-chemical and Biophysical Research Communications,1998,249:713-718.
[18] Wang J T,Li S,Xu S W,et al.Effects of cold stress on the messengerribonucleic acid levelsofperoxisome proliferator-activated receptor-γ in spleen,thymus,and bursa of Fabricius of chickens[J].Poultry Science,2009,404:1-6.
[19] 赖长华.共轭亚油酸对断奶仔猪免疫应激的调控[D].北京:中国农业大学,2004.
[20] Leininger M T,Portocarrero C P,Houseknecht K L.Peroxisome proliferator activated receptor gamma1 expression in porcine white bloodcells:dynamic regulation with acute endotoxemia[J].Biochem Biophys Res Commun,1999,263:749-753.
[21] Gilroy D W,Colville-Nash P R,Willis D,et al.Inducible cyclooxygenase may have anti-inflammatory properties[J].Nature Med,1999(5):698-701.
[22] Vast D,Mukundan L,Odegaard J I,et al.Oxidative metabolism and PGC-1beta attenuate marcrophage-mediated inflammation[J].Cell Metab,2006,4(1):13-24.
[23] Szatmari I,Gogolak P,Im J S,et al.Activation of PPAR gamma specifies a dendritic cell subtype capable of enhanced induction of Inkt cell expansion[J].Immunity,2004,21(1):95-106.
[24] Gosset P,Charbonnier A S,Delerive P,et al.Peroxisome proliferator-activated receptor gamma activators affect the maturation of human monocyte-derived dendritic cells[J].Eur J Immunol,2001,31(10):2857-2865.
[25] Faveeuw C,Fougeray S,Angeli V,et al.Peroxisome proliferator-activated receptor gamma activators inhibit interleukin-12 production in murine dendritic cells[J].FEBS Lett,2000,486(3):261-266.
[26] Szatmari I,Torocsik D,Agostini M,et al.PPAR gamma regulates the function of human dendritic cell primarily by altering lipid metabolism[J].Blood,2007,110(9):3271-3280.
[27] Bensinger S J,Tontonoz P.Integration of metabolism and inflammation by lipid-activated nuclear receptors[J].Nature,2008,454(7203):470-477.
[28] Tontonoz P,Hu E,and Spiegelman B M.Stimulation of adipogenesis in fibroblasts by PPAR gamma 2,a lipid-activated transcription factor[J].Cell,1994,79(7):1147-1156.
[29] TanakaY,Kamintma T,Momose H.Idenfification of regulation net works of lipid metabolism by nuelear receptors[J].Genome Informatics,2003,14:362-363.
[30] Momose H,Kaminua T,Tanaka Y.Analysis of gene regulation net work by nuelear receptor PPAR[J].Genome Imformatics,2003,14:364-365.
[31] Beatrice D,Annemieke I J,Pallavi R D,et al.The peroxisome proliferators activated receptors at the cross road of diet and hormonal signaling[J].Steroid Biochem Molev Biol,1998,65:65-74.

