西罗莫司治疗肾移植后排斥反应的疗效、不良反应与其血药浓度的相关性分析Δ
牟静,傅晓华,任斌,唐蕾#(.中山大学附属第一医院,广州市50080;.广州新海医院,广州市50300)
西罗莫司是大环内酯抗生素类免疫抑制剂,能阻断T淋巴细胞活化的后期反应(增殖),抑制细胞从G1期进入S期,阻断白细胞介素-2与其受体的结合,使Tc、Td细胞不能成为具有免疫应答作用的致敏性T淋巴细胞而发挥其免疫抑制作用[1]。临床上西罗莫司常用于防治肝肾移植术后的排斥反应,但西罗莫司具有较大的个体差异,治疗窗窄,极易发生严重不良反应,因此需对其进行血药浓度监测。本文通过对西罗莫司血药浓度与疗效、不良反应的相关性进行分析,确定其安全、有效的血药浓度范围,对及时调整给药剂量、指导临床合理用药具有重要意义。
1 对象与方法
1.1 对象
入选本研究的病例均为2006-2009年在中山大学附属第一医院接受肾移植的患者,患者的性别、年龄、体重、血药浓度、肌酐清除率、肝功能指标等资料见表1。
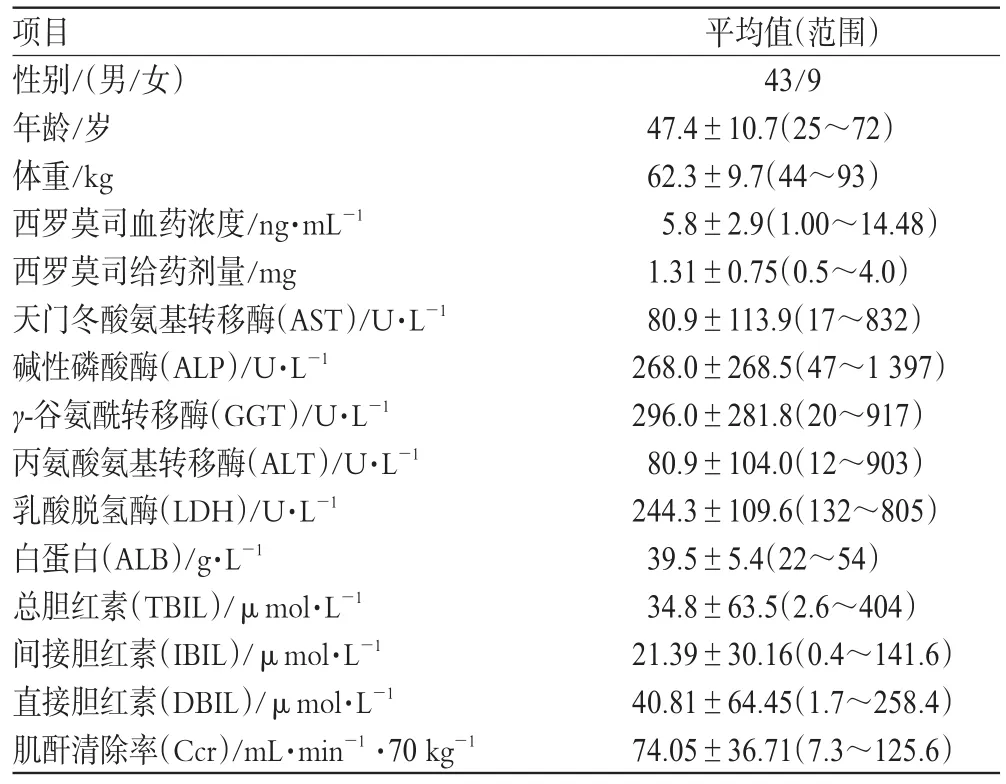
表1 肾移植病人的人口统计学资料Tab 1 Demographic data of renal transplantation patients
1.2 用药方案
患者在移植术后接受西罗莫司+泼尼松+环孢素或他克莫司或霉酚酸酯三联免疫抑制治疗,其中3名服用环孢素,36名服用他克莫司,余者服用霉酚酸酯进行联合免疫抑制治疗。
移植后48 h内开始服用西罗莫司,首次负荷剂量为6 mg,维持剂量为2 mg,每日1次。术后第7~10天测量1次西罗莫司全血谷浓度,以后每月测量1次,根据病人的临床情况调整西罗莫司的维持剂量。术中及术后2 d,ivgtt给予甲泼尼龙500 mg·d-1,以后po给予泼尼松30 mg·d-1,第3个月减量至10~20 mg·d-1,第6个月减至5~10 mg·d-1。
霉酚酸酯用量500~1 500 mg·d-1,每日2次。
他克莫司用量1~5 mg·d-1,每隔12 h分2次po给药,术后1月内血药浓度控制在8~12 ng·mL-1范围内,1年内控制在6~10 ng·mL-1范围内。
环孢素用量100~325 mg·d-1,每日2次。术后1月内谷浓度控制在200~350 ng·mL-1范围内,术后第3个月,浓度控制在150 ng·mL-1左右,至术后第6~9个月,浓度控制在50~100 ng·mL-1范围内。
研究过程中,定期常规体检,观察生命体征,定期行血常规、血生化、肝功能、肾功能、血糖、血脂、血药浓度监测等实验室检查。
1.3 实验室检查
采用高效液相色谱(HPLC)法测定患者西罗莫司稳态谷浓度,在整个治疗过程中进行治疗药物监测,以便及时调整给药剂量。
1.4 资料分析
2 结果
2.1 西罗莫司血药浓度影响因素
共收集西罗莫司血药浓度数据112份。女性患者西罗莫司平均血药浓度为(6.9±2.4)ng·mL-1,男性患者平均血药浓度为(5.6±2.9)ng·mL-1,两者差异有统计学意义(P<0.05)。血药浓度与体重呈负相关(P<0.05),与给药剂量/体重比呈正相关(P<0.05)。另外,不同年龄组(<65岁vs.>65岁)血药浓度差异无统计学意义(P>0.05)。
2.2 西罗莫司血药浓度与临床检查指标
将西罗莫司血药浓度分为<8 ng·mL-1和>8 ng·mL-1组,考察不同血药浓度组血常规、血生化等指标的差异,结果见表2。
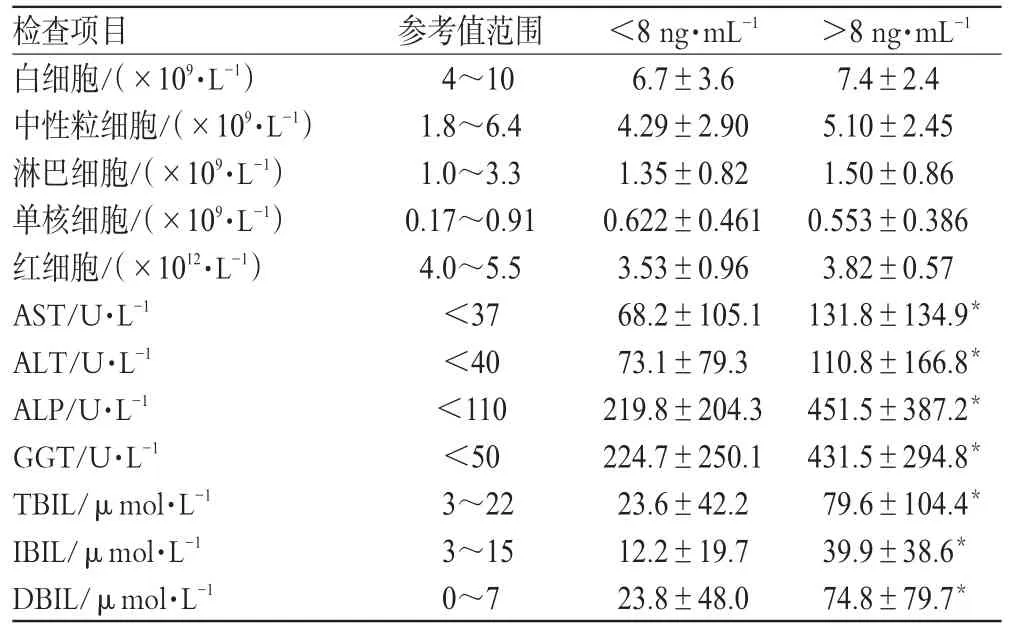
表2 西罗莫司血药浓度对临床检查指标的影响Tab 2 The influence of plasma concentration of sirolimus on clinical index
由表2可见,西罗莫司血药浓度对血常规指标没有影响(P>0.05)。患者服用西罗莫司后,其AST、ALT、ALP、GGT、DBIL、IBIL、TBIL均有升高,血药浓度>8 ng·mL-1时,其各项肝功能指标均明显高于血药浓度<8 ng·mL-1组(P<0.05)。因此,西罗莫司的血药浓度应控制在<8 ng·mL-1范围内,以减少其对肝功能的损伤。
2.3 西罗莫司血药浓度与肌酐清除率
将西罗莫司稳态谷浓度分成<4 ng·mL-1、4~8 ng·mL-1和>8 ng·mL-1组,平均肌酐清除率分别为(54.87±43.87)、(79.94±30.75)、(76.71±39.74)mL·min-1·70 kg-1,不同血药浓度组肌酐清除率有明显差异(P<0.05),血药浓度控制在4~8 ng·mL-1时,肌酐清除率最高,肾功能恢复情况最佳。
参照中点效应分析法[2],将每组中肌酐清除率大于平均肌酐清除率(74.05±36.71)mL·min-1·70 kg-1者视为有效,其例数记为fa,每组中肌酐清除率小于(74.05±36.71)mL·min-1·70 kg-1者视为无效,其例数记为fu,计算效应比值fa/fu,将fa/fu≥1的西罗莫司谷浓度组视为有效浓度组。将每组西罗莫司谷浓度与对应肌酐清除率、fa/fu作图,见图1。
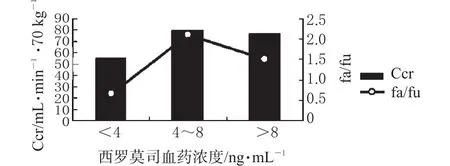
图1 肾移植病人Ccr、fa/fu与西罗莫司血药浓度的相关性Fig 1 The relationship between Ccr,fa/fu and plasma concentration of sirolimus in renal transplantation patients
由图1可见,肌酐清除率和效应比值fa/fu均随西罗莫司血药浓度的增加呈逐步上升趋势,血药浓度为4~8 ng·mL-1时,肌酐清除率和效应比值fa/fu最高;血药浓度>8 ng·mL-1时,肌酐清除率和效应比值fa/fu均下降;血药浓度<4 ng·mL-1时,效应比值fa/fu<1,视为治疗无效。
3 讨论
西罗莫司用于防治肾移植后的排斥反应,其疗效确切,但其治疗窗窄,患者个体差异较大,因此,血药浓度监测对于增强西罗莫司治疗的有效性,降低不良反应发生率,具有重要意义[3]。临床上,西罗莫司的治疗方案较多,可单独给药或与他克莫司、环孢素等联合应用,不同给药方案其血药浓度维持范围也各不相同。一般认为,血药浓度控制在6~12 ng·mL-1能有效地降低排斥反应。本研究结果表明,西罗莫司稳态谷浓度>8 ng·mL-1时,患者AST等各项肝功能指标明显升高,出现严重肝功能损伤;稳态谷浓度在4~8 ng·mL-1范围内,移植肾肌酐清除率明显升高,肾功能的恢复情况较好。故推荐临床用药时应尽量将患者的稳态谷浓度控制在4~8 ng·mL-1水平,可增加西罗莫司应用的安全性和有效性。本研究结果与国内文献报道的西罗莫司有效血药浓度一致[4]。
西罗莫司不良反应较多,主要有高脂血症、感染、肝功能异常、造血系统损伤等[4~8]。本研究中未发现严重的造血系统损伤,主要不良反应为肝功能损伤。西罗莫司在体内的药动学特征受年龄、性别、体重、种族等多种因素影响[9~12],因此,本研究对中国人服用西罗莫司后血药浓度与药物不良反应、疗效进行相关性分析,对监测西罗莫司血药浓度、制订个体化抗排斥反应方案具有重要意义。但本研究的样本量有限,可扩大样本量进行深入研究和分析,为指导西罗莫司临床合理用药提供更充分的依据。
[1] Jones K,Saadat-Lajevard S,Lee T,et al.An immunoassay for the measurement of sirolimus[J].Clin Ther,2000,22(Suppl B):49.
[2] Kovarik JM,Kaplan B,Tedesco SH,et al.Exposure-response relationships for everolimus in de novo kidney transplantation:defining a therapeutic range[J].Transplantation,2002,73(6):920.
[3] 黎曙霞,任 斌,王长希,等.固相萃取-HPLC法测定西罗莫司的血药浓度及其临床应用研究[J].中国药房,2008,19(20):1 540.
[4] 王长希,尚文俊,陈立中,等.肾移植受者应用西罗莫司治疗窗的临床研究[J].中国新药与临床杂志,2005,24(1):41.
[5] 王长希,郑克立,赵 亮,等.西罗莫司用于肾移植患者的临床前瞻性研究[J].世界临床药物,2005,26(1):55.
[6] 曹志彬,邱 丰,刘 炜,等.肾移植受者应用西罗莫司的临床疗效[J].上海交通大学学报(医学版),2006,26(6):696.
[7] 许足三,陈善群,孙建明,等.肾移植术后肺部感染21例诊治分析[J].南华大学学报(医学版),2007,35(4):628.
[8] 刘龙山,李 军,陈立中,等.以西罗莫司为基础环孢素A早期减量和撤除方案对比的临床观察[J].肾脏病与透析肾移植杂志,2008,17(2):135.
[9] TejaniA,Alexander S,Ettenger R,et al.Safety and pharmacokinetics of ascending single doses of sirolimus(Rapamune,rapamycin) in pediatric patients with stable chronic renal failure undergoing dialysis[J].Pediatr Transplant,2004,8(2):151.
[10] Dansirikul C,Duffull SB,Morris RG,et al.Relationships between sirolimus dosing,concentration and outcomes in renal transplant recipients[J].Br J Clin Pharmacol,2005,60(5):560.
[11] Zahir H,Keogh A,Akhlaghi F.Apparent clearance of sirolimus in heart transplant recipients:impact of primary diagnosis and serum lipids[J].Ther Drug Monit,2006,28(6):818.
[12] Filler G,Bendrick-Peart J,Christians U.Pharmacokinetics of mycophenolate mofetil and sirolimus in children[J].Ther Drug Monit,2008,30(2):138.

