大黄总提物的大鼠亚急性毒性*
柴宝娟,李 祥,陈建伟
南京中医药大学药学院,南京 210046
大黄为临床常用中药,近年来有文献报道大黄蒽醌类成分主要对肾脏有毒性,对肝脏毒性较小[1-3]。大黄临床上常经过配伍或炮制后给药,本课题组为考察大黄配伍之后能否降低大黄肝肾毒性,预先考察大黄产生明显肝肾毒性的毒性剂量,从而设计本实验,观察大黄总提物对大鼠亚急性毒性影响。为充分暴露大黄的整体毒性,本实验采用醇提与水提相结合的方式,制备大黄总提物,考察不同剂量下给予大黄总提物一个月后对大鼠肝肾的影响,从而为后期大黄配伍减毒时的大黄药理剂量打下基础,并为大黄临床合理用药提供依据。
1 材料与方法
1.1 材料
大黄购于安徽丰原铜陵中药饮片有限公司,经本文作者陈建伟鉴定为蓼科植物掌叶大黄Rheum palmatum L.的干燥根及根茎。
大黄总提物的制备方法:将大黄粉碎得粗粉,加10倍95%乙醇加热回流3次,每次1h,合并滤液浓缩得醇提液,滤渣挥去乙醇,加10倍量水,加热提取1h,滤液与醇提液合并,减压干燥得总提物。大黄总提物为棕色粉末,得率为49.1%。以0.5%羧甲基纤维素钠(CMCNa)将其研磨配成相应浓度的混悬液供试验用。
1.2 试验动物
实验采用上海斯莱克实验动物有限公司提供的清洁级SD大鼠40只,雌雄各半,体重180~220 g,合格证号:SCXK(沪)2007-0005。
1.3 仪器
Dimension Xpand全自动生化仪 (美国杜邦公司);ADVIA 120全自动血液分析仪 (Bayer公司);台式离心机TGL-16B(上海安亭科学仪器厂)等。
1.4 试验方法
经环境适应性饲养1周后,将动物随机分为4组,每组大鼠雌雄各5只。试验按2010版《中华人民共和国药典》规定人用大黄最高剂量(0.25g·kg-1·d-1)[4]的等效量的2倍、4倍、8倍设3个剂量组(人等效量参考文献[5]),分别为 3.0、6.0、12.0 g·kg-1·d-1(生药),同时设正常对照组。大鼠按每100g体重灌胃给药2 mL受试药混悬液,每天1次,连续给药30天。正常对照组给予同体积的0.5%CMC-Na溶液。试验动物每周称体重1次,根据体重变化调整给药量。实验期间动物自由进食饮水,每天观察动物的一般状况。末次给药禁食不禁水24 h后,眼眶静脉取血作血常规及生化指标测定,动物取血后处死,取出脾脏、胸腺、肝、肾组织进行观察和称重。
1.5 观察指标
1.5.1 一般检查 每天观察动物的一般状况:精神状态、反应、行为活动、排便情况、毛色、清洁度等。
1.5.2 血液学检查 末次给药禁食不禁水24 h后,眼眶取血1 mL,加入肝素钠抗凝,测定下列指标:红细胞计数(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT);白细胞计数(WBC)、淋巴细胞相对计数(LY)、中性粒细胞相对计数(NE)、单核细胞相对计数(Mon)。
1.5.3 血液生化指标检查 末次给药禁食不禁水24 h后,眼眶取血4 mL,离心分离血清,用全自动生化仪测定天门冬酸转氨酶 (AST)、丙氨酸转氨酶(ALT)、尿素氮(BUN)、肌酐(Crea)。
1.5.4 病理检查 大鼠解剖观察,对各脏器进行肉眼观察,将脾脏、胸腺取出称重,计算脏器指数(脏器重量/体重);取肝、肾组织,用10%中性甲醛溶液固定,脱水,石蜡包埋,切片,HE染色,镜检。
1.6 统计学分析
2 结 果
2.1 一般形态观察
给药组大鼠在给药后即排软便,粪便颜色呈棕褐色,尿液颜色呈微黄。中、高剂量组在给药2周后大鼠活动差,进食少,尿液呈深黄色,排稀便,粪便颜色灰黄色,皮毛竖立无光泽,污秽;低剂量组给药3周后皮毛清洁度较差,活动减少,精神不佳,尿液呈黄色,软便,粪便颜色呈棕黄色。
高剂量对大鼠体重增长有抑制作用,给药30天后雄性大鼠体重与对照组相比有差异,给药1周后低剂量组雌性大鼠体重与对照组相比有显著差异 (P<0.05),1 周后体重增长与对照组无显著差异(P>0.05)。
2.2 大黄总提物对大鼠血液学指标的影响
结果见表1。给药30天后高剂量组动物的Mon升高,各剂量组其余所检指标与对照组相比均无显著差异(P>0.05)。
2.3 大黄总提物对大鼠血液生化指标的影响
结果见表2。给药30天后高剂量组AST、ALT均显著高于对照组 (P<0.01),Crea与对照组相比略有降低 (P<0.05),BUN与对照组相比无差异;中、低剂量组与对照组相比,各指标无统计学差异。
表1 大黄总提物给药30天对大鼠血液细胞学指标的影响(,n=10)
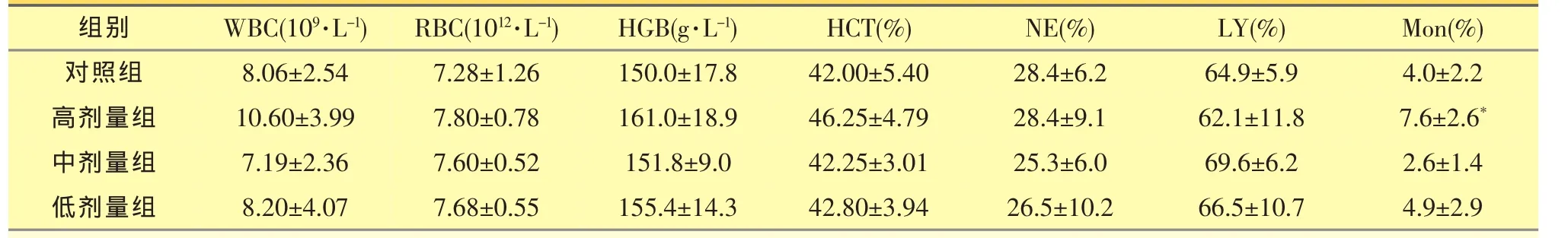
表1 大黄总提物给药30天对大鼠血液细胞学指标的影响(,n=10)
注:与对照组比较:*P<0.05,**P<0.01
表2 大黄总提物给药30天对大鼠血液生化指标的影响(,n=10)
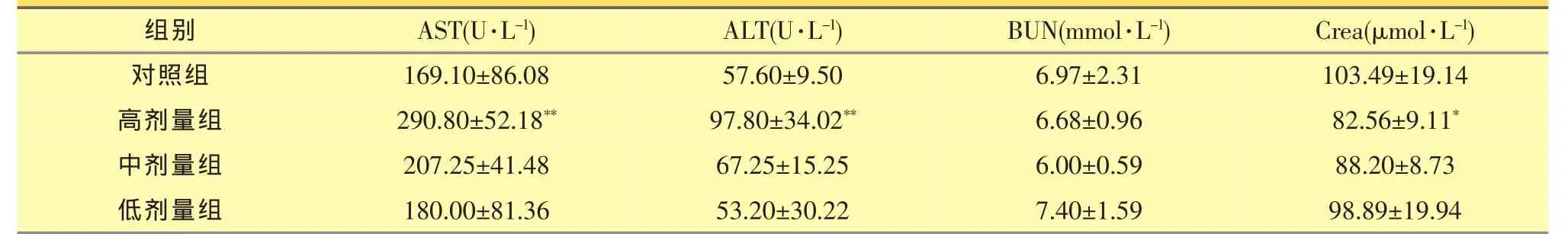
表2 大黄总提物给药30天对大鼠血液生化指标的影响(,n=10)
注:与对照组比较:*P<0.05,**P<0.01
2.4 大黄总提物对脏器指数的影响及病理组织学检查状况
给药30天后,脾脏、胸腺的脏器系数与对照组比较无显著性差异。组织学检查表明,给药30天后,高剂量组出现2例肝脏弥漫性肝细胞重度水肿,胞浆疏松淡染,1例肝脏轻度水肿;中剂量组出现1例肝脏弥漫性肝细胞轻度水肿;低剂量组未见肝脏病变。各组肾脏和对照组相比未见明显的病理改变。结果见图1。物质基础还有待研究。
3 讨 论
目前认为大黄的毒性成分为蒽醌类成分,本课题组前期研究[6]表明,大黄配伍后总蒽醌与结合蒽醌的量均有不同程度的降低,游离蒽醌降低较少,提示大黄配伍后可能会降低肝肾毒性,具体的减毒
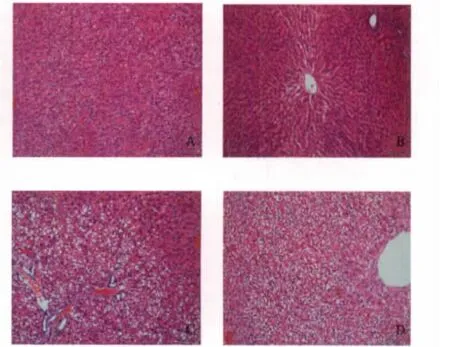
图1 大鼠肝组织病理切片图(HE×200)
实验中在测定大黄对血液细胞学指标的影响时,中剂量组有4个样本出现不同程度的血块,从而造成结果低于对照组,可能是由于取血时采用的肝素抗凝效果不佳,取血过程中造成污染引起的。此外,本实验中高中低剂量普遍不呈现剂量关系,可能由于设定的组间差距不够大以及动物间个体差异引起。
实验结果说明大黄低剂量(3 g·kg-1)连续给药30d,对大鼠的肝肾不会产生毒性作用,当剂量达到12 g·kg-1时,大鼠 ALT、AST显著性升高,病理显示肝脏出现弥漫性水肿,对大鼠的肝脏毒性作用较明显。各剂量组肾脏未显示病理病变。张陆勇[7]等对SD大鼠行大黄总蒽醌灌胃13周后,高剂量组即出现肾脏近曲小管上皮细胞不同程度肿胀变性。推测本实验未检测出肾脏毒性,可能是由于实验周期不够长。王伽伯等[8]观察大黄不同炮制品对小鼠肝肾毒性的影响,发现生大黄最大给药量(76 g·kg-1·d-1)给小鼠连续灌胃14天,出现肝肾损伤,炮制品毒性较小。本实验未出现肾毒性,也可能由于大黄剂量不足引起。
当大黄剂量达到 6 g·kg-1·d-1(相当于人最高等效剂量的4倍)时,即对大鼠产生肝毒性,高剂量时测定Crea与对照组相比降低,可能是由于大鼠给予高剂量大黄后活动明显减少,肌肉代谢降低,产生的肌酐量降低引起。本实验提示,临床大黄的最大使用量应不超过30 g·d-1,服药周期不超过一个月。
[1]王青秀,廖明阳,吴纯启.大黄及其主要成分的毒性毒理研究[J]. 毒理学杂志,2007,21(4):301.
[2]笪红远,江振洲,王翠芬,等.大黄酸和大黄素在体外对人肾小管上皮细胞的毒性作用研究[J].中草药,2009,40(1):102-5.
[3]雷 湘,陈 刚,陈科力,等.大黄素对小鼠的急性毒性研究[J]. 中药药理与临床,2008,24(1):29.
[4]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:23.
[5]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算 [J].中国临床药理学与治疗学,2004,9(9):1069-72.
[6]秦 云,李 祥,陈建伟,等.大黄中蒽醌类成分配伍前后的量变规律[J].中国实验方剂学杂志,2010,16(5):94-8.
[7]张陆勇,江振洲,濮存海,等.大黄总蒽醌对SD大鼠灌胃给药的长期毒性研究[J].中国生化药物杂志,2004,25(4):206-9.
[8]王伽伯,马永刚,张 萍,等.炮制对大黄化学成分和肝肾毒性的影响及其典型相关分析[J].药学学报,2009,44(8):885-90.

