奥拉西坦胶囊含量测定方法研究
姜 成
(辽宁雪松医药连锁有限公司,辽宁 沈阳 110101)
奥拉西坦是由意大利ISF公司1974年研究开发的吡咯烷酮类衍生物,为新一代脑代谢改善药,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。我国于1991年开始研制,目前已开发上市的制剂有片剂、胶囊、口服溶液、注射剂、冻干粉针、大输液。目前,奥拉西坦含量的测定方法有柱切换法、柱前衍生化法、凯氏定氮法和高效液相色谱法[1-7]。奥拉西坦类似物吡拉西坦[10]已经收录在中国药典中,为了更有效的控制奥拉西坦及其制剂的质量,在参考有关文献[1-10]与部颁标准WS 1005(X-750)-2002的基础上,本文采用氮测定法和高效液相色谱法对实验室自制奥拉西坦胶囊制剂中奥拉西坦含量进行研究,并比较两种方法。
1 仪器与试药
1.1 仪器
Agilent 1100高效液相色谱仪(安捷伦仪器公司);AUW220D型分析天平(岛津仪器制作所);KQ-300 型超声清洗器(昆山市超声仪器有限公司);凯氏定氮瓶。
1.2 试药
奥拉西坦原料(湖北奥翔精细化工有限公司,纯度:99.8%);奥拉西坦对照品(中国药品生物制品检定所,纯度:100%,批号:101032-200901);乙腈(天津市康科德科技有限公司);奥拉西坦胶囊(自制,批号:110412、11413、110414);氢氧化钠(天津市博迪化工有限公司);硼酸(天津市科密欧化学试剂开发中心);硫酸(沈阳经济技术开发区试剂厂);水为重蒸馏水,乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 凯氏定氮法
奥拉西坦分子结构中具有酰胺基团,该基团可被氢氧化钠水解,产生的氨气用水蒸气蒸馏,并用硼酸溶液吸收,用标准酸液进行滴定,计算其含量。取本品适量(约相当于奥拉西坦0.2g),精密称定,参照中国药典2010年版二部附录Ⅶ D氮测定法中的第一法[8],测定本品含量,测定结果,见表2。实验中空白辅料对测定无干扰,滴定度为每1mL硫酸滴定液(0.05mol/L)相当于7.908mg的C6H10N2O3,方法重复性良好,RSD为0.3%,回收率为99.6%。
2.2 高效液相色谱法
2.2.1 色谱条件
采用Inertsil NH2色谱柱(250mm×4.6mm,5μm);流动相为水-乙腈(20∶80);检测波长214nm;流速1mL/min;进样量20μL。
2.2.2 标准溶液的制备
取奥拉西坦标准品,配制成浓度为每1mL中含奥拉西坦为1mg的标准溶液,备用。
2.2.3 空白供试品溶液的制备
取按处方配制不含奥拉西坦的空白辅料,精密称定,用流动相制成空白供试品溶液,过滤,备用。
2.2.4 供试品溶液的制备
取本品装量差异项下的内容物适量(约相当于奥拉西坦0.05g),精密称定,溶解后置50mL容量瓶中,流动相定容,滤过,即得。
2.2.5 专属性试验
分别取空白供试品溶液、标准品溶液、供试品溶液20μL,注入液相色谱仪,按上述色谱条件测定,记录色谱图,结果见图1。
2.2.6 精密度试验
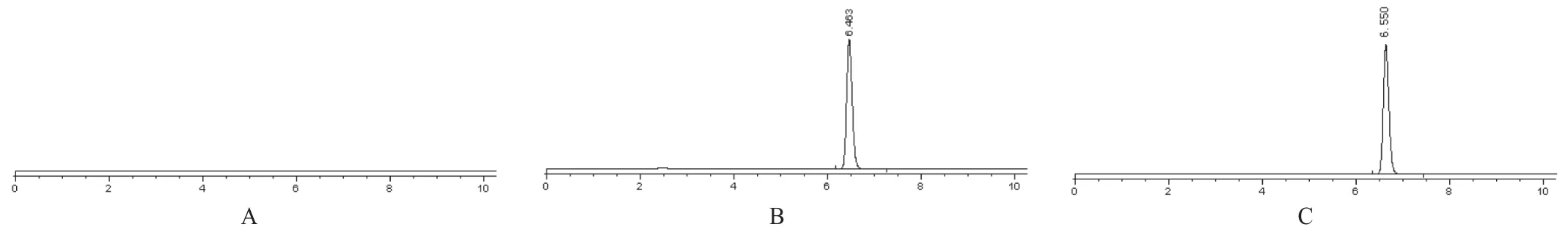
图1 A辅料空白;B奥拉西坦标准品;C奥拉西坦胶囊
在上述色谱条件下,取奥拉西坦供试品溶液,连续进样6次,每次进样20μL,色谱峰面积RSD为0.20%。
2.2.7 线性关系考察
取奥拉西坦标准品约50mg,精密称定,溶解后置10mL容量瓶中,用流动相稀释至刻度,摇匀,再分别精密吸取0.1、0.5、1.0、1.5、2.0至5mL容量瓶中,用流动相稀释至刻度,摇匀,各稀释液与母液一起构成系列标准液,各取样20μL,注入液相色谱仪,记录色谱图。以奥拉西坦标准品质量浓度X为横坐标,以色谱峰面积Y为纵坐标,进行线性回归分析,结果表明奥拉西坦标准品在0.099~1.998mg/mL质量浓度范围内,其峰面积与质量呈良好的线性关系,回归方程为:Y=22250X-122.8,r=0.9999(n=5)。
2.2.8 回收率试验
取空白辅料与奥拉西坦原料药,精密称定,按处方工艺,配成主药浓度为标示量的80%、100%、120%的模拟样品各三份,溶解后置100mL量瓶中,水定容至刻度,过滤,取滤液加流动相稀释4倍,配制成供试液,用0.45μm微孔滤膜过滤,各进样20μL,记录色谱图。按外标法以峰面积计算回收率,结果见表1。
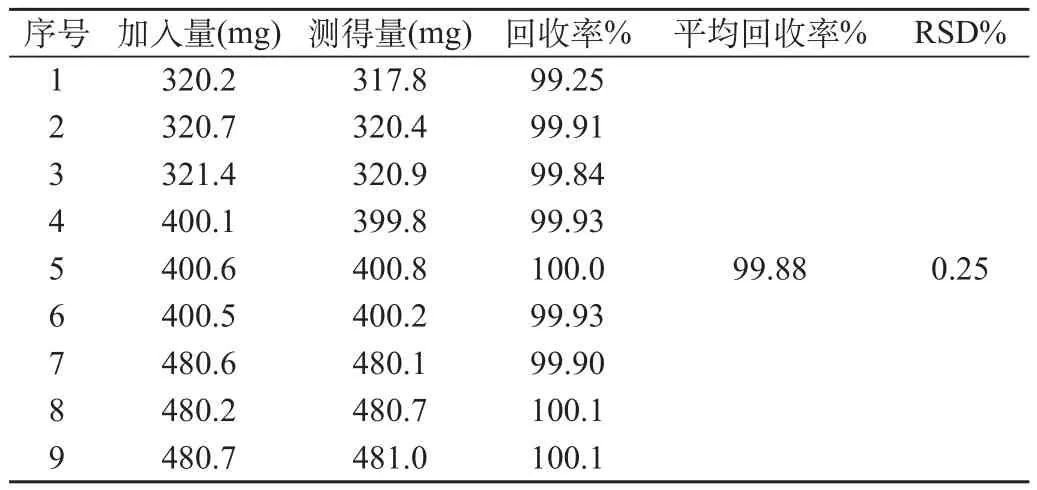
表1 回收率结果
2.2.9 溶液稳定性试验
取本品适量,按含量测定项下供试品溶液的配制方法操作,制成的供试品溶液于室温条件下放置,分别在0,2,4,8和24h各进样20μL,峰面积RSD值为0.4%。表明供试品溶液在24h内是稳定的。
2.2.10 样品测定

表2 奥拉西坦胶囊中奥拉西坦含量测定结果
按供试品溶液的制备方法制备3批供试品溶液,分别进样20μL,测定峰面积,计算3批样奥拉西坦胶囊中奥拉西坦的含量,结果见表2。
3 讨 论
奥拉西坦是一种极性很强的小分子物质,水溶性好,在有机相中分配系数小,因此采用高效液相色谱法法测其含量是使用氨基色谱柱。在参考相关文献和部颁标准的基础上,本文分别采用氮测定法和HPLC法对奥拉西坦胶囊中奥拉西坦含量进行测定,并对两种方法进行方法学研究,对3批样品的含量测定结果进行比较,结果表明两种方法的方法学试验结果都可准确的用于本品含量测定,两种方法测得3批样品的含量基本一致,但HPLC法具有专属性强、灵敏度高、重复性好等特点,为更好的控制奥拉西坦制剂质量,建议在制定质量标准中,采用HPLC法测定奥拉西坦制剂含量。
根据测定结果,结合生产实际,拟定本品含量限度:含奥拉西坦(C6H10N2O3)应为标示量的95.0%~105.0%。
[1]崔巍,李健和,阳巧凤,等.奥拉西坦注射剂中奥拉西坦2种含量测定方法的比较[J].中南药学,2010,8(11):845-847.
[2]Lecaillon JB,Souppart C,Le Duiqou F,et al.Determination of oxiracetam in plasma and urine by column 2 switching high performance liquid chramatography[J].J Chrarnatogr,1989,497(12):223-230.
[3]Pemcca E,Albriei A,Gatti G,et al.Pharmacokinetics of oxiracetam following intravenous and oral administration in healthy volunteers[J].Eur J Drug Metab Pharmacokinet,1984,9(3):267-274.
[4]林冬,陈咏昕.HPLC法测定奥拉西坦注射液中奥拉西坦的含量[J].广东药学院学报,2006,22(1):51-52.
[5]刘萍,夏钊,彭艳梅.高效液相色谱法测定奥拉西坦口服液中奥拉西坦的含量[J].中南药学,2008,6(3):304-306.
[6]国家药品监督管理局.奥拉西坦质量标准[S].WS-1005(X-750)-2002.
[7]周凤英,李慧敏,李楠.奥拉西坦胶囊含量测定方法的改进[J].中国药品标准,2006,7(4):62-64.
[8]国家药典委员会.中国药典,2010版.二部[S].北京:中国医药科技出版社,2010: Ⅶ D.
[9]崔跃,张敏月,王红雷.奥拉西坦胶囊的制备及稳定性考察[J].药学研究,2008,5(17):32-33.
[10]国家药典委员会.中国药典,2010版.二部[S].北京:中国医药科技出版社,2010: 337-339.

